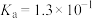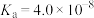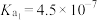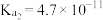工业废气中的硫化氢是一种无色有毒的气体。根据硫化氢的性质,可采取不同的处理方法。
(1)氧化法(克劳斯法),其原理是:
H2S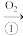 SO2
SO2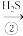 S
S
S(s)+O2(g)=SO2(g) ∆H=-297kJ·mol-1
第②步反应的热化学方程式为___________ 。
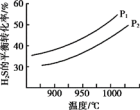
(2)热分解法,其原理是:2H2S(g) S2(?)+2H2(g)。不同温度和压强下,H2S的平衡转化率变化如图。P1
S2(?)+2H2(g)。不同温度和压强下,H2S的平衡转化率变化如图。P1___________ P2(填“>”或“<”),原因是___________ 。
(3)直接电解法,可回收S和H2。

资料:
ⅰ.H2S溶液中含硫微粒的物质的量分数随pH变化如图。
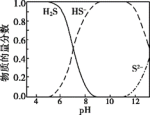
ⅱ.(x-1)S+S2− S
S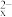 (黄色溶液);S
(黄色溶液);S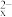 与酸反应生成S。
与酸反应生成S。
①直接电解H2S酸性溶液(pH≈5),容易出现电解反应不能持续进行的情况,结合电极反应式分析其可能的原因___________ 。
②工业上,常用烧碱吸收H2S,将吸收后的溶液(pH=13.2)先进行电解,再用电解后的黄色溶液吸收H2S生成S。反应生成S的离子方程式是___________ 。
(4)间接电解法。先用FeCl3溶液吸收含H2S的工业废气,所得溶液用惰性电极进行电解。
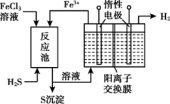
①反应池中发生反应的离子方程式是___________ 。
②该装置实验有两个显著优点:a.H2S的原子利用率100%;b.___________ 。
(5)碱性溶液吸收法。
已知:25℃时,H2S的电离常数Ka1=9.1×10-8、Ka2=1.1×10-12;H2CO3的电离常数Ka1=4.3×10-7、Ka2=5.6×10-11。用Na2CO3溶液吸收含H2S的工业废气,反应的离子方程式是___________ 。
(1)氧化法(克劳斯法),其原理是:
H2S
 SO2
SO2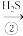 S
S已知:2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH=-1172kJ·mol-1
S(s)+O2(g)=SO2(g) ∆H=-297kJ·mol-1
第②步反应的热化学方程式为
(2)热分解法,其原理是:2H2S(g)
 S2(?)+2H2(g)。不同温度和压强下,H2S的平衡转化率变化如图。P1
S2(?)+2H2(g)。不同温度和压强下,H2S的平衡转化率变化如图。P1
(3)直接电解法,可回收S和H2。

资料:
ⅰ.H2S溶液中含硫微粒的物质的量分数随pH变化如图。

ⅱ.(x-1)S+S2−
 S
S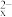 (黄色溶液);S
(黄色溶液);S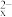 与酸反应生成S。
与酸反应生成S。①直接电解H2S酸性溶液(pH≈5),容易出现电解反应不能持续进行的情况,结合电极反应式分析其可能的原因
②工业上,常用烧碱吸收H2S,将吸收后的溶液(pH=13.2)先进行电解,再用电解后的黄色溶液吸收H2S生成S。反应生成S的离子方程式是
(4)间接电解法。先用FeCl3溶液吸收含H2S的工业废气,所得溶液用惰性电极进行电解。

①反应池中发生反应的离子方程式是
②该装置实验有两个显著优点:a.H2S的原子利用率100%;b.
(5)碱性溶液吸收法。
已知:25℃时,H2S的电离常数Ka1=9.1×10-8、Ka2=1.1×10-12;H2CO3的电离常数Ka1=4.3×10-7、Ka2=5.6×10-11。用Na2CO3溶液吸收含H2S的工业废气,反应的离子方程式是
更新时间:2024-03-28 20:06:29
|
相似题推荐
【推荐1】除去废水中Cr(Ⅵ)的方法有多种。请按要求回答下列问题。
(1)室温下,含Cr(Ⅵ)的微粒在水溶液中存在如下平衡:
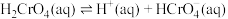

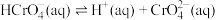
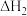
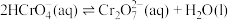

①室温下,反应
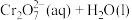 的
的
________ (用含 、
、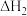 或
或 的代数式表示)。
的代数式表示)。
②基态 核外电子排布式为
核外电子排布式为________ 。
③室温下,初始浓度为 的
的 溶液中
溶液中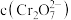 随
随 的变化如图所示。
的变化如图所示。
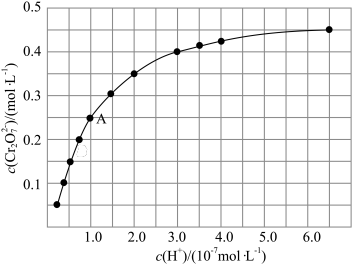
根据A点数据计算反应
 的
的
_________ ,下列关于该反应的说法不正确的是_________ 。
A.加水稀释,平衡右移,K值增大
B.若达到A点的时间为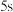 ,则
,则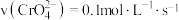
C.若升高温度,溶液中 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的
(2) 与熟石灰除Cr(VI)法:向酸性废水中加入
与熟石灰除Cr(VI)法:向酸性废水中加入 ,再加入熟石灰,使
,再加入熟石灰,使 沉淀。
沉淀。
①实验中的 作用是
作用是________ 。
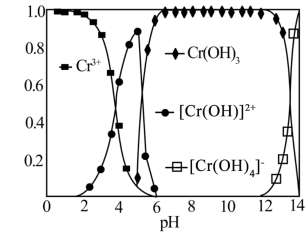
②Cr(Ⅲ)在水溶液中的存在形态分布如图所示。当 时,Cr(Ⅲ)去除率下降的原因可用离子方程式表示为
时,Cr(Ⅲ)去除率下降的原因可用离子方程式表示为_________ 。
(3)微生物法:
①用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水时,Cr(Ⅵ)去除率随温度的变化如图所示。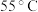 时,Cr(Ⅵ)的去除率很低的原因是
时,Cr(Ⅵ)的去除率很低的原因是____________ 。
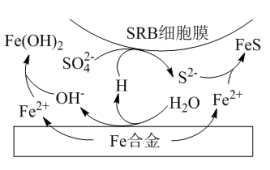
②水体中,Fe合金在SRB存在条件下腐蚀的机理如图所示。Fe腐蚀后生成FeS的过程可描述为:Fe失去电子转化为 ,
, 得到电子转化为H,
得到电子转化为H,________ 。
(4)可用电解法将废水中铬酸钾溶液制成重铬酸钾,其工作原理如图所示:
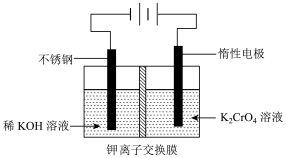
①该制备过程总反应的化学方程式为____________ 。
②电解一段时间后,阳极区溶液中 的物质的量由
的物质的量由
 变成
变成
 ,则生成的重铬酸钾的物质的量为
,则生成的重铬酸钾的物质的量为___________  。
。
(1)室温下,含Cr(Ⅵ)的微粒在水溶液中存在如下平衡:
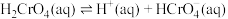

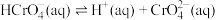
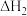
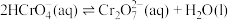

①室温下,反应

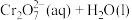 的
的
 、
、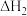 或
或 的代数式表示)。
的代数式表示)。②基态
 核外电子排布式为
核外电子排布式为③室温下,初始浓度为
 的
的 溶液中
溶液中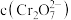 随
随 的变化如图所示。
的变化如图所示。
根据A点数据计算反应

 的
的
A.加水稀释,平衡右移,K值增大
B.若达到A点的时间为
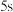 ,则
,则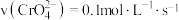
C.若升高温度,溶液中
 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的
(2)
 与熟石灰除Cr(VI)法:向酸性废水中加入
与熟石灰除Cr(VI)法:向酸性废水中加入 ,再加入熟石灰,使
,再加入熟石灰,使 沉淀。
沉淀。①实验中的
 作用是
作用是②Cr(Ⅲ)在水溶液中的存在形态分布如图所示。当
 时,Cr(Ⅲ)去除率下降的原因可用离子方程式表示为
时,Cr(Ⅲ)去除率下降的原因可用离子方程式表示为
(3)微生物法:
①用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水时,Cr(Ⅵ)去除率随温度的变化如图所示。
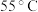 时,Cr(Ⅵ)的去除率很低的原因是
时,Cr(Ⅵ)的去除率很低的原因是
②水体中,Fe合金在SRB存在条件下腐蚀的机理如图所示。Fe腐蚀后生成FeS的过程可描述为:Fe失去电子转化为
 ,
, 得到电子转化为H,
得到电子转化为H,
(4)可用电解法将废水中铬酸钾溶液制成重铬酸钾,其工作原理如图所示:

①该制备过程总反应的化学方程式为
②电解一段时间后,阳极区溶液中
 的物质的量由
的物质的量由
 变成
变成
 ,则生成的重铬酸钾的物质的量为
,则生成的重铬酸钾的物质的量为 。
。
您最近半年使用:0次
【推荐2】氢气作为清洁能源有着广泛的应用前景,请回答下列问题:
I.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如下。
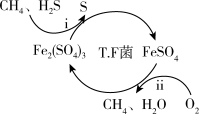
(1)过程ii的离子方程式是_______ 。
II.蒸气转化:在催化剂的作用下,水蒸气将 氧化。结合图回答问题。
氧化。结合图回答问题。
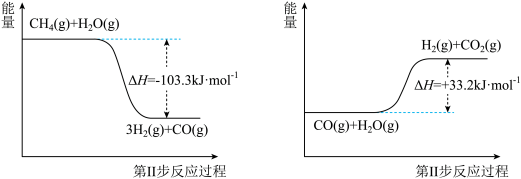
(2)写出甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式:_______ 。
(3)第II步为可逆反应。在800°C时,恒容密闭容器中CO的起始浓度为a mol/L,水蒸气的起始浓度为1.5a mol/L,达到化学平衡状态后,CO平衡转化率为60%,则此反应的平衡常数k=_______ 。
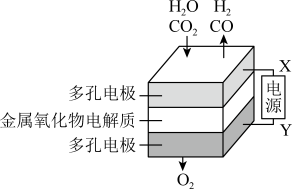
(4)在固态金属氧化物电解池中,高温共电解 混合气体制备
混合气体制备 和CO,基本原理如图所示,X是电源的
和CO,基本原理如图所示,X是电源的_______ 极(填“正”或“负”),电解池中阴极的反应式是_____ 和_______ 。
I.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如下。

(1)过程ii的离子方程式是
II.蒸气转化:在催化剂的作用下,水蒸气将
 氧化。结合图回答问题。
氧化。结合图回答问题。
(2)写出甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式:
(3)第II步为可逆反应。在800°C时,恒容密闭容器中CO的起始浓度为a mol/L,水蒸气的起始浓度为1.5a mol/L,达到化学平衡状态后,CO平衡转化率为60%,则此反应的平衡常数k=
(4)在固态金属氧化物电解池中,高温共电解
 混合气体制备
混合气体制备 和CO,基本原理如图所示,X是电源的
和CO,基本原理如图所示,X是电源的
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
(1)已知:①2Cu(s)+ O2(g)=Cu2O(s);△H=﹣169kJ•mol﹣1
O2(g)=Cu2O(s);△H=﹣169kJ•mol﹣1
②C(s)+ O2(g)=CO(g);△H=﹣110.5kJ•mol﹣1
O2(g)=CO(g);△H=﹣110.5kJ•mol﹣1
③Cu(s)+ O2(g)=CuO(s);△H=﹣157kJ•mol﹣1
O2(g)=CuO(s);△H=﹣157kJ•mol﹣1
则方法a发生的热化学方程式是:_____ 。
(2)方法c采用离子交换膜控制电解液中OH﹣的浓度而制备纳米Cu2O,装置如图所示:
该离子交换膜为_____ 离子交换膜(填“阴”或“阳”),该电池的阳极反应式为_____ ,钛极附近的pH值_____ (填“增大”“减小”或“不变”)。
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为_____ 。
(4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验:
2H2O(g)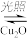 2H2(g)+O2(g)△H>0.水蒸气的浓度随时间t变化如下表所示:
2H2(g)+O2(g)△H>0.水蒸气的浓度随时间t变化如下表所示:
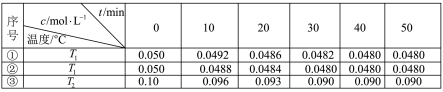
①对比实验的温度:T2_____ T1(填“>”“<”或“=”),能否通过对比实验①③到达平衡所需时间长短判断:_____ (填“能”或“否”)。
②实验①前20min的平均反应速率 v(O2)=_____
③催化剂的催化效率:实验①_____ 实验②(填“>”或“<”)。

| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
| 方法c | 电解法,反应为2Cu+H2O Cu2O+H2↑ Cu2O+H2↑ |
| 方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
(1)已知:①2Cu(s)+
 O2(g)=Cu2O(s);△H=﹣169kJ•mol﹣1
O2(g)=Cu2O(s);△H=﹣169kJ•mol﹣1②C(s)+
 O2(g)=CO(g);△H=﹣110.5kJ•mol﹣1
O2(g)=CO(g);△H=﹣110.5kJ•mol﹣1③Cu(s)+
 O2(g)=CuO(s);△H=﹣157kJ•mol﹣1
O2(g)=CuO(s);△H=﹣157kJ•mol﹣1则方法a发生的热化学方程式是:
(2)方法c采用离子交换膜控制电解液中OH﹣的浓度而制备纳米Cu2O,装置如图所示:
该离子交换膜为
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为
(4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验:
2H2O(g)
 2H2(g)+O2(g)△H>0.水蒸气的浓度随时间t变化如下表所示:
2H2(g)+O2(g)△H>0.水蒸气的浓度随时间t变化如下表所示:
①对比实验的温度:T2
②实验①前20min的平均反应速率 v(O2)=
③催化剂的催化效率:实验①

您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】Ⅰ.据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下两种:
水蒸气重整:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
二氧化碳重整:CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH3 ③
2CO(g)+2H2(g) ΔH3 ③
则反应①自发进行的条件是______________ ,ΔH3=______________ kJ·mol-1。
Ⅱ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g) 2NH3(g)。
2NH3(g)。
(2)在不同温度、压强和相同催化剂条件下,初始N2、H2分别为0.1 mol、0.3 mol时,平衡后混合物中氨的体积分数(φ)如下图所示。
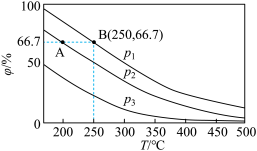
①其中,p1、p2和p3由大到小的顺序是______________________________ ,其原因是__________________________________________________________________ 。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)________ vB(N2)(填“>”“<”或“=”)。
③若在250 ℃、p1为105 Pa条件下,反应达到平衡时容器的体积为1 L,则该条件下B点N2的分压p(N2)为_____________________ Pa (分压=总压×物质的量分数,保留一位小数)。
Ⅲ.以连二硫酸根(S2O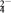 )为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:

(3)①阴极区的电极反应式为_________________________________ 。
②NO吸收转化后的主要产物为NH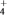 ,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为
,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为________ mL。
Ⅳ、常温下,将a mol·L-1的醋酸与b mol·L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=___________ (用含a和b的代数式表示)。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下两种:
水蒸气重整:CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②二氧化碳重整:CH4(g)+CO2(g)
 2CO(g)+2H2(g) ΔH3 ③
2CO(g)+2H2(g) ΔH3 ③则反应①自发进行的条件是
Ⅱ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)
 2NH3(g)。
2NH3(g)。(2)在不同温度、压强和相同催化剂条件下,初始N2、H2分别为0.1 mol、0.3 mol时,平衡后混合物中氨的体积分数(φ)如下图所示。

①其中,p1、p2和p3由大到小的顺序是
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)
③若在250 ℃、p1为105 Pa条件下,反应达到平衡时容器的体积为1 L,则该条件下B点N2的分压p(N2)为
Ⅲ.以连二硫酸根(S2O
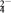 )为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
(3)①阴极区的电极反应式为
②NO吸收转化后的主要产物为NH
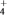 ,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为
,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为Ⅳ、常温下,将a mol·L-1的醋酸与b mol·L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】工业废气中二氧化碳的综合开发利用越来越受到人们的关注。
(1)研究CO2与CH4反应使之转化为CO和H2(合成气),可减缓燃料危机和减弱温室效应,其过程包括
反应a:CH4(g)+CO2(g) 2CO(g)+2H2(g)ΔH1=+247.3kJ·mol−1
2CO(g)+2H2(g)ΔH1=+247.3kJ·mol−1
反应b:H2(g)+CO2(g) H2O(g)+CO(g)ΔH2=+41.0kJ·mol−1
H2O(g)+CO(g)ΔH2=+41.0kJ·mol−1
①相同条件下CO2(g)+4H2(g) CH4(g)+2H2O(g)的ΔH=
CH4(g)+2H2O(g)的ΔH=_______ kJ·mol−1。
②反应a在一定条件下能够自发进行的原因是_______ ;该反应工业生产适宜的温度和压强为_______ (填标号)。
A.高温高压B.高温低压C.低温高压D.低温低压
(2)CO2催化加氢制甲醇:在一容积可变的密闭容器中,充入1molCO2与3molH2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH<0,实验测得CO2在不同温度下的平衡转化率与总压强的关系如图所示:
CH3OH(g)+H2O(g)ΔH<0,实验测得CO2在不同温度下的平衡转化率与总压强的关系如图所示:
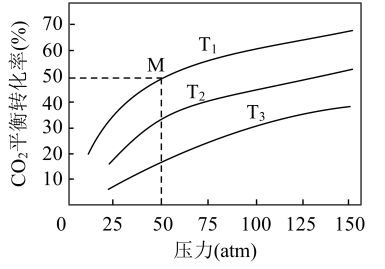
①T1、T2、T3的数值由大到小的顺序为_______ 。
②T1温度下,该反应的压强平衡常数Kp=_______ atm−2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)下列有关CO2催化加氢制甲醇的说法正确的是_______(填标号)。
(1)研究CO2与CH4反应使之转化为CO和H2(合成气),可减缓燃料危机和减弱温室效应,其过程包括
反应a:CH4(g)+CO2(g)
 2CO(g)+2H2(g)ΔH1=+247.3kJ·mol−1
2CO(g)+2H2(g)ΔH1=+247.3kJ·mol−1反应b:H2(g)+CO2(g)
 H2O(g)+CO(g)ΔH2=+41.0kJ·mol−1
H2O(g)+CO(g)ΔH2=+41.0kJ·mol−1①相同条件下CO2(g)+4H2(g)
 CH4(g)+2H2O(g)的ΔH=
CH4(g)+2H2O(g)的ΔH=②反应a在一定条件下能够自发进行的原因是
A.高温高压B.高温低压C.低温高压D.低温低压
(2)CO2催化加氢制甲醇:在一容积可变的密闭容器中,充入1molCO2与3molH2,发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)ΔH<0,实验测得CO2在不同温度下的平衡转化率与总压强的关系如图所示:
CH3OH(g)+H2O(g)ΔH<0,实验测得CO2在不同温度下的平衡转化率与总压强的关系如图所示:
①T1、T2、T3的数值由大到小的顺序为
②T1温度下,该反应的压强平衡常数Kp=
(3)下列有关CO2催化加氢制甲醇的说法正确的是_______(填标号)。
| A.延长反应时间有利于提高CH3OH的平衡产率 |
B.适当增大投料比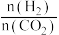 有利于提高CO2的平衡转化率, 有利于提高CO2的平衡转化率, |
| C.恒温、固定容积的密闭容器中,混合气体的密度保持不变时达到平衡 |
| D.体系达平衡后,若压缩体积,一段时间后反应再达平衡时,与原平衡相比CO2的浓度减小 |
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】铁及铁的氧化物广泛应于生产、生活、航天、科研领域。
(1)Fe2O3与CH4反应可制备“纳米级”金属铁,其反应为:3 CH4(g)+Fe2O3(s) Fe(s)+6H2(g)+3CO(g) ΔH
Fe(s)+6H2(g)+3CO(g) ΔH
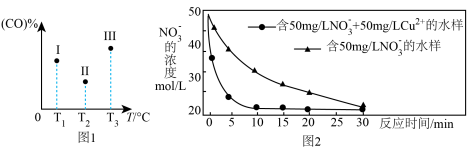
①在容积均为VL的Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中加入足量“纳米级”金属铁,然后分别充入amolCO和2amolH2,三个容器的反应温度分别保持T1、T2、T3,在其它条件相同的情况下,实验测得反应均进行到tmin时CO的体积分数如图1所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定处于化学平衡状态的是____ (填Ⅰ、Ⅱ、Ⅲ);制备“纳米级”金属铁的反应:ΔH______ 0(填“>”“<”)
②在T℃时,向某恒容密闭容器中加入3molCH4(g)和2molFe2O3(s),进行上述反应,反应起始时压强为P0,反应进行至10min时达到平衡,测得此时容器的气体压强是起始压强的2倍。T℃下该反应的KP=_______ ;T℃下若起始时该容器中加入2molCH4(g)、4molFe2O3(s)、1molFe(s)、2molH2(g)、2molCO(g),则起始时v(正)_____ v(逆)(填“>”“<”或“=”)
(2)纳米铁粉与水中NO 反应的离子方程式为4Fe+NO
反应的离子方程式为4Fe+NO +10H+=4Fe2++NH
+10H+=4Fe2++NH +3H2O
+3H2O
①研究发现,若pH偏低将会导致NO 的去除率下降,其原因是
的去除率下降,其原因是___ 。
②相同条件下,纳米铁粉去除不同水样中NO 的速率有较大差异,图2中所产生的差异的可能原因是
的速率有较大差异,图2中所产生的差异的可能原因是 ____________ 。(答一条)
(1)Fe2O3与CH4反应可制备“纳米级”金属铁,其反应为:3 CH4(g)+Fe2O3(s)
 Fe(s)+6H2(g)+3CO(g) ΔH
Fe(s)+6H2(g)+3CO(g) ΔH①在容积均为VL的Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中加入足量“纳米级”金属铁,然后分别充入amolCO和2amolH2,三个容器的反应温度分别保持T1、T2、T3,在其它条件相同的情况下,实验测得反应均进行到tmin时CO的体积分数如图1所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定处于化学平衡状态的是

②在T℃时,向某恒容密闭容器中加入3molCH4(g)和2molFe2O3(s),进行上述反应,反应起始时压强为P0,反应进行至10min时达到平衡,测得此时容器的气体压强是起始压强的2倍。T℃下该反应的KP=
(2)纳米铁粉与水中NO
 反应的离子方程式为4Fe+NO
反应的离子方程式为4Fe+NO +10H+=4Fe2++NH
+10H+=4Fe2++NH +3H2O
+3H2O①研究发现,若pH偏低将会导致NO
 的去除率下降,其原因是
的去除率下降,其原因是②相同条件下,纳米铁粉去除不同水样中NO
 的速率有较大差异,图2中所产生的差异的可能原因是
的速率有较大差异,图2中所产生的差异的可能原因是
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】碳酸二甲酯[(CH3O)2CO,DMC]是一种重要的绿色化工原料,可以利用CO、O2与甲醇在PdCl2-CuCl2/AC催化剂作用下,反应得到,容器中发生如下3个反应:
反应①:2CH3OH(g)+CO(g)+1/2O2(g) DMC(g)+H2O(g)ΔH1
DMC(g)+H2O(g)ΔH1
反应②:CO(g)+1/2O2(g) CO2(g)ΔH2<0
CO2(g)ΔH2<0
反应③:DMC(g)+H2O(g) 2CH3OH(g)+CO2(g)ΔH3>0
2CH3OH(g)+CO2(g)ΔH3>0
请回答:
(1)反应①在一定条件下能自发进行,判断ΔH1_____ 0(填:<、>或=)
(2)下列说法正确的是:
(3)探究该反应进行的最佳温度和最佳CO/O2体积比,某兴趣小组查阅资料,在确定甲醇体积分数为0.20,压强为0.3MPa的条件下进行实验。
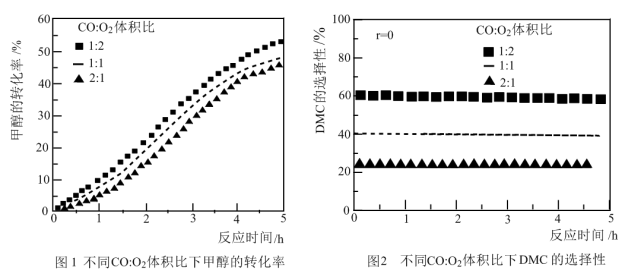
①在一定温度下,改变CO/O2体积比,得到甲醇平均转化率(图1)、DMC选择性(图2)随时间的变化关系。试问0~5h内最适宜的CO/O2体积比是_____ 。
②固定CO/O2体积比和压强,改变温度,记录DMC的物质的量(I)、甲醇的物质的量(II)和CO2的物质的量(III)如图3所示。试问该反应最适宜的温度为_____ ,理由是_____ 。

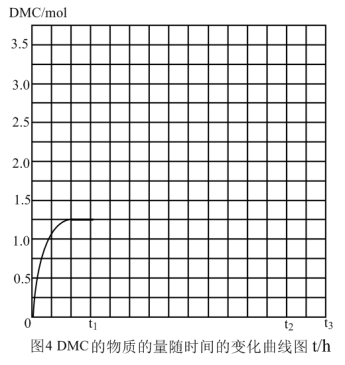
③反应①在0.3MPa、400K时,甲醇的平衡转化率为52.0%,DMC的选择性为65.0%。现向某装置中加入20mol的甲醇和一定量的CO、O2,反应的起始温度为480K,在t1时刻,降低温度至400K,反应至t2重新达到平衡。试画出t1~t3时刻DMC的物质的量随时间的变化曲线_____ 。
(4)有研究表明,以铂为电极,在离子液体-CH3OK-甲醇体系中常温常压下,CO2和甲醇电催化合成DMC。在离子液体环境下,CH3OK可电离出CH3O-;而甲醇在此环境下,用K做电子转移促进剂,可直接解离成与CH3OK相同的CH3O-。试写出该状态下阳极电极方程式_____ 。
反应①:2CH3OH(g)+CO(g)+1/2O2(g)
 DMC(g)+H2O(g)ΔH1
DMC(g)+H2O(g)ΔH1反应②:CO(g)+1/2O2(g)
 CO2(g)ΔH2<0
CO2(g)ΔH2<0反应③:DMC(g)+H2O(g)
 2CH3OH(g)+CO2(g)ΔH3>0
2CH3OH(g)+CO2(g)ΔH3>0请回答:
(1)反应①在一定条件下能自发进行,判断ΔH1
(2)下列说法正确的是:
| A.在恒容容器中达平衡的反应③,在温度升高的同时带来容器内压强变大,因此平衡逆向移动 |
| B.在恒温恒容容器中达平衡的反应②,充入一定量CO2(g),重新达平衡后,CO2的体积分数大于原平衡,平衡正向移动 |
| C.当合成DMC容器中甲醇和CO2的物质的量之比不再变化时,反应③一定达到平衡状态 |
| D.反应②随着温度的升高,平衡逆向移动,平衡常数减小,正反应速率增大,逆反应速率减小 |
①在一定温度下,改变CO/O2体积比,得到甲醇平均转化率(图1)、DMC选择性(图2)随时间的变化关系。试问0~5h内最适宜的CO/O2体积比是

②固定CO/O2体积比和压强,改变温度,记录DMC的物质的量(I)、甲醇的物质的量(II)和CO2的物质的量(III)如图3所示。试问该反应最适宜的温度为

③反应①在0.3MPa、400K时,甲醇的平衡转化率为52.0%,DMC的选择性为65.0%。现向某装置中加入20mol的甲醇和一定量的CO、O2,反应的起始温度为480K,在t1时刻,降低温度至400K,反应至t2重新达到平衡。试画出t1~t3时刻DMC的物质的量随时间的变化曲线

(4)有研究表明,以铂为电极,在离子液体-CH3OK-甲醇体系中常温常压下,CO2和甲醇电催化合成DMC。在离子液体环境下,CH3OK可电离出CH3O-;而甲醇在此环境下,用K做电子转移促进剂,可直接解离成与CH3OK相同的CH3O-。试写出该状态下阳极电极方程式
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某化学兴趣小组进行有关电解食盐水的探究实验,电解装置如图所示。

I.实验一:电解饱和食盐水。
(1)电解饱和食盐水的化学方程式为___________ 。
II.实验二:电解不饱和食盐水及产物分析。
相同条件下,电解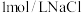 溶液并收集两极产生的气体。在
溶液并收集两极产生的气体。在 处收集到
处收集到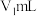 气体。同时,在
气体。同时,在 处收集到
处收集到 气体,停止电解。结果发现
气体,停止电解。结果发现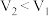 ,且与电解饱和食盐水相比,
,且与电解饱和食盐水相比, 处收集到的气体颜色明显较浅。经讨论分析,导致上述现象的原因有:
处收集到的气体颜色明显较浅。经讨论分析,导致上述现象的原因有:
i.有部分 溶于溶液中;
溶于溶液中;
ii.有 生成。
生成。
(2)设计实验证明有部分 溶于
溶于 溶液中,实验方案为
溶液中,实验方案为___________ 。
(3)证明有 生成并测定
生成并测定 的体积。按如下图所示装置进行实验,通过注射器缓缓地将在
的体积。按如下图所示装置进行实验,通过注射器缓缓地将在 处收集到
处收集到 气体全部推入装置
气体全部推入装置 (盛有足量试剂
(盛有足量试剂 溶液)中,最终,量气管中收集到
溶液)中,最终,量气管中收集到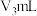 气体(设
气体(设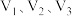 均在相同条件下测得)。
均在相同条件下测得)。
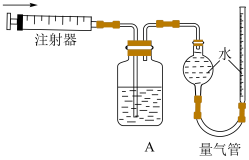
①装置 的作用是
的作用是___________ 。
②本实验中,观察到___________ 的现象,说明石墨电极上有 生成。
生成。
③实验中是否需要预先除尽装置中的空气?___________ (填“是”或“否”)。
(4)实验二中,在石墨电极上产生的 的总体积为
的总体积为___________  (用代数式表示)。
(用代数式表示)。

I.实验一:电解饱和食盐水。
(1)电解饱和食盐水的化学方程式为
II.实验二:电解不饱和食盐水及产物分析。
相同条件下,电解
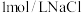 溶液并收集两极产生的气体。在
溶液并收集两极产生的气体。在 处收集到
处收集到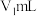 气体。同时,在
气体。同时,在 处收集到
处收集到 气体,停止电解。结果发现
气体,停止电解。结果发现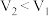 ,且与电解饱和食盐水相比,
,且与电解饱和食盐水相比, 处收集到的气体颜色明显较浅。经讨论分析,导致上述现象的原因有:
处收集到的气体颜色明显较浅。经讨论分析,导致上述现象的原因有:i.有部分
 溶于溶液中;
溶于溶液中;ii.有
 生成。
生成。(2)设计实验证明有部分
 溶于
溶于 溶液中,实验方案为
溶液中,实验方案为(3)证明有
 生成并测定
生成并测定 的体积。按如下图所示装置进行实验,通过注射器缓缓地将在
的体积。按如下图所示装置进行实验,通过注射器缓缓地将在 处收集到
处收集到 气体全部推入装置
气体全部推入装置 (盛有足量试剂
(盛有足量试剂 溶液)中,最终,量气管中收集到
溶液)中,最终,量气管中收集到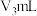 气体(设
气体(设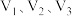 均在相同条件下测得)。
均在相同条件下测得)。
①装置
 的作用是
的作用是②本实验中,观察到
 生成。
生成。③实验中是否需要预先除尽装置中的空气?
(4)实验二中,在石墨电极上产生的
 的总体积为
的总体积为 (用代数式表示)。
(用代数式表示)。
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】甲烷催化裂解是工业上制备乙炔的方法之一。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890 kJ·mol-1
C2H2(g)+ O2(g)=2CO2(g)+H2O(l) ΔH2=-1 300 kJ·mol-1
O2(g)=2CO2(g)+H2O(l) ΔH2=-1 300 kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH3=-572 kJ·mol-1
则2CH4(g) C2H2(g)+3H2(g) ΔH=
C2H2(g)+3H2(g) ΔH=________ kJ·mol-1。
(2)某科研小组尝试利用固体表面催化工艺进行CH4的裂解。
①若用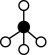 、
、 、
、 和
和 分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最低的是
分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最低的是________ (填字母)。

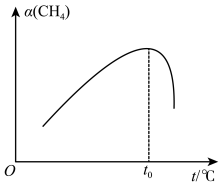
②在恒容密闭容器中充入a mol甲烷,测得单位时间内在固体催化剂表面CH4的转化率[α(CH4)]与温度(t)的关系如图所示,t0℃后CH4的转化率突减的原因可能是_______ 。
(3)甲烷分解体系中几种气体的平衡分压(p,单位为Pa)与温度(t,单位为℃)的关系如图所示:
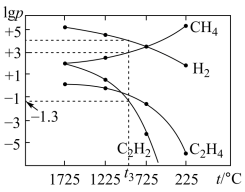
①t1℃时,向V L恒容密闭容器中充入0.12 mol CH4,只发生反应2CH4(g) C2H4(g)+2H2(g),达到平衡时,测得p(C2H4)=p(CH4),CH4的平衡转化率为
C2H4(g)+2H2(g),达到平衡时,测得p(C2H4)=p(CH4),CH4的平衡转化率为________ 。(保留3位有效数字)若改变温度至t2℃,CH4以0.01mol/(L· s)的平均速率增多,则t1________ t2(填“>”“=”或“<”)。
②在图中,t3℃时,化学反应2CH4(g) C2H2(g)+3H2(g)的压强平衡常数Kp=
C2H2(g)+3H2(g)的压强平衡常数Kp=____ 。
(4)工业上,以石墨为电极,电解亚铁氰化钾K4[Fe(CN)6]溶液可以制备铁氰化钾{K3[Fe(CN)6],可用于检验Fe2+},阳极的电极反应式为____________ 。
(5)设计如图实验探究牺牲阳极的阴极保护法原理:
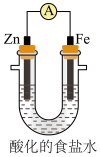
得出结论:①锌______ 保护铁;(填“能”或“不能”)
②产生蓝色沉淀可以得出铁被铁氰化钾氧化生成______ 。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890 kJ·mol-1
C2H2(g)+
 O2(g)=2CO2(g)+H2O(l) ΔH2=-1 300 kJ·mol-1
O2(g)=2CO2(g)+H2O(l) ΔH2=-1 300 kJ·mol-12H2(g)+O2(g)=2H2O(l) ΔH3=-572 kJ·mol-1
则2CH4(g)
 C2H2(g)+3H2(g) ΔH=
C2H2(g)+3H2(g) ΔH=(2)某科研小组尝试利用固体表面催化工艺进行CH4的裂解。
①若用
 、
、 、
、 和
和 分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最低的是
分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最低的是
②在恒容密闭容器中充入a mol甲烷,测得单位时间内在固体催化剂表面CH4的转化率[α(CH4)]与温度(t)的关系如图所示,t0℃后CH4的转化率突减的原因可能是

(3)甲烷分解体系中几种气体的平衡分压(p,单位为Pa)与温度(t,单位为℃)的关系如图所示:

①t1℃时,向V L恒容密闭容器中充入0.12 mol CH4,只发生反应2CH4(g)
 C2H4(g)+2H2(g),达到平衡时,测得p(C2H4)=p(CH4),CH4的平衡转化率为
C2H4(g)+2H2(g),达到平衡时,测得p(C2H4)=p(CH4),CH4的平衡转化率为②在图中,t3℃时,化学反应2CH4(g)
 C2H2(g)+3H2(g)的压强平衡常数Kp=
C2H2(g)+3H2(g)的压强平衡常数Kp=(4)工业上,以石墨为电极,电解亚铁氰化钾K4[Fe(CN)6]溶液可以制备铁氰化钾{K3[Fe(CN)6],可用于检验Fe2+},阳极的电极反应式为
(5)设计如图实验探究牺牲阳极的阴极保护法原理:

| 操作 | 现象 |
| (i)取铁极附近的溶液于试管中,滴加铁氰化钾溶液 | 无明显现象 |
| (ii)在U形管铁极附近滴加铁氰化钾溶液 | 产生蓝色沉淀 |
②产生蓝色沉淀可以得出铁被铁氰化钾氧化生成
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】已知25℃时,部分弱酸的电离平衡常数如下表:
(1)25℃时,在 的
的 溶液中由水电离出来的
溶液中由水电离出来的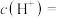
__________ .
(2) 溶液显
溶液显_________ 性,用离子方程式表示原因____________ ;请写出少量 通入到过量的
通入到过量的 溶液中发生反应的离子方程式:
溶液中发生反应的离子方程式:_________________________ .
(3) 溶液中加少量的
溶液中加少量的 固体,电离平衡
固体,电离平衡__________ 移动(填“正向”、“逆向”或“不”);体积均为100mL,pH均为2的 与一元酸HX溶液,加水稀释过程中pH与溶液体积的关系如图1所示,则
与一元酸HX溶液,加水稀释过程中pH与溶液体积的关系如图1所示,则
_________ (填“>”或“<”)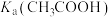 .
.
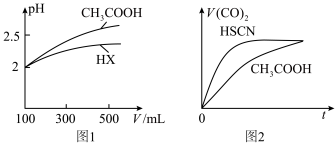
(4)25℃时,将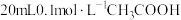 溶液和
溶液和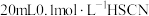 溶液分别与
溶液分别与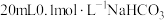 溶液混合,实验测得产生的气体体积
溶液混合,实验测得产生的气体体积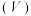 随时间
随时间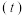 的变化如图2所示:反应初始阶段两种溶液产生
的变化如图2所示:反应初始阶段两种溶液产生 气体的速率存在明显差异的原因是
气体的速率存在明显差异的原因是________________________ ;假设混合后,两份溶液的体积仍相等,则反应结束后所得两溶液中,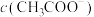
_____________ (填“>”、“<”或“=”) 
弱酸 |
|
|
|
|
电离平衡常数 |
|
|
|
|
(1)25℃时,在
 的
的 溶液中由水电离出来的
溶液中由水电离出来的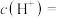
(2)
 溶液显
溶液显 通入到过量的
通入到过量的 溶液中发生反应的离子方程式:
溶液中发生反应的离子方程式:(3)
 溶液中加少量的
溶液中加少量的 固体,电离平衡
固体,电离平衡 与一元酸HX溶液,加水稀释过程中pH与溶液体积的关系如图1所示,则
与一元酸HX溶液,加水稀释过程中pH与溶液体积的关系如图1所示,则
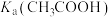 .
.
(4)25℃时,将
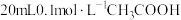 溶液和
溶液和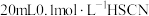 溶液分别与
溶液分别与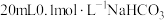 溶液混合,实验测得产生的气体体积
溶液混合,实验测得产生的气体体积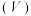 随时间
随时间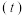 的变化如图2所示:反应初始阶段两种溶液产生
的变化如图2所示:反应初始阶段两种溶液产生 气体的速率存在明显差异的原因是
气体的速率存在明显差异的原因是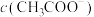

您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】Ⅰ.盐类水解知识。
(1)氯化铁水溶液呈___________ 性,原因是用离子方程式表示:___________ ;把 溶液蒸干,灼烧,最后得到的主要固体产物是
溶液蒸干,灼烧,最后得到的主要固体产物是___________ ;普通泡沫灭火器是利用溶液跟溶液混合,产生大量的气体和沉淀,气体将混合物压出灭火器,相关反应的离子方程式是:_________ 。
Ⅱ.已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
(2)物质的量浓度均为0.1 的四种溶液:pH由小到大排列的顺序是
的四种溶液:pH由小到大排列的顺序是___________ (用编号填写)
a. b.
b. c.NaClO d.
c.NaClO d.
(3)常温下,0.1
 溶液加水稀释过程中,下列表达式的数据变大的是
溶液加水稀释过程中,下列表达式的数据变大的是________
A. B.
B. C.
C.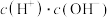
D. E.
E.
(4)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:___________ 。
(5)25℃时,将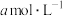 的醋酸与
的醋酸与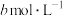 氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为
氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为___________ 。
(1)氯化铁水溶液呈
 溶液蒸干,灼烧,最后得到的主要固体产物是
溶液蒸干,灼烧,最后得到的主要固体产物是Ⅱ.已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
| 化学式 |  | 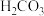 | HClO |
| 电离平衡常数 | 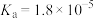 | 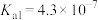 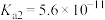 |  |
 的四种溶液:pH由小到大排列的顺序是
的四种溶液:pH由小到大排列的顺序是a.
 b.
b. c.NaClO d.
c.NaClO d.
(3)常温下,0.1

 溶液加水稀释过程中,下列表达式的数据变大的是
溶液加水稀释过程中,下列表达式的数据变大的是A.
 B.
B. C.
C.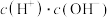
D.
 E.
E.
(4)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
(5)25℃时,将
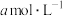 的醋酸与
的醋酸与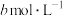 氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为
氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】回答下列问题:
(1)已知PH3与NH3结构相似,PH3的电子式___________ ,键角PH3___________ NH3(填“大于”“小于”“等于”,下同),热稳定性:PH3___________ NH3。
(2)Fe、Ni元素性质非常相似,属于铁系元素,得到广泛应用。
①Fe元素位于元素周期表的___________ 区(填分区)。
②基态Ni3+核外电子排布式为___________ 。
(3)鉴定Ni2+的特征反应是将丁二酮肟加入Ni2+盐溶液中,生成鲜红色的螯合物M,M结构如下图所示:

①组成M的五种元素中,除H元素外,另外四种元素第一电离能由大到小的顺序为___________ (填元素符号),
②图中各微粒间不存在的作用力有___________ (填标号)。
a. 配位键 b.极性键 c.非极性键 d.π键 e.离子键 f.氢键
(4)如图为H3BO3晶体的片层结构,其中B的杂化方式为___________ 。
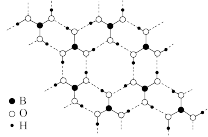
(5)硼酸(H3BO3)为一元弱酸,电离方程式H3BO3+H2O⇌H++B(OH) 。已知:H3BO3的电离常数Ka=5.8×10﹣10,H2CO3的电离常数Ka1=4.4×10﹣7、Ka2=4.7×10﹣11,向饱和硼酸溶液中滴加少量Na2CO3溶液,写出发生反应的离子方程式
。已知:H3BO3的电离常数Ka=5.8×10﹣10,H2CO3的电离常数Ka1=4.4×10﹣7、Ka2=4.7×10﹣11,向饱和硼酸溶液中滴加少量Na2CO3溶液,写出发生反应的离子方程式___________ 。
(1)已知PH3与NH3结构相似,PH3的电子式
(2)Fe、Ni元素性质非常相似,属于铁系元素,得到广泛应用。
①Fe元素位于元素周期表的
②基态Ni3+核外电子排布式为
(3)鉴定Ni2+的特征反应是将丁二酮肟加入Ni2+盐溶液中,生成鲜红色的螯合物M,M结构如下图所示:

①组成M的五种元素中,除H元素外,另外四种元素第一电离能由大到小的顺序为
②图中各微粒间不存在的作用力有
a. 配位键 b.极性键 c.非极性键 d.π键 e.离子键 f.氢键
(4)如图为H3BO3晶体的片层结构,其中B的杂化方式为

(5)硼酸(H3BO3)为一元弱酸,电离方程式H3BO3+H2O⇌H++B(OH)
 。已知:H3BO3的电离常数Ka=5.8×10﹣10,H2CO3的电离常数Ka1=4.4×10﹣7、Ka2=4.7×10﹣11,向饱和硼酸溶液中滴加少量Na2CO3溶液,写出发生反应的离子方程式
。已知:H3BO3的电离常数Ka=5.8×10﹣10,H2CO3的电离常数Ka1=4.4×10﹣7、Ka2=4.7×10﹣11,向饱和硼酸溶液中滴加少量Na2CO3溶液,写出发生反应的离子方程式
您最近半年使用:0次