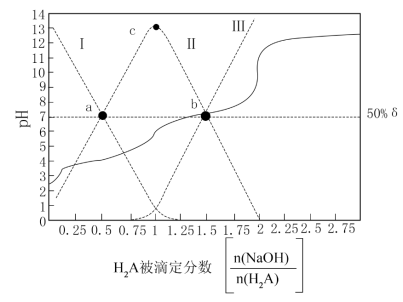
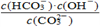琥珀酸(丁二酸,简记为 )为二元弱酸。常温下,在含
)为二元弱酸。常温下,在含 和
和 的混合液中滴加
的混合液中滴加 溶液,溶液
溶液,溶液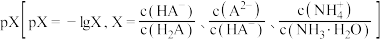 与
与 的关系如图所示。
的关系如图所示。
 )为二元弱酸。常温下,在含
)为二元弱酸。常温下,在含 和
和 的混合液中滴加
的混合液中滴加 溶液,溶液
溶液,溶液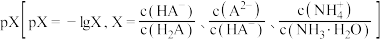 与
与 的关系如图所示。
的关系如图所示。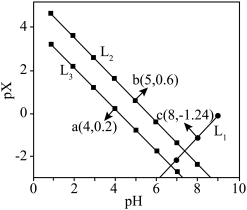
A.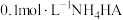 溶液中: 溶液中: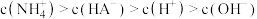 |
B.当 时, 时,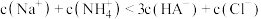 |
C.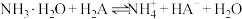 的平衡常数K小于 的平衡常数K小于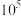 |
D. 和 和 直线交点坐标为(7.42,-1.82) 直线交点坐标为(7.42,-1.82) |
更新时间:2024-05-31 07:17:24
|
相似题推荐
单选题
|
较难
(0.4)
解题方法
【推荐1】将盐酸分别滴加到 和
和 浊液中,体系中
浊液中,体系中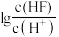 与
与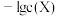 (
( 为
为 、
、 、
、 )的变化关系如图所示。已知
)的变化关系如图所示。已知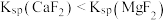 ,下列说法错误的是
,下列说法错误的是
 和
和 浊液中,体系中
浊液中,体系中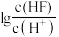 与
与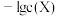 (
( 为
为 、
、 、
、 )的变化关系如图所示。已知
)的变化关系如图所示。已知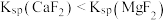 ,下列说法错误的是
,下列说法错误的是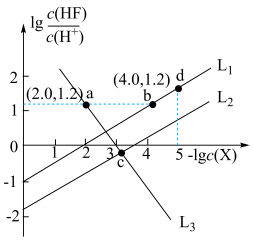
A. 表示 表示 与 与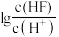 的变化曲线 的变化曲线 |
B.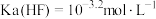 |
C.c点溶液中: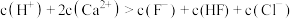 (不考虑水的电离因素) (不考虑水的电离因素) |
D. 点坐标为 点坐标为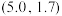 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】在25°C时,向a mL 0.10mol·L-1的HNO2溶液中逐滴加入0.10mol·L-1的NaOH溶液,滴定过程中,混合溶液的pOH[pOH= -lgc(OH-)]与NaOH溶液的体积V的关系如图所示。已知P点溶液中存在c(OH-)=c(H+)+c(HNO2),下列说法不正确的是( )


| A.25°C时,HNO2电离常数的数量级是10-4 |
| B.M点溶液中存在:3c(H+)+ c(HNO2)=3c(OH-)+ c(NO2-) |
| C.图上M、N、P、Q四点溶液中所含离子的种类相同 |
| D.a=10.80 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】下列溶液中各微粒的浓度关系正确的是
| A.常温下,将0.1mol·L-1NH4CI溶液与0.05mol·L-1NaOH溶液等体积混合:c(C1-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
| B.在小苏打溶液中存在:c(HCO3-)=c(Na+)-c(CO32-)-c(H2CO3) |
| C.向CH3COOH溶液中加入适量的NaOH,得到pH=4的混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.pH=3的一元酸HX和PH=11的一元碱MOH等体积混合:c(M+)=c(X-)>c(H+)=c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如下图所示。下列有关叙述正确的是
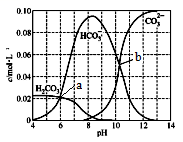

| A.b点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-) |
| B.随pH增大,c(CO32-)/c(HCO3-)数值先减小后增大 |
| C.25℃时,碳酸的第一步电离常数Ka1=10-6 |
| D.溶液呈中性时:c(HCO3- )>c(Cl-)>c(CO32-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】下列说法正确的是


| A.等体积等物质的量浓度的CH3COONa(aq)与NaCl(aq)中离子总数大小:N前=N后 |
| B.常温下醋酸和醋酸钠混合溶液中c (CH3COOH)、c (CH3COO-)与pH值的关系如图所示,当pH=4.5溶液中:c (CH3COO-)> c (CH3COOH)> c (H+)> c (OH-) |
| C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:2 c(Na+)=c(CH3COO-)+ c(CH3COOH) |
| D.pH相等的盐酸与醋酸溶液,c(Cl-)>c(CH3COO-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】室温下,向100mL 0.1mol·L-1乙二胺溶液中滴加0.1 mol·L-1盐酸,乙二胺溶液中含氮粒子的物质的量分数δ随溶液pH的变化曲线如图所示[已知:乙二胺(H2NCH2CH2NH2)与NH3相似,水溶液呈碱性],下列说法错误的是
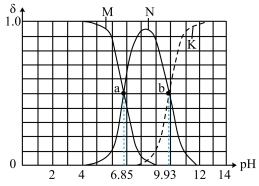

| A.曲线M表示的粒子是H2NCH2CH2NH2 |
| B.由图可知[H3NCH2CH2NH3]2+的一级水解常数Kh1=10-6.85 |
| C.b点所处的溶液中:c(H+)+c([H2NCH2CH2NH3]+)=c(OH-)+c(C1-) |
| D.当溶液的pH=7时,滴加盐酸的体积小于200 mL |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】下列有关电解质溶液的说法正确的是( )
A.向0.1mol CH3COOH溶液中加入少量水,溶液中 CH3COOH溶液中加入少量水,溶液中 减小 减小 |
B.将CH3COONa溶液从20℃升温至30℃,溶液中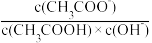 增大 增大 |
C.0.1 mol/L Na2CO3与0.1 mol/L NaHCO3等体积混合:3c(Na+)=2[c(CO )+c(HCO )+c(HCO )+c(H2CO3)] )+c(H2CO3)] |
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中 不变 不变 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】 具有较强还原性,其溶于水生成的氢硫酸是一种弱酸(
具有较强还原性,其溶于水生成的氢硫酸是一种弱酸(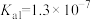 、
、 )。用
)。用 溶液吸收
溶液吸收 得
得 溶液。下列说法正确的是
溶液。下列说法正确的是
 具有较强还原性,其溶于水生成的氢硫酸是一种弱酸(
具有较强还原性,其溶于水生成的氢硫酸是一种弱酸(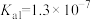 、
、 )。用
)。用 溶液吸收
溶液吸收 得
得 溶液。下列说法正确的是
溶液。下列说法正确的是A.升高 溶液的温度,一定能提高 溶液的温度,一定能提高 的吸收率 的吸收率 |
B.25℃时,若 溶液中 溶液中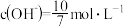 ,则 ,则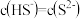 |
C.向 溶液中加入足量浓硝酸,反应生成气体,其主要成分为 溶液中加入足量浓硝酸,反应生成气体,其主要成分为 |
D. [ [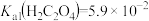 ]能与 ]能与 发生反应: 发生反应: |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
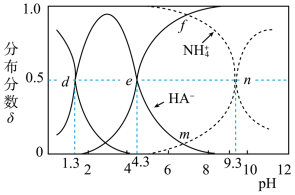
【推荐1】乙二酸(用 表示)为二元弱酸。
表示)为二元弱酸。 时,向
时,向 的
的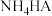 溶液中滴加适量的盐酸或
溶液中滴加适量的盐酸或 溶液,溶液中各含氮(或A)微粒的分布分数
溶液,溶液中各含氮(或A)微粒的分布分数 与溶液
与溶液 的关系如图所示(不考虑溶液中
的关系如图所示(不考虑溶液中 分子)。例如,溶液中
分子)。例如,溶液中 的分布分数
的分布分数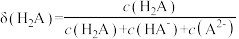 。下列说法正确的是
。下列说法正确的是
 表示)为二元弱酸。
表示)为二元弱酸。 时,向
时,向 的
的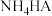 溶液中滴加适量的盐酸或
溶液中滴加适量的盐酸或 溶液,溶液中各含氮(或A)微粒的分布分数
溶液,溶液中各含氮(或A)微粒的分布分数 与溶液
与溶液 的关系如图所示(不考虑溶液中
的关系如图所示(不考虑溶液中 分子)。例如,溶液中
分子)。例如,溶液中 的分布分数
的分布分数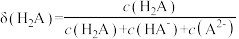 。下列说法正确的是
。下列说法正确的是
A.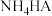 溶液中: 溶液中: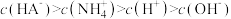 |
B. 的溶液中: 的溶液中: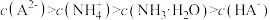 |
C.d点溶液中: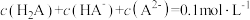 |
D.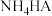 溶液中滴加少量 溶液中滴加少量 溶液的主要反应离子方程式: 溶液的主要反应离子方程式: |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】 溶液中含铁微粒的分布系数与pH的关系如图所示。下列说法错误的是
溶液中含铁微粒的分布系数与pH的关系如图所示。下列说法错误的是
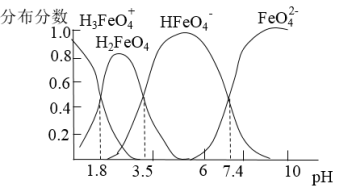
 溶液中含铁微粒的分布系数与pH的关系如图所示。下列说法错误的是
溶液中含铁微粒的分布系数与pH的关系如图所示。下列说法错误的是
A.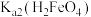 的数量级为 的数量级为 |
B.当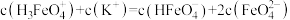 时,溶液一定呈中性 时,溶液一定呈中性 |
C.向pH=2的这种溶液中加氢氧化钠至pH=10,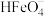 的分布分数逐渐增大 的分布分数逐渐增大 |
D.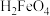 既能与强酸又能与强碱反应 既能与强酸又能与强碱反应 |
您最近一年使用:0次