合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
(1)①由上表数据可知该反应为_____ (填放热,吸热,无法确定 )反应。
②下列措施能用勒夏特列原理解释是_____ (填序号)。
a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500°C左右 d.需要使用过量的N2,提高H2转化率
(2)0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液反应放热QkJ,请你用热化学方程式表示其反应式_____ 。
(3)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl﹣),则一水合氨的电离平衡常数Kb=_____ (用ab表示)。
(4)原料气H2可通过反应 CH4(g)+H2O (g) CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的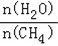 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:

①图中,两条曲线表示压强的关系是:P1_____ P2(填“>”、“=”或“<”)。
②其它条件一定,升高温度,氢气的产率会__ (填“增大”,“减小”减小,“不变”不变)。
(5)原料气H2还可通过反应CO(g)+H2O(g) CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L﹣1,该温度下反应的平衡常数K值为_____ 。
②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_____ (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
| 温 度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表数据可知该反应为
②下列措施能用勒夏特列原理解释是
a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500°C左右 d.需要使用过量的N2,提高H2转化率
(2)0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液反应放热QkJ,请你用热化学方程式表示其反应式
(3)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl﹣),则一水合氨的电离平衡常数Kb=
(4)原料气H2可通过反应 CH4(g)+H2O (g)
 CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的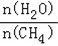 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是:P1
②其它条件一定,升高温度,氢气的产率会
(5)原料气H2还可通过反应CO(g)+H2O(g)
 CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L﹣1,该温度下反应的平衡常数K值为
②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
16-17高二上·湖北宜昌·期末 查看更多[11]
广西南宁市第十中学2020-2021学年高二上学期期中考试化学(理)试题河南省漯河市临颍县南街高级中学2019-2020学年高二下学期阶段性测试化学试题安徽省枞阳县浮山中学2019-2020学年高二下学期开学考试化学试题内蒙古自治区包头市第六中学2018-2019学年高二上学期期中考试化学试题新疆维吾尔自治区第二师华山中学2018-2019学年高二上学期期中考试化学试题河南省西华县第一高级中学2017-2018学年高二上学期期末选拔考试化学试题江西省上高县第二中学2017-2018学年高二上学期期末考试化学试题安徽省淮南市第二中学2017-2018学年高二上学期第二次月考化学试题安徽省淮北市第一中学2017-2018学年高二上学期第四次月考(12月)化学试题湖北省宜昌市部分重点中学2016-2017学年高二上学期期末化学试题2016-2017学年湖北省宜昌市部分重点中学高二上学期期末考试化学试卷
更新时间:2017-03-06 20:51:29
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】分类思想是化学重要的学科思想。下表是对部分常见的 18 电子微粒的分类。
请结合表格中的微粒(或由微粒组成的物质)完成下列问题:
(1)根据分类时呈现的规律,可推知表格中:①_________ ②_______ (填分子式)
(2)热稳定性:H2S____ SiH4(填“>”、“<”或“=”)还原性:Cl- ___ S2-(填“>”、“<”或“=”)
(3)KHS的电子式为______ , CaO2和 N2H4均含有____ 键(填“离子”、“极性”“非极性'”)
(4)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2)当它们混合时 , 即产 生大量的N2和水蒸气,并放出大量热。已知 0.2mol 液态肼 和足量H2O2反应,生成氮气和水蒸气, 放出 Q kJ 的热量。写出该反应的热化学方程式____ 。
(5)已知拆开 lmolHCl 分子中的化学键需要消耗 431kJ 能量, 根据下面的能量图,回答下列问题:
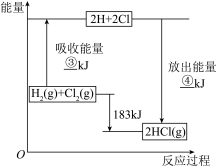
分别写出③、④ 的数值:③______ kJ;④______ kJ。
(6)已知在常温常压下:
2CH3OH(l)+ 3O2(g)=2CO2(g)+4H2O(g) ΔH= -1275.6kJ/mol
H2O(l)= H2O(g) ΔH = + .44.0kJ/mol
写出表示甲醇燃烧热的热化学方程式_______ 。
| 分子 | Ar |
| HCl H2S ① SiH4 | |
| F2 H2O2 N2H4 ② | |
| CH3F CH3OH | |
| 阳离子 | K+ Ca2+ |
| 阴离子 | Cl- S2- |
HS- O |
请结合表格中的微粒(或由微粒组成的物质)完成下列问题:
(1)根据分类时呈现的规律,可推知表格中:①
(2)热稳定性:H2S
(3)KHS的电子式为
(4)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2)当它们混合时 , 即产 生大量的N2和水蒸气,并放出大量热。已知 0.2mol 液态肼 和足量H2O2反应,生成氮气和水蒸气, 放出 Q kJ 的热量。写出该反应的热化学方程式
(5)已知拆开 lmolHCl 分子中的化学键需要消耗 431kJ 能量, 根据下面的能量图,回答下列问题:

分别写出③、④ 的数值:③
(6)已知在常温常压下:
2CH3OH(l)+ 3O2(g)=2CO2(g)+4H2O(g) ΔH= -1275.6kJ/mol
H2O(l)= H2O(g) ΔH = + .44.0kJ/mol
写出表示甲醇燃烧热的热化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】图中X、Y、Z为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应,回答下列问题:
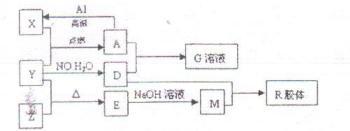
(1)组成单质Y的元素在周期表中的位置是__________ ;M中存在的化学键类型为_______ ;R的化学式是__________ 。
(2)已知A与1mol Al反应转化为X时(所有物质均为固体),放出akJ热量。写出该反应的热化学方程式:__________
(3)写出A和D的稀溶液反应生成G的离子方程式:__________

(1)组成单质Y的元素在周期表中的位置是
(2)已知A与1mol Al反应转化为X时(所有物质均为固体),放出akJ热量。写出该反应的热化学方程式:
(3)写出A和D的稀溶液反应生成G的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】白磷(P4)与氯气反应的能量变化如图所示。回答下列问题:___________ 。
(2)PCl5(g)=PCl3(g)+Cl2(g) H=
H=___________ 88kJ/mol。
(3)写出白磷蒸气在氯气中反应生成五氯化磷气体的热化学方程式:___________ 。
(4)甲醇是人们开发和利用的一种新能源。已知:
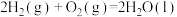
 kJ/mol
kJ/mol
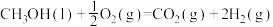
 kJ/mol
kJ/mol
①上述第二个反应的能量变化如图所示,则
___________ kJ/mol。(用 、
、 的相关式子表示);
的相关式子表示);
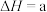 kJ/mol,试根据表中所列键能数据估算
kJ/mol,试根据表中所列键能数据估算
___________ 。
(5)火箭推进器中盛有强还原剂液态肼( )和强氧化剂液态双氧水,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量,写出该反应的热化学方程式:
)和强氧化剂液态双氧水,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量,写出该反应的热化学方程式:___________ 。

(2)PCl5(g)=PCl3(g)+Cl2(g)
 H=
H=(3)写出白磷蒸气在氯气中反应生成五氯化磷气体的热化学方程式:
(4)甲醇是人们开发和利用的一种新能源。已知:
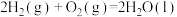
 kJ/mol
kJ/mol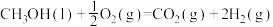
 kJ/mol
kJ/mol①上述第二个反应的能量变化如图所示,则

 、
、 的相关式子表示);
的相关式子表示);

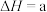 kJ/mol,试根据表中所列键能数据估算
kJ/mol,试根据表中所列键能数据估算
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ/mol | 436 | 391 | 945 |
 )和强氧化剂液态双氧水,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量,写出该反应的热化学方程式:
)和强氧化剂液态双氧水,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量,写出该反应的热化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】合成氨的反应对人类解决粮食问题贡献巨大。合成氨反应的化学方程式为N2(g)+3H2(g) 2NH3(g),回答下列问题:
2NH3(g),回答下列问题:
(1)已知键能:H-H436kJ•mol-1,N-H391kJ•mol-1,N≡N946kJ•mol-1。则N2(g)+3H2(g) 2NH3(g)反应中生成17gNH3
2NH3(g)反应中生成17gNH3_____ (填“吸收”或“放出”)_____ kJ热量。
(2)恒温下,将amolN2与bmolH2的混合气体通入2L的恒容密闭容器中,进行合成氨反应,当反应进行到5s时,有0.1molNH3生成。
①0~5s内用H2表示该反应的平均反应速率v(H2)=_____ mol•L-1•s-1。
②实验测得反应进行到t时刻时,nt(N2)=3mol,nt(H2)=8mol,nt(NH3)=6mol,则a=_____ ,b=_____ 。
③再经一段时间后反应达到平衡,此时混合气体总物质的量为13mol,则平衡时NH3的物质的量为_____ mol。
④下列可以说明该反应达到平衡状态的是_____ (填标号)。
A.c(N2):c(NH3)=1:2 B.3v正(H2)=2v逆(NH3)
C.容器内气体的密度不再变化 D.混合气体的压强不再变化
⑤若在不同条件下进行上述反应,测得反应速率分别为
Ⅰ.v(N2)=0.3mol•L-1•min-1
Ⅱ.v(H2)=0.4mol•L-1•min-1
Ⅲ.n(NH3)=0.5mol•L-1•min-1
其中反应速率最慢的是_____ (填标号)。
 2NH3(g),回答下列问题:
2NH3(g),回答下列问题:(1)已知键能:H-H436kJ•mol-1,N-H391kJ•mol-1,N≡N946kJ•mol-1。则N2(g)+3H2(g)
 2NH3(g)反应中生成17gNH3
2NH3(g)反应中生成17gNH3(2)恒温下,将amolN2与bmolH2的混合气体通入2L的恒容密闭容器中,进行合成氨反应,当反应进行到5s时,有0.1molNH3生成。
①0~5s内用H2表示该反应的平均反应速率v(H2)=
②实验测得反应进行到t时刻时,nt(N2)=3mol,nt(H2)=8mol,nt(NH3)=6mol,则a=
③再经一段时间后反应达到平衡,此时混合气体总物质的量为13mol,则平衡时NH3的物质的量为
④下列可以说明该反应达到平衡状态的是
A.c(N2):c(NH3)=1:2 B.3v正(H2)=2v逆(NH3)
C.容器内气体的密度不再变化 D.混合气体的压强不再变化
⑤若在不同条件下进行上述反应,测得反应速率分别为
Ⅰ.v(N2)=0.3mol•L-1•min-1
Ⅱ.v(H2)=0.4mol•L-1•min-1
Ⅲ.n(NH3)=0.5mol•L-1•min-1
其中反应速率最慢的是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】在300℃时,X、Y、Z三种气体在恒容密闭容器中反应时的法度变化知图所示:

请回答下列问题:
(1)该反应的化学方程式为_______ ,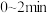 内的反应速率
内的反应速率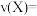
_______ 。
(2)a、b、c三个相等的时间段内,X物质的浓度减少量的相对大小为_______ (用a、b、c表示)。
(3)下列事实能表明300℃时该反应处于平衡状态的是_______(填序号)。

请回答下列问题:
(1)该反应的化学方程式为
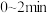 内的反应速率
内的反应速率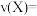
(2)a、b、c三个相等的时间段内,X物质的浓度减少量的相对大小为
(3)下列事实能表明300℃时该反应处于平衡状态的是_______(填序号)。
| A.容器内气体压强保持不变 | B.生成Y、Z的速率之比为 |
| C.气体的密度保持不变 | D. |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g) CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
(1)该反应的平衡常数表达式K=__ ;根据图,升高温度,K值将__ (填“增大”、“减小”或“不变”)。
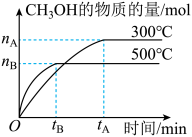
(2)500℃时,从反应开始到化学平衡状态,以H2的浓度变化表示的化学反应速率是__ (用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是__ (填字母,下同)。
a.υ生成(CH3OH)=υ消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的 ,在其他条件不变的情况下,对平衡体系产生的影响是
,在其他条件不变的情况下,对平衡体系产生的影响是____ 。
a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加 d.重新平衡时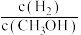 减小
减小
 CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。(1)该反应的平衡常数表达式K=

(2)500℃时,从反应开始到化学平衡状态,以H2的浓度变化表示的化学反应速率是
(3)判断该可逆反应达到化学平衡状态的标志是
a.υ生成(CH3OH)=υ消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的
 ,在其他条件不变的情况下,对平衡体系产生的影响是
,在其他条件不变的情况下,对平衡体系产生的影响是a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加 d.重新平衡时
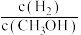 减小
减小
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)氢气可用于制备H2O2。已知:
H2(g)+A(l)=B(l) ΔH1
O2(g)+B(l)=A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g)=H2O2(l)的ΔH__ 0(填“>”、“<”或“=”)。
(2)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g) MHx+2y(s)ΔH<0达到化学平衡。下列有关叙述正确的是
MHx+2y(s)ΔH<0达到化学平衡。下列有关叙述正确的是___ 。
a.容器内气体压强保持不变
b.吸收ymolH2只需1molMHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(1)氢气可用于制备H2O2。已知:
H2(g)+A(l)=B(l) ΔH1
O2(g)+B(l)=A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g)=H2O2(l)的ΔH
(2)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)
 MHx+2y(s)ΔH<0达到化学平衡。下列有关叙述正确的是
MHx+2y(s)ΔH<0达到化学平衡。下列有关叙述正确的是a.容器内气体压强保持不变
b.吸收ymolH2只需1molMHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】化学平衡图像分析
(1)对于反应
 ,
,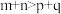
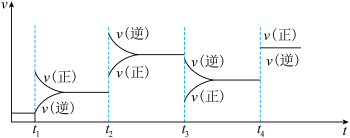
上图中各时间点改变的条件是
_______ ;
_______ ;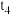
_______ 。
(2)可逆反应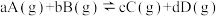
 ,同时符合下列两图中各曲线,
,同时符合下列两图中各曲线,

则
_______ 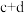

_______ 

_______ 0(填“>”、“<”或“=”)
(3)某化学科研小组研究在其他条件不变时,改变某一条件对反应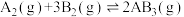 的化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量)
的化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量)

根据图像得出的结论,若正反应吸热,则
_______  (填“>”、“<”或“=”),对于a、b、c三点:
(填“>”、“<”或“=”),对于a、b、c三点: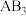 的平衡体积分数由大到小为
的平衡体积分数由大到小为_______ , 的平衡转化率由大到小为
的平衡转化率由大到小为_______ , 的平衡转化率由大到小为
的平衡转化率由大到小为_______ 。
(4)对于化学反应 ,L线上所有的点都是平衡点。
,L线上所有的点都是平衡点。

则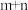
_______ 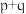 ,E点
,E点
_______  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(1)对于反应

 ,
,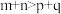

上图中各时间点改变的条件是


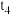
(2)可逆反应
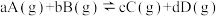
 ,同时符合下列两图中各曲线,
,同时符合下列两图中各曲线,
则

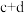



(3)某化学科研小组研究在其他条件不变时,改变某一条件对反应
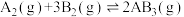 的化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量)
的化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量)
根据图像得出的结论,若正反应吸热,则

 (填“>”、“<”或“=”),对于a、b、c三点:
(填“>”、“<”或“=”),对于a、b、c三点: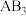 的平衡体积分数由大到小为
的平衡体积分数由大到小为 的平衡转化率由大到小为
的平衡转化率由大到小为 的平衡转化率由大到小为
的平衡转化率由大到小为(4)对于化学反应
 ,L线上所有的点都是平衡点。
,L线上所有的点都是平衡点。
则
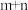
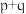 ,E点
,E点
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】2017年5月5日,中国首架按照国际标准研制,拥有自主知识产权的大型客机C-919在上海浦东机场首飞,科学家在实验室研究利用催化技术将飞机尾气中的NO和CO转变成CO2和N2,其反应为2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH<0。
N2(g)+2CO2(g) ΔH<0。
(1)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是____________ 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(2)若将1 molNO和2 mol CO通入2 L的恒容密闭容器中,在一定条件下发生上述反应,反应中生成的N2的物质的量浓度随时间的变化情况如图1所示。则NO从反应开始到平衡时的平均反应速率v(NO)=_________ ,4 min末CO的浓度为_____________ mol•L-1。
(3)已知上述反应中NO的平衡转化率与压强、温度的关系如图2所示。工业上催化装置比较适合的温度和压强是____________________ 。

 N2(g)+2CO2(g) ΔH<0。
N2(g)+2CO2(g) ΔH<0。(1)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(2)若将1 molNO和2 mol CO通入2 L的恒容密闭容器中,在一定条件下发生上述反应,反应中生成的N2的物质的量浓度随时间的变化情况如图1所示。则NO从反应开始到平衡时的平均反应速率v(NO)=
(3)已知上述反应中NO的平衡转化率与压强、温度的关系如图2所示。工业上催化装置比较适合的温度和压强是

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)可逆反应A(g)+B(g)⇌2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示.
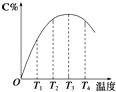
①由T1向T2变化时,正反应速率________ 逆反应速率(填“>”、“<”或“=”).
②由T3向T4变化时,正反应速率________ 逆反应速率(填“>”、“<”或“=”).
③反应在________ 温度下达到平衡.
④此反应的正反应为________ 热反应.
(2)800℃时,在2L密闭容器中发生反应2NO(g)+O2(g)⇌2NO2(g),在反应体系中,n(NO)随时间的变化如表所示:
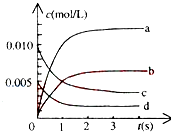
①图中表示NO2变化的曲线是________ ,用O2表示从0~2s内该反应的平均速率v=________ .
②能说明该反应已经达到平衡状态的是________
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变.

①由T1向T2变化时,正反应速率
②由T3向T4变化时,正反应速率
③反应在
④此反应的正反应为
(2)800℃时,在2L密闭容器中发生反应2NO(g)+O2(g)⇌2NO2(g),在反应体系中,n(NO)随时间的变化如表所示:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

①图中表示NO2变化的曲线是
②能说明该反应已经达到平衡状态的是
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变.
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】化学在生产生活中有着广泛的应用,请回答下列问题:
(1)开启啤酒瓶后瓶中立刻泛起大量泡沫,该变化______ (填“能”或“不能”)用勒夏特列原理解释。
(2)如图是碳和水蒸气发生反应生成CO、H2的途径和三个状态的能量,该反应为吸热反应,比较E1、E2、E3的大小:______ 。
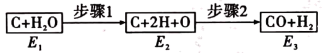
(3)某中学开展劳动实习,学生用废电池的锌皮制备ZnSO4∙7H2O,该过程中需除去锌皮中的少量杂质铁,方法是先加稀H2SO4和H2O2溶解,铁变为______ (填离子符号),再加碱调节至pH为______ 时,铁刚好沉淀完全(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱至pH为6时,锌开始沉淀。若上述过程不加H2O2后果是______ 。(已知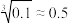 ,lg2
,lg2 0.3)
0.3)
(1)开启啤酒瓶后瓶中立刻泛起大量泡沫,该变化
(2)如图是碳和水蒸气发生反应生成CO、H2的途径和三个状态的能量,该反应为吸热反应,比较E1、E2、E3的大小:
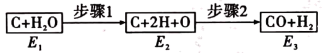
(3)某中学开展劳动实习,学生用废电池的锌皮制备ZnSO4∙7H2O,该过程中需除去锌皮中的少量杂质铁,方法是先加稀H2SO4和H2O2溶解,铁变为
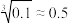 ,lg2
,lg2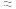 0.3)
0.3)| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp的近似值 | 10-17 | 10-17 | 10-39 |
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】用CO2来生产燃料甲醇是工业上一种有效开发利用CO2的方法。为探究反应原理,进行如下实验,在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(1)从反应开始到平衡,CO2的平均反应速率v(CO2)=____ mol·L-1·min-1。
(2)氢气的转化率=____ 。
(3)求此温度下该反应的平衡常数K=____ 。
(4)下列措施中能使平衡体系中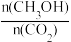 增大的是
增大的是____ 。
A.将H2O(g)从体系中分离出去 B.充入He(g),使体系压强增大
C.升高温度 D.再充入1 mol H2
(5)当反应进行到3min末时,下列说法正确的是________ (填字母)。
A.CO和CH3OH(g)的物质的量浓度相等
B.用CO和CH3OH(g)表示的化学反应速率相等
C.上述反应达到平衡状态
D.3 min后该反应的正反应速率逐渐增大
 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从反应开始到平衡,CO2的平均反应速率v(CO2)=
(2)氢气的转化率=
(3)求此温度下该反应的平衡常数K=
(4)下列措施中能使平衡体系中
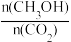 增大的是
增大的是A.将H2O(g)从体系中分离出去 B.充入He(g),使体系压强增大
C.升高温度 D.再充入1 mol H2
(5)当反应进行到3min末时,下列说法正确的是
A.CO和CH3OH(g)的物质的量浓度相等
B.用CO和CH3OH(g)表示的化学反应速率相等
C.上述反应达到平衡状态
D.3 min后该反应的正反应速率逐渐增大
您最近一年使用:0次



