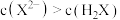常温下,用0.10mol/LNaOH溶液滴定20.00mL 0.10mol/LHA溶液(滴定曲线见图)。下列说法正确的是
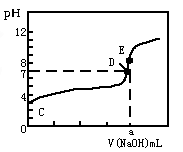
| A.此图可以表示从NaOH滴定盐酸的曲线 |
| B.图中D点状态时溶液中有:c(Na+)<c(A-) |
| C.达到D、E状态时,均有:c(Na+)+c(H+)=c(A-)+c(OH-) |
| D.当O<V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)> c(Na+)> c(H+)>c(OH-) |
更新时间:2017-03-16 19:48:07
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】常温下,下列有关叙述中不正确的是( )
| A.等体积、等pH的氢氧化钠溶液和氨水,分别与等浓度的硫酸反应,氨水消耗的硫酸多 |
| B.pH=3的稀硫酸跟pH=11的氢氧化钠溶液等体积混合,混合溶液的pH<7 |
| C.通过测定100mL1mol/L的氯化钠溶液和醋酸钠溶液的pH的大小,可达到比较盐酸和醋酸酸性强弱的目的 |
| D.等体积、等浓度的盐酸和醋酸溶液与足量锌反应,整个过程的平均反应速率盐酸快 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列说法不正确的是
| A.20℃时,AgCl固体在等物质的量浓度的NaCl、MgCl2溶液中的溶度积相同 |
B.浓度为0.2mol/L的KHCO3溶液:c(H2CO3)>c( ) ) |
| C.a mol/LHCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b |
D.常温下,在0.1mol/L的NaOH溶液中,由水电离出的c(H+)<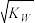 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】 是阿伏加 德罗常数的值。已知:常温下,
是阿伏加 德罗常数的值。已知:常温下, 的电离常数
的电离常数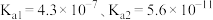 ,HClO的电离常数
,HClO的电离常数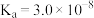 。84消毒液制备原理为
。84消毒液制备原理为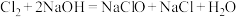 。下列说法正确的是
。下列说法正确的是
 是阿伏加 德罗常数的值。已知:常温下,
是阿伏加 德罗常数的值。已知:常温下, 的电离常数
的电离常数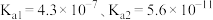 ,HClO的电离常数
,HClO的电离常数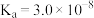 。84消毒液制备原理为
。84消毒液制备原理为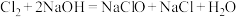 。下列说法正确的是
。下列说法正确的是A. 溶液中 溶液中 数为 数为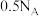 |
B.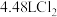 完全反应时转移电子数为 完全反应时转移电子数为 |
C.84消毒液中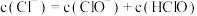 |
D.84消毒液中通少量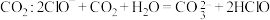 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】常温下,往 的
的 溶液中通入HCl或加入NaOH固体调节溶液的pH(忽略体积变化),溶液中
溶液中通入HCl或加入NaOH固体调节溶液的pH(忽略体积变化),溶液中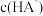 随pH变化的曲线如图。下列说法正确的是
随pH变化的曲线如图。下列说法正确的是
 的
的 溶液中通入HCl或加入NaOH固体调节溶液的pH(忽略体积变化),溶液中
溶液中通入HCl或加入NaOH固体调节溶液的pH(忽略体积变化),溶液中 随pH变化的曲线如图。下列说法正确的是
随pH变化的曲线如图。下列说法正确的是
A.水的电离程度: |
B. |
C.c点溶液中存在: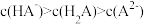 |
D.d点溶液中存在: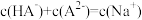 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】25℃时,用0.1000mol/L的NaOH溶液分别滴定体积均为50.00mL、浓度均为0.0500mol/L的HClO、KHP(邻苯二甲酸氢钾)及HF溶液,其滴定曲线如下图所示。下列说法正确的是
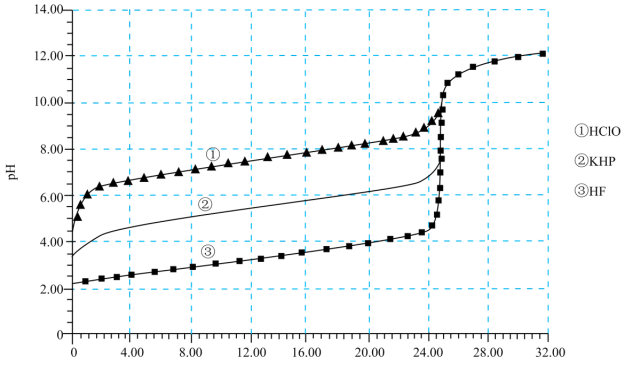

| A.Ka(HF)<Ka(HClO) |
| B.分别滴定至pH=7.00时,c(ClO﹣)<c(P2-)﹣c(H2P)<c(F﹣) |
| C.V(NaOH溶液)=12.50mL时,①中c(Na+)<c(ClO﹣) |
| D.V(NaOH溶液)=25.00mL时,②中c(HP﹣)>c(P2-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】下列有关电解质溶液中粒子浓度关系正确的是
A.pH=1的NaHSO4溶液:c(H+)=c( )+c(OH﹣) )+c(OH﹣) |
| B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl﹣)=c(I﹣) |
| C.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO﹣)+c(CH3COOH)+2c(Cl﹣) |
D.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合:c( )+c( )+c( )=c(Cl-) )=c(Cl-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】已知氟硅酸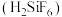 是二元强酸。下列叙述正确的是
是二元强酸。下列叙述正确的是
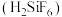 是二元强酸。下列叙述正确的是
是二元强酸。下列叙述正确的是A. 水溶液中不存在电离平衡 水溶液中不存在电离平衡 |
B.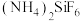 溶液 溶液 |
C.常温下,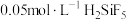 溶液的 溶液的 |
D. 溶液中 溶液中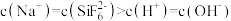 |
您最近一年使用:0次

 时,向某二元弱酸
时,向某二元弱酸 的溶液中滴加
的溶液中滴加 溶液,混合溶液中
溶液,混合溶液中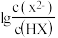 或
或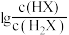 与
与 的关系如图所示。下列叙述正确的是
的关系如图所示。下列叙述正确的是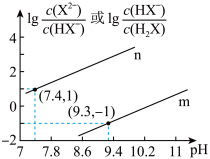
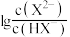 与
与 时,
时,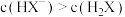
 溶液中
溶液中