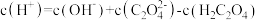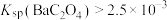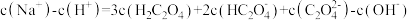25℃时,关于某酸(用H2A表示)下列说法中,不正确的是
| A.pH=a的Na2A溶液中,由水电离产生的c(OH-)=10a-14 |
| B.将pH=a的H2A稀释为pH=a+l的过程中,c(H2A)/c(H+)减小,则H2A为弱酸 |
| C.测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| D.0.2 mol·L-1 H2A 溶液中的 c(H+)=a,0.1 mol·L-1 H2A溶液中的 c(H+)=b,若a<2 b,则H2A为弱酸 |
2017·浙江绍兴·一模 查看更多[9]
2017届浙江省绍兴市高三3月教学质量调测考试化学试卷22017届浙江省绍兴市高三3月教学质量调测考试化学试卷河北省衡水中学2016-2017学年高一下学期三调考试化学试题2017届浙江省绍兴市高三3月教学质量调测考试化学试卷1甘肃省白银市第十中学2019-2020学年高二上学期期中考试化学试题(已下线)专题07 电解质溶液——备战2021年高考化学纠错笔记浙江省绍兴市高考选考科目考试适应性试卷化学试题(已下线)专题12 水溶液中的离子平衡-备战2022年高考化学学霸纠错(全国通用)(已下线)三轮冲刺卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(浙江专用)
更新时间:2017-03-26 13:19:59
|
相似题推荐
单选题
|
较难
(0.4)
【推荐1】乙醇胺为一元弱碱(25℃时,电离常数Kb=4.0×10-5)。其电离方程式为HOCH2CH2NH2+H2O⇌HOCH2CH2NH +OH-。用0.1mol/L的盐酸滴定20mL0.1mol/L乙醇胺溶液,温度恒定在25℃时,滴定过程中由水电离出的c(H+)与滴加盐酸体积的关系如图所示(已知:lg5=0.7)。下列说法中错误的是
+OH-。用0.1mol/L的盐酸滴定20mL0.1mol/L乙醇胺溶液,温度恒定在25℃时,滴定过程中由水电离出的c(H+)与滴加盐酸体积的关系如图所示(已知:lg5=0.7)。下列说法中错误的是
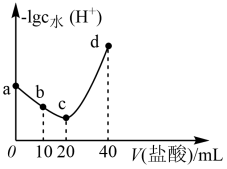
 +OH-。用0.1mol/L的盐酸滴定20mL0.1mol/L乙醇胺溶液,温度恒定在25℃时,滴定过程中由水电离出的c(H+)与滴加盐酸体积的关系如图所示(已知:lg5=0.7)。下列说法中错误的是
+OH-。用0.1mol/L的盐酸滴定20mL0.1mol/L乙醇胺溶液,温度恒定在25℃时,滴定过程中由水电离出的c(H+)与滴加盐酸体积的关系如图所示(已知:lg5=0.7)。下列说法中错误的是
| A.a点溶液的pH约为11.3 |
B.b点溶液中:c(HOCH2CH2NH2)>c(Cl-)>c(HOCH2CH2NH ) ) |
| C.c点两侧溶液均存在由水电离出的c(H+)=1×10-7mol/L |
D.d点溶液中:c(Cl-)=2c(HOCH2CH2NH2)+2c(HOCH2CH2NH ) ) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】人体血液存在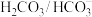 和
和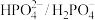 等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值
等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值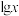 [x表示
[x表示 或
或 ]与pH的关系如图所示。已知
]与pH的关系如图所示。已知 ,
,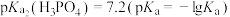 。下列说法正确的是
。下列说法正确的是

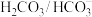 和
和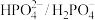 等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值
等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值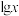 [x表示
[x表示 或
或 ]与pH的关系如图所示。已知
]与pH的关系如图所示。已知 ,
,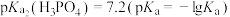 。下列说法正确的是
。下列说法正确的是
A.曲线I表示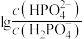 与pH的变化关系 与pH的变化关系 |
| B.a点→b点的过程中,水的电离程度逐渐减小 |
C.当pH增大时, 逐渐减小 逐渐减小 |
D.当 时, 时, |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】根据下列实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向FeBr2溶液中通入少量Cl2 | 溶液由浅绿色变为黄色 | 氧化性:Cl2>Br2 |
| B | 向Na2SO3溶液中滴加盐酸 | 有气体产生 | 非金属性:Cl>S |
| C | 向pH=3的HA和HB溶液中分别加水稀释至100倍 | pH(HA)>pH(HB) | 酸性:HA>HB |
| D | 向重晶石中加入饱和碳酸钠溶液 | 重晶石逐渐溶解 | 溶度积:Ksp(BaCO3)<Ksp(BaSO4) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】向NaOH溶液中缓慢通入 气体,溶液中
气体,溶液中 的物质的量与通入
的物质的量与通入 物质的量的关系图如下。下列关于图中a、b两点溶液的说法错误的是
物质的量的关系图如下。下列关于图中a、b两点溶液的说法错误的是

 气体,溶液中
气体,溶液中 的物质的量与通入
的物质的量与通入 物质的量的关系图如下。下列关于图中a、b两点溶液的说法错误的是
物质的量的关系图如下。下列关于图中a、b两点溶液的说法错误的是
| A.a、b溶液与同浓度盐酸完全反应时,消耗盐酸的体积相同 |
| B.a溶液中水的电离程度与b溶液中水的电离程度相同 |
C.a、b两溶液都满足: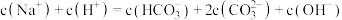 |
D.将a、b两点混合后溶液满足: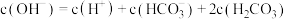 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐3】25 ℃时,用浓度为0.1000 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.1000 mol·L-1的三种酸HX、HY、HZ,滴定曲线如下图所示。下列说法错误的是


| A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HX<HY<HZ |
| B.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) |
| C.根据滴定曲线,可得知Y-的水解常数K约为10-9 |
| D.由图象可知酸碱中和滴定分析不适用于极弱的酸和极弱的碱的测定 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】25℃时,NaCN溶液中CN-、HCN浓度所占分数( )随pH变化的关系如图甲所示,其中a点的坐标为(9.5,0.5)。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图乙所示。下列溶液中的关系中一定正确的
)随pH变化的关系如图甲所示,其中a点的坐标为(9.5,0.5)。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图乙所示。下列溶液中的关系中一定正确的
 )随pH变化的关系如图甲所示,其中a点的坐标为(9.5,0.5)。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图乙所示。下列溶液中的关系中一定正确的
)随pH变化的关系如图甲所示,其中a点的坐标为(9.5,0.5)。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图乙所示。下列溶液中的关系中一定正确的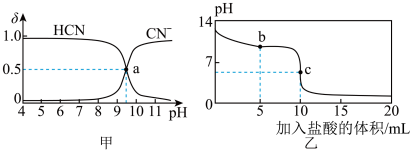
| A.图甲中pH=7的溶液:c(Cl-)=c(HCN) |
| B.常温下,NaCN的水解平衡常数:Kh(NaCN)=10-4.5mol/L |
| C.图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+) |
| D.图乙中c点的溶液:c(Na+)+ c(H+)= c(HCN)+ c(OH-)+ c(CN-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】设NA为阿伏加德罗常数的值,下列说法不正确的是
| A.46 g乙醇中含有的共价键数为8NA |
| B.12.4 g白磷(P4)中所包含的P−P共价键有0.4NA |
| C.标准状况下,2.24 L CH2Cl2含有的分子数大于0.1NA |
| D.常温下,2 L 0.1 mol∙L−1 FeCl3溶液与1 L 0.2 mol∙L−1 FeCl3溶液所含Fe3+数目不同 |
您最近一年使用:0次

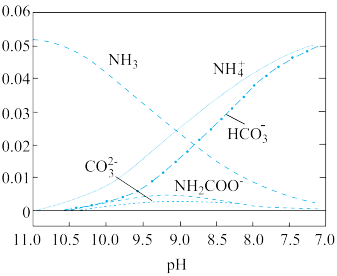
 )>c(HCO
)>c(HCO )>c(NH2COOˉ)>c(CO
)>c(NH2COOˉ)>c(CO )
) 不断减小
不断减小 是一种二元弱酸。室温下,通过下列实验探究
是一种二元弱酸。室温下,通过下列实验探究 溶液的性质。
溶液的性质。 0.1
0.1
 溶液中滴加过量0.1
溶液中滴加过量0.1 溶液,溶液变浑浊。
溶液,溶液变浑浊。
 溶液,无明显现象。
溶液,无明显现象。