已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g) Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
①写出该反应平衡常数的表达式________ 。
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量________ ;充入氦气,混合气体的密度________ (填“增大”“减小”或“不变”)。
(2)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
①上述盐溶液中的阴离子,结合质子能力最强的是________ 。
②根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最强的是________ ;将各溶液分别稀释100倍,pH变化最小的是________ (填编号)。
A.HCN B.HClO
C.H2CO3 D.CH3COOH
③据上表数据,请你判断下列反应不能成立的是________ (填编号)。
A.CH3COOH+Na2CO3===NaHCO3+CH3COONa
B.CH3COOH+NaCN===CH3COONa+HCN
C.CO2+H2O+2NaClO===Na2CO3+2HClO
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为__________________________________ 。
(3)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液里[Cu2+]=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于________ ;要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全( 使Cu2+浓度降 至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH为________ 。
(1)可逆反应FeO(s)+CO(g)
 Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:| T/K | 938 | 1 100 |
| K | 0.68 | 0.40 |
①写出该反应平衡常数的表达式
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量
(2)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①上述盐溶液中的阴离子,结合质子能力最强的是
②根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最强的是
A.HCN B.HClO
C.H2CO3 D.CH3COOH
③据上表数据,请你判断下列反应不能成立的是
A.CH3COOH+Na2CO3===NaHCO3+CH3COONa
B.CH3COOH+NaCN===CH3COONa+HCN
C.CO2+H2O+2NaClO===Na2CO3+2HClO
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为
(3)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液里[Cu2+]=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于
更新时间:2018-08-28 09:24:50
|
相似题推荐
【推荐1】CO2的大量排放不仅会造成温室效应还会引起海水中富含二氧化碳后酸度增加,可能会杀死一些海洋生物,甚至会溶解掉部分海床,从而造成灾难性的后果。所以二氧化碳的吸收和利用成为当前研究的重要课题。
(1)工业上以CO2与H2为原料合成甲醇,再以甲醇为原料来合成甲醚。
已知:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1
2CH3OH(g)⇌CH3OCH3(g)+H2O(g) △H2=-24.5 kJ•mol﹣1
2CO2(g)+6H2(g)⇌ CH3OCH3(g)+3H2O(g) △H3=-122.5 kJ•mol﹣1
甲醇的电子式为________________ ;△H1=________ kJ·mol-1
(2)某科研小组探究用活性炭处理汽车尾气的可行性,在T1℃体积为2L的恒温密闭容器中进行了实验,并根据实验数据绘制了如下图象,其中X代表NO浓度变化,Y代表N2和CO2浓度变化:
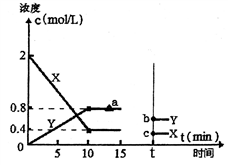
①若15min,后升高到一定温度,达到新平衡后容器中N2、CO2、NO的浓度之比为1:1:3,到达到新平衡时CO2的反应速率与图中a点相比较,速率_____ (填“增大”、“减小”或“不变”),此时平衡常数K与T1℃相比_______ (填“增大”、“减小”或“不变”)。②T1℃时该反应的平衡常数为_________________ 。
③如上图所示,若15min后改变了一个条件,t时刻建立新的平衡,b点坐标(0.6,t),c点坐标(0.3,t)。则改变的条件可能是_______ (填序号)。
a.扩大容器体积 b.升高温度 c.使用合适催化剂 d.移走部分NO
(3)已知:H2CO3的电离常数Ka1=4.4×10-7,Ka2=5×10-11。25℃时若用1L 1mol· L-1的NaOH溶液吸收CO2,当溶液中c(CO32-):c(H2CO3)=2200,此时该溶液的pH值为________________ 。
(4)以熔融K2CO3为电解质的甲醚燃料电池,具有能量转化率高,储电量大等特点,则该电池的负极电极反应式为______________________ 。
(1)工业上以CO2与H2为原料合成甲醇,再以甲醇为原料来合成甲醚。
已知:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1
2CH3OH(g)⇌CH3OCH3(g)+H2O(g) △H2=-24.5 kJ•mol﹣1
2CO2(g)+6H2(g)⇌ CH3OCH3(g)+3H2O(g) △H3=-122.5 kJ•mol﹣1
甲醇的电子式为
(2)某科研小组探究用活性炭处理汽车尾气的可行性,在T1℃体积为2L的恒温密闭容器中进行了实验,并根据实验数据绘制了如下图象,其中X代表NO浓度变化,Y代表N2和CO2浓度变化:

①若15min,后升高到一定温度,达到新平衡后容器中N2、CO2、NO的浓度之比为1:1:3,到达到新平衡时CO2的反应速率与图中a点相比较,速率
③如上图所示,若15min后改变了一个条件,t时刻建立新的平衡,b点坐标(0.6,t),c点坐标(0.3,t)。则改变的条件可能是
a.扩大容器体积 b.升高温度 c.使用合适催化剂 d.移走部分NO
(3)已知:H2CO3的电离常数Ka1=4.4×10-7,Ka2=5×10-11。25℃时若用1L 1mol· L-1的NaOH溶液吸收CO2,当溶液中c(CO32-):c(H2CO3)=2200,此时该溶液的pH值为
(4)以熔融K2CO3为电解质的甲醚燃料电池,具有能量转化率高,储电量大等特点,则该电池的负极电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】无水 具有抗菌、杀虫、抗氧化和除藻等功能,从电路板回收无水
具有抗菌、杀虫、抗氧化和除藻等功能,从电路板回收无水 的工艺如下:
的工艺如下:

已知:各离子开始沉淀和完全沉淀的pH如下表:
回答下列各题:
(1)用离子方程式表示 的作用
的作用______ ,物质x可调节溶液b的pH,最好选用______ (填正确答案的编号),加入x后调节溶液b的pH范围是______ 。
A.CuO B.NaOH C.氨水 D.
(2)废渣的主要成分的化学式是______ 。
(3)一系列操作是先蒸发浓缩,冷却结晶得到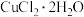 。但冷却结晶时发现
。但冷却结晶时发现 溶液过饱和也不析出晶体。实验室模拟该过程通过玻璃棒摩擦烧杯壁或加入少量氯化铜固体粉末立即产生大量该晶体,原因是
溶液过饱和也不析出晶体。实验室模拟该过程通过玻璃棒摩擦烧杯壁或加入少量氯化铜固体粉末立即产生大量该晶体,原因是______ 。将
______ ,得到无水 。
。
(4) 是
是 分解的催化剂,其催化过程可用两步表示:
分解的催化剂,其催化过程可用两步表示:
步骤Ⅰ:
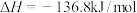
步骤Ⅱ: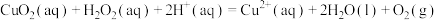

写出 分解的热化学方程式
分解的热化学方程式______ 。
(5)有机供氢剂HL与无水 可发生反应:
可发生反应:
 。某温度下,向密闭容器中加入一定量的
。某温度下,向密闭容器中加入一定量的 和
和 (反应物均足量)。
(反应物均足量)。
①其他条件不变,升高温度HL转化率提高,原因可能有______ 。
②测得反应达到平衡时,该容器压强为120kPa,维持温度等其他条件不变,将容器体积压缩至原容积的一半,达到新平衡时,容器内的压强为______ kPa.
 具有抗菌、杀虫、抗氧化和除藻等功能,从电路板回收无水
具有抗菌、杀虫、抗氧化和除藻等功能,从电路板回收无水 的工艺如下:
的工艺如下:
已知:各离子开始沉淀和完全沉淀的pH如下表:
| 金属离子 |  |  |  |
| 开始沉淀PH | 5.6 | 7.5 | 1.9 |
| 完全沉淀pH | 7.8 | 9.5 | 3.3 |
(1)用离子方程式表示
 的作用
的作用A.CuO B.NaOH C.氨水 D.

(2)废渣的主要成分的化学式是
(3)一系列操作是先蒸发浓缩,冷却结晶得到
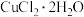 。但冷却结晶时发现
。但冷却结晶时发现 溶液过饱和也不析出晶体。实验室模拟该过程通过玻璃棒摩擦烧杯壁或加入少量氯化铜固体粉末立即产生大量该晶体,原因是
溶液过饱和也不析出晶体。实验室模拟该过程通过玻璃棒摩擦烧杯壁或加入少量氯化铜固体粉末立即产生大量该晶体,原因是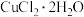
 。
。(4)
 是
是 分解的催化剂,其催化过程可用两步表示:
分解的催化剂,其催化过程可用两步表示:步骤Ⅰ:

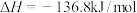
步骤Ⅱ:
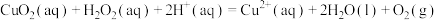

写出
 分解的热化学方程式
分解的热化学方程式(5)有机供氢剂HL与无水
 可发生反应:
可发生反应:
 。某温度下,向密闭容器中加入一定量的
。某温度下,向密闭容器中加入一定量的 和
和 (反应物均足量)。
(反应物均足量)。①其他条件不变,升高温度HL转化率提高,原因可能有
②测得反应达到平衡时,该容器压强为120kPa,维持温度等其他条件不变,将容器体积压缩至原容积的一半,达到新平衡时,容器内的压强为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】某合成气的主要成分是一氧化碳和氢气,可用于合成甲醚(CH3OCH3)等清洁燃料。由天然气获得该合成气过程中可能发生的反应有:
①CH4(g)+H2O(g) CO(g)+3H2(g) ΔH1=+206.1kJ·mol-1
CO(g)+3H2(g) ΔH1=+206.1kJ·mol-1
②CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH2=+247.3kJ·mol-1
2CO(g)+2H2(g) ΔH2=+247.3kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图所示,则在10min时,改变的外界条件可能是________ 。

(2)反应③中ΔH3=_______ 。800℃时,反应③的平衡常数K=1,测得该温度下密闭容器中某时刻各物质的物质的量见下表:
此时反应③中正、逆反应速率的关系式是______ (填代号)。
a.v正>v逆 b.v正<v逆 c.v正=v逆 d.无法判断
(3)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中CH4的转化率随时间的变化如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象_______ 。

(4)某合成气的主要成分中的一氧化碳,在一定条件下也可用NaOH溶液与CO反应生成甲酸钠(HCOONa),进一步反应生成甲酸来消除CO污染。常温下将amol的CO通入2Lbmol·L-1NaOH溶液中,恰好完全反应生成甲酸钠和含少量甲酸的混合溶液(假设溶液体积不变),测得溶液中c(Na+)=c(HCOO-),则该混合溶液中甲酸的电离平衡常数Ka=_______ (用含a和b的代数式表示)。
①CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH1=+206.1kJ·mol-1
CO(g)+3H2(g) ΔH1=+206.1kJ·mol-1②CH4(g)+CO2(g)
 2CO(g)+2H2(g) ΔH2=+247.3kJ·mol-1
2CO(g)+2H2(g) ΔH2=+247.3kJ·mol-1③CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图所示,则在10min时,改变的外界条件可能是

(2)反应③中ΔH3=
| CO | H2O | CO2 | H2 |
| 0.5 mol | 8.5 mol | 2.0mol | 2.0mol |
此时反应③中正、逆反应速率的关系式是
a.v正>v逆 b.v正<v逆 c.v正=v逆 d.无法判断
(3)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中CH4的转化率随时间的变化如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象

(4)某合成气的主要成分中的一氧化碳,在一定条件下也可用NaOH溶液与CO反应生成甲酸钠(HCOONa),进一步反应生成甲酸来消除CO污染。常温下将amol的CO通入2Lbmol·L-1NaOH溶液中,恰好完全反应生成甲酸钠和含少量甲酸的混合溶液(假设溶液体积不变),测得溶液中c(Na+)=c(HCOO-),则该混合溶液中甲酸的电离平衡常数Ka=
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐1】以废锰渣(含MnO2及少量KOH、MgO、Fe2O3)为原料制备MnSO4晶体,其工艺流程可表示为:_____ 。
(2)“酸浸”时为提高锰离子的浸出率,可采取的措施有_____ 。
(3)“反应I”中加入硫铁矿(主要成分FeS2)与MnO2反应生成Mn2+与Fe3+,滤渣1的主要成分为FeS2和S,写出该反应的离子方程式_____ 。
(4)已知:Ksp[Fe(OH)3]=1×10-38。“调pH”后滤液中Fe3+刚好沉淀完全(离子浓度小于1×10-5mol·L-1认为沉淀完全),此时pH约为_____ ;滤渣2除MnO2、CaCO3外主要成分是_____ (填化学式)。
(5)测定产品纯度。取制得的MnSO4晶体0.1510g,溶于适量水中,加硫酸酸化;用过量NaBiO3(难溶于水)将Mn2+完全氧化为MnO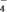 ,过滤洗涤;将几次洗涤的滤液与过滤所得的滤液合并,向其中加入Na2C2O4固体0.5360g;充分反应后,用0.0400mol·L-1KMnO4溶液滴定,用去20.00mL。计算产品中MnSO4的质量分数(写出计算过程,保留两位有效数字)
,过滤洗涤;将几次洗涤的滤液与过滤所得的滤液合并,向其中加入Na2C2O4固体0.5360g;充分反应后,用0.0400mol·L-1KMnO4溶液滴定,用去20.00mL。计算产品中MnSO4的质量分数(写出计算过程,保留两位有效数字)_____ 。
[已知: +
+ →CO2↑+Mn2+(未配平)]
→CO2↑+Mn2+(未配平)]
(2)“酸浸”时为提高锰离子的浸出率,可采取的措施有
(3)“反应I”中加入硫铁矿(主要成分FeS2)与MnO2反应生成Mn2+与Fe3+,滤渣1的主要成分为FeS2和S,写出该反应的离子方程式
(4)已知:Ksp[Fe(OH)3]=1×10-38。“调pH”后滤液中Fe3+刚好沉淀完全(离子浓度小于1×10-5mol·L-1认为沉淀完全),此时pH约为
(5)测定产品纯度。取制得的MnSO4晶体0.1510g,溶于适量水中,加硫酸酸化;用过量NaBiO3(难溶于水)将Mn2+完全氧化为MnO
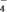 ,过滤洗涤;将几次洗涤的滤液与过滤所得的滤液合并,向其中加入Na2C2O4固体0.5360g;充分反应后,用0.0400mol·L-1KMnO4溶液滴定,用去20.00mL。计算产品中MnSO4的质量分数(写出计算过程,保留两位有效数字)
,过滤洗涤;将几次洗涤的滤液与过滤所得的滤液合并,向其中加入Na2C2O4固体0.5360g;充分反应后,用0.0400mol·L-1KMnO4溶液滴定,用去20.00mL。计算产品中MnSO4的质量分数(写出计算过程,保留两位有效数字)[已知:
 +
+ →CO2↑+Mn2+(未配平)]
→CO2↑+Mn2+(未配平)]
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】废旧锂离子电池经处理得到的正极活性粉体中含有Li2O、NiO、Co2O3、MnO2、Fe、C、Al、Cu等。采用以下工艺流程可从废旧锂离子电池中分离回收钴、镍、锰,制备正极材料的前驱体(NiCO3·CoCO3·MnCO3)。
(1)“酸浸”温度为85℃,粉体中的钴(以Co2O3表示)还原浸出的化学方程式为_______ ,H2O2的用量比理论用量多一倍的原因是_______ 。
(2)“除铁”时需将溶液的pH调至3左右,加入的化合物X是________ 填化学式)
(3)“除铜”时获得萃余液的操作名称是_______ 。
(4)“除铝”时反应的离子方程式为_______ 。萃余液中Co2+的浓度为0.33mol·L-1,通过计算说明,常温下除铝控制溶液pH为4.5,是否造成Co的损失_______ ?(列出算式并给出结论)已知:(Ksp[Co(OH)2]=5.9×10-15)
(5)从滤液④中可提取_______ (任写一种)用作_______ 。
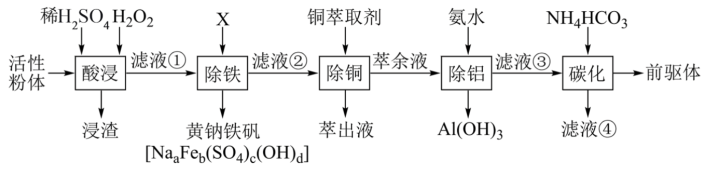
(1)“酸浸”温度为85℃,粉体中的钴(以Co2O3表示)还原浸出的化学方程式为
(2)“除铁”时需将溶液的pH调至3左右,加入的化合物X是
(3)“除铜”时获得萃余液的操作名称是
(4)“除铝”时反应的离子方程式为
(5)从滤液④中可提取
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
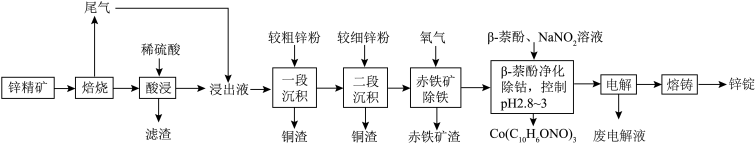
【推荐3】湿法炼锌具有能耗低,生成产品纯度高等特点,其主要原料为锌精矿(主要成分为硫化锌,还含有铁、钴、铜、镉、铅等元素的杂质),获得较纯锌锭的工艺流程如图: 、
、 、CdO。
、CdO。
(1)铜原子的价层电子排布图为________ 。
(2)“酸浸”中滤渣主要成分为________ 。
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,然后反应速率显著增大,请解释产生此现象的原因:________ 。
(4)写出“赤铁矿除铁”过程中反应的离子方程式:_________ 。
(5)“ 萘酚净化除钴”先是
萘酚净化除钴”先是 把
把 氧化成
氧化成 ,并生成NO,
,并生成NO, 与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出
与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出 被氧化的离子方程式:
被氧化的离子方程式:________ 。
(6)“电解”工艺中,电解液常有较高浓度的 会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和
会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和 ,生成CuCl沉淀从而除去
,生成CuCl沉淀从而除去 ,发生的反应为
,发生的反应为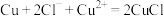 ,该反应的平衡常数
,该反应的平衡常数
________ 。[已知: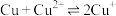
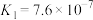 ;
; ]
]
(7)纯净的硫化锌是半导体锂离子电池负极材料。在充电过程中,发生合金化反应生成LiZn(合金相),同时负极材料晶胞的组成变化如图所示。
________ ,
________ ;充电过程中ZnS到 的电极反应式为
的电极反应式为________ (x和y用具体数字表示)。
②若 的晶胞参数为a nm,则EF间的距离为
的晶胞参数为a nm,则EF间的距离为________ nm。
 、
、 、CdO。
、CdO。(1)铜原子的价层电子排布图为
(2)“酸浸”中滤渣主要成分为
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,然后反应速率显著增大,请解释产生此现象的原因:
(4)写出“赤铁矿除铁”过程中反应的离子方程式:
(5)“
 萘酚净化除钴”先是
萘酚净化除钴”先是 把
把 氧化成
氧化成 ,并生成NO,
,并生成NO, 与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出
与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出 被氧化的离子方程式:
被氧化的离子方程式:(6)“电解”工艺中,电解液常有较高浓度的
 会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和
会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和 ,生成CuCl沉淀从而除去
,生成CuCl沉淀从而除去 ,发生的反应为
,发生的反应为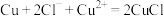 ,该反应的平衡常数
,该反应的平衡常数
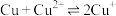
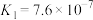 ;
; ]
](7)纯净的硫化锌是半导体锂离子电池负极材料。在充电过程中,发生合金化反应生成LiZn(合金相),同时负极材料晶胞的组成变化如图所示。
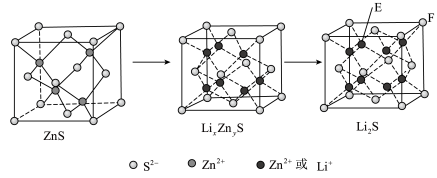


 的电极反应式为
的电极反应式为②若
 的晶胞参数为a nm,则EF间的距离为
的晶胞参数为a nm,则EF间的距离为
您最近一年使用:0次
【推荐1】氟化镁( )晶体广泛应用在光学、冶金、国防、医疗等领域。
)晶体广泛应用在光学、冶金、国防、医疗等领域。
Ⅰ.氟化镁晶胞是长方体,其结构如下图所示:
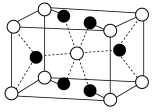
(1)F原子的价层电子排布式是___________ 。
(2) 晶胞示意图中:
晶胞示意图中:
a.○表示___________ (填离子符号);
b.离子半径: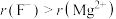 ,结合离子结构示意图解释原因:
,结合离子结构示意图解释原因:___________ 。
(3)已知 晶胞体积为
晶胞体积为 ,阿伏伽德罗常数的值为
,阿伏伽德罗常数的值为 ,则其晶体密度=
,则其晶体密度=___________  (用代数式表示)。
(用代数式表示)。
Ⅱ.一种由Mg制备 的工艺流程如下:
的工艺流程如下:

已知:i. 易溶于甲醇;
易溶于甲醇;
ii. ,
, ,
,
(4)上述流程中,可循环利用的物质是___________ 。
(5)比较相同条件下化学反应速率的大小:①Mg与 ;②Mg与
;②Mg与 。
。
a.小组同学预测化学反应速率:①<②,理由___________ 。
b.实验表明化学反应速率:①>②,分析其原因可能是___________ 。
(6)上述流程中 转化为
转化为 可以选择HF或NaF,结合数据判断哪种试剂的转化效果更好:
可以选择HF或NaF,结合数据判断哪种试剂的转化效果更好:___________ 。
 )晶体广泛应用在光学、冶金、国防、医疗等领域。
)晶体广泛应用在光学、冶金、国防、医疗等领域。Ⅰ.氟化镁晶胞是长方体,其结构如下图所示:

(1)F原子的价层电子排布式是
(2)
 晶胞示意图中:
晶胞示意图中:a.○表示
b.离子半径:
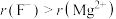 ,结合离子结构示意图解释原因:
,结合离子结构示意图解释原因:(3)已知
 晶胞体积为
晶胞体积为 ,阿伏伽德罗常数的值为
,阿伏伽德罗常数的值为 ,则其晶体密度=
,则其晶体密度= (用代数式表示)。
(用代数式表示)。Ⅱ.一种由Mg制备
 的工艺流程如下:
的工艺流程如下:
已知:i.
 易溶于甲醇;
易溶于甲醇;ii.
 ,
, ,
,
(4)上述流程中,可循环利用的物质是
(5)比较相同条件下化学反应速率的大小:①Mg与
 ;②Mg与
;②Mg与 。
。a.小组同学预测化学反应速率:①<②,理由
b.实验表明化学反应速率:①>②,分析其原因可能是
(6)上述流程中
 转化为
转化为 可以选择HF或NaF,结合数据判断哪种试剂的转化效果更好:
可以选择HF或NaF,结合数据判断哪种试剂的转化效果更好:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】利用所学化学反应原理知识,解决以下问题:
(1)①某温度下,纯水中的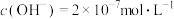 ,若温度不变,滴入稀硫酸使
,若温度不变,滴入稀硫酸使 ,则由水电离出的
,则由水电离出的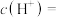
___________ 。
②将99mL 盐酸与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至25℃时溶液的
盐酸与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至25℃时溶液的
___________ 。
(2)①物质的量浓度为0.1mol/L的下列物质:a. ;b.
;b. ;c.
;c. ;d.NaOH,pH由大到小的顺序是:
;d.NaOH,pH由大到小的顺序是:___________ (填编号,下同)。
②物质的量浓度相同的下列四种溶液:a.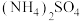 ;b.
;b. ;c.
;c.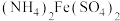 ;d.氨水,
;d.氨水, 由大到小的顺序是
由大到小的顺序是___________ 。
(3)已知常温下 的水解常数
的水解常数 。常温下,含等物质的量浓度的HCN与NaCN的混合溶液显
。常温下,含等物质的量浓度的HCN与NaCN的混合溶液显___________ (填“酸”“碱”或“中”)性,
___________ (填“>”“<”或“=”) 。该溶液中各离子浓度由大到小的顺序为
。该溶液中各离子浓度由大到小的顺序为___________ 。
(4)常温下,向100mL0.2mol/L的 溶液中加入200mL0.15mol/L的盐酸(混合后溶液的体积变化忽略不计)。已知25℃时,
溶液中加入200mL0.15mol/L的盐酸(混合后溶液的体积变化忽略不计)。已知25℃时,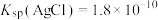 。请回答下列问题:
。请回答下列问题:
①混合后溶液的
___________ 。
②混合后溶液中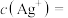
___________ mol/L。
(1)①某温度下,纯水中的
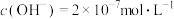 ,若温度不变,滴入稀硫酸使
,若温度不变,滴入稀硫酸使 ,则由水电离出的
,则由水电离出的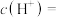
②将99mL
 盐酸与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至25℃时溶液的
盐酸与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至25℃时溶液的
(2)①物质的量浓度为0.1mol/L的下列物质:a.
 ;b.
;b. ;c.
;c. ;d.NaOH,pH由大到小的顺序是:
;d.NaOH,pH由大到小的顺序是:②物质的量浓度相同的下列四种溶液:a.
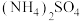 ;b.
;b. ;c.
;c.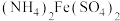 ;d.氨水,
;d.氨水, 由大到小的顺序是
由大到小的顺序是(3)已知常温下
 的水解常数
的水解常数 。常温下,含等物质的量浓度的HCN与NaCN的混合溶液显
。常温下,含等物质的量浓度的HCN与NaCN的混合溶液显
 。该溶液中各离子浓度由大到小的顺序为
。该溶液中各离子浓度由大到小的顺序为(4)常温下,向100mL0.2mol/L的
 溶液中加入200mL0.15mol/L的盐酸(混合后溶液的体积变化忽略不计)。已知25℃时,
溶液中加入200mL0.15mol/L的盐酸(混合后溶液的体积变化忽略不计)。已知25℃时,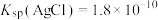 。请回答下列问题:
。请回答下列问题:①混合后溶液的

②混合后溶液中
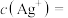
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】铈( )的氧化物在半导体材料、高级颜料及汽车尾气的净化器方面有广泛应用。以氟碳铈矿(含
)的氧化物在半导体材料、高级颜料及汽车尾气的净化器方面有广泛应用。以氟碳铈矿(含 、
、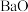 、
、 等)为原料制备
等)为原料制备 的工艺流程如图:
的工艺流程如图:
(1) 中氟元素对应的氟原子激发态的电子排布式有
中氟元素对应的氟原子激发态的电子排布式有_______ (填序号)。
a. b.
b.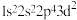 c.
c. d.
d.
(2)“氧化焙烧”后, 元素转化为
元素转化为 和
和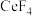 。写出“氧化焙烧”时
。写出“氧化焙烧”时 发生的化学反应方程式:
发生的化学反应方程式:_______ 。
(3)实验室进行操作①所需的玻璃仪器有烧杯、_______ 。
(4)“系列操作”包含下图几个过程: 不能溶于有机物
不能溶于有机物 ;
;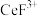 能溶于有机物
能溶于有机物 ,且存在反应
,且存在反应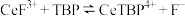 。“滤液
。“滤液 ”中加入有机物
”中加入有机物 后的分离方法是
后的分离方法是_______ ,“有机层B”中发生反应的离子方程式为_______ 。
(5)已知25℃时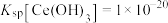 ,“调
,“调 ”时,要使
”时,要使 沉淀完全(通常认为溶液中离子浓度小于
沉淀完全(通常认为溶液中离子浓度小于 为沉淀完全),应控制
为沉淀完全),应控制 大于
大于_______ 。
(6) 立方晶胞结构如图所示。
立方晶胞结构如图所示。_______ 。
②阿伏加德罗常数的值为 ,
, 摩尔质量为
摩尔质量为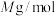 ,晶体密度为
,晶体密度为 ,其晶胞边长的计量表达式为
,其晶胞边长的计量表达式为
_______  。
。
 )的氧化物在半导体材料、高级颜料及汽车尾气的净化器方面有广泛应用。以氟碳铈矿(含
)的氧化物在半导体材料、高级颜料及汽车尾气的净化器方面有广泛应用。以氟碳铈矿(含 、
、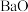 、
、 等)为原料制备
等)为原料制备 的工艺流程如图:
的工艺流程如图: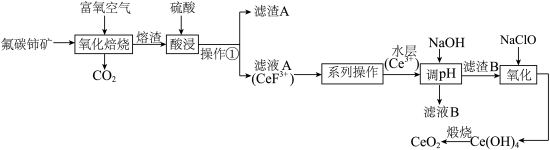
(1)
 中氟元素对应的氟原子激发态的电子排布式有
中氟元素对应的氟原子激发态的电子排布式有a.
 b.
b.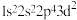 c.
c. d.
d.
(2)“氧化焙烧”后,
 元素转化为
元素转化为 和
和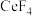 。写出“氧化焙烧”时
。写出“氧化焙烧”时 发生的化学反应方程式:
发生的化学反应方程式:(3)实验室进行操作①所需的玻璃仪器有烧杯、
(4)“系列操作”包含下图几个过程:

 不能溶于有机物
不能溶于有机物 ;
;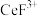 能溶于有机物
能溶于有机物 ,且存在反应
,且存在反应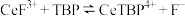 。“滤液
。“滤液 ”中加入有机物
”中加入有机物 后的分离方法是
后的分离方法是(5)已知25℃时
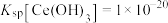 ,“调
,“调 ”时,要使
”时,要使 沉淀完全(通常认为溶液中离子浓度小于
沉淀完全(通常认为溶液中离子浓度小于 为沉淀完全),应控制
为沉淀完全),应控制 大于
大于(6)
 立方晶胞结构如图所示。
立方晶胞结构如图所示。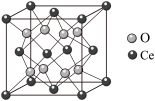
②阿伏加德罗常数的值为
 ,
, 摩尔质量为
摩尔质量为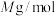 ,晶体密度为
,晶体密度为 ,其晶胞边长的计量表达式为
,其晶胞边长的计量表达式为
 。
。
您最近一年使用:0次



