硫酸是重要的化工材料,二氧化硫与氧气反应生成三氧化硫是工业制硫酸的重要反应之一。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g) 2SO3(g)在一定条件下经20分钟达到平衡,测得c(SO3)=0.040mol/L。
2SO3(g)在一定条件下经20分钟达到平衡,测得c(SO3)=0.040mol/L。
①从反应开始到达到平衡,用SO2表示的平均反应速率为________________
②从平衡角度分析采用过量O2的目的是____________ ;
③该反应的平衡常数表达式为K=___________ 。
④已知:K(300℃)>K(350℃),该反应是________ (选填“吸”或“放”)热反应。若反应温度升高,SO2的转化率将_______ (填“增大”、“减小”或“不变”)。
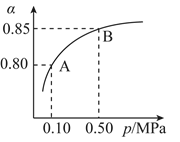
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。平衡状态由A变到B时,平衡常数K(A)_______ K(B)(填“>”、“<”或“=”,下同)。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)
 2SO3(g)在一定条件下经20分钟达到平衡,测得c(SO3)=0.040mol/L。
2SO3(g)在一定条件下经20分钟达到平衡,测得c(SO3)=0.040mol/L。①从反应开始到达到平衡,用SO2表示的平均反应速率为
②从平衡角度分析采用过量O2的目的是
③该反应的平衡常数表达式为K=
④已知:K(300℃)>K(350℃),该反应是

(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。平衡状态由A变到B时,平衡常数K(A)
更新时间:2018-11-19 14:43:53
|
相似题推荐
填空题
|
较易
(0.85)
【推荐1】已知:反应aA(g)+bB(g) cC(g),某温度下,在2L的密闭容器中投入一定量的A和B,两种气体的物质的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在2L的密闭容器中投入一定量的A和B,两种气体的物质的量浓度随时间变化的曲线如图所示。

(1)经测定,前4s内v(C)=0.05mol·L-1·s-1,v(A)=____ ,则该反应的化学方程式为____ 。
(2)从反应开始到12s内,A的转化率为____ 。
(3)若上述反应分别在甲、乙、丙二个相同的密闭容器中进行,反应相同时间后,测得三个容器中的反应速率分别为:甲:v(A)=0.3mol·L-1·s-1;乙:v(B)=0.12mol·L-1·s-1;丙:v(C)=9.6mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为____ 。
(4)下列条件的改变能加快上述反应的反应速率的是____ 。
①升高温度
②保持压强不变,充入He
③保持体积不变,充入He
④增加A的浓度
(5)下列叙述能说明该反应达到化学平衡状态的是____ 。
A.混合气体的总物质的量不随时间变化而变化
B.单位时间内每消耗3molA,同时生成2molC
C.混合气体的体积不随时间变化而变化
D.混合气体的密度不随时间变化而变化
E.混合气体的平均摩尔质量不随时间变化而变化
F.v(A):v(B)=3:1
 cC(g),某温度下,在2L的密闭容器中投入一定量的A和B,两种气体的物质的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在2L的密闭容器中投入一定量的A和B,两种气体的物质的量浓度随时间变化的曲线如图所示。
(1)经测定,前4s内v(C)=0.05mol·L-1·s-1,v(A)=
(2)从反应开始到12s内,A的转化率为
(3)若上述反应分别在甲、乙、丙二个相同的密闭容器中进行,反应相同时间后,测得三个容器中的反应速率分别为:甲:v(A)=0.3mol·L-1·s-1;乙:v(B)=0.12mol·L-1·s-1;丙:v(C)=9.6mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为
(4)下列条件的改变能加快上述反应的反应速率的是
①升高温度
②保持压强不变,充入He
③保持体积不变,充入He
④增加A的浓度
(5)下列叙述能说明该反应达到化学平衡状态的是
A.混合气体的总物质的量不随时间变化而变化
B.单位时间内每消耗3molA,同时生成2molC
C.混合气体的体积不随时间变化而变化
D.混合气体的密度不随时间变化而变化
E.混合气体的平均摩尔质量不随时间变化而变化
F.v(A):v(B)=3:1
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】一定温度下,在体积为2L的密闭容器中,充入1mol 和3mol
和3mol 发生如下反应:
发生如下反应: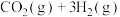
 。经测得
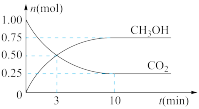
。经测得 和
和 (g)的物质的量随时间变化如图所示。
(g)的物质的量随时间变化如图所示。
①从反应开始到平衡, 的平均反应速率
的平均反应速率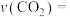
__ 。
②达到平衡时, 的转化率为
的转化率为__ 。(用百分数表示)
③下列措施不能提高反应速率的是____ 。
A.升高温度 B.加入适当催化剂
C.缩小体积,增大压强 D.恒温、恒压下通入氦气
④下列叙述中不能说明上述反应达到平衡状态的是___ 。
A.混合气体的平均相对分子质量保持不变
B.混合气体的压强不随时间的变化而变化
C. 在混合气体中的质量分数保持不变
在混合气体中的质量分数保持不变
D.反应中 与
与 的物质的量之比为1∶1
的物质的量之比为1∶1
E.单位时间内每消耗1mol 同时生成1mol
同时生成1mol
 和3mol
和3mol 发生如下反应:
发生如下反应: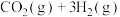
 。经测得
。经测得 和
和 (g)的物质的量随时间变化如图所示。
(g)的物质的量随时间变化如图所示。
①从反应开始到平衡,
 的平均反应速率
的平均反应速率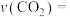
②达到平衡时,
 的转化率为
的转化率为③下列措施不能提高反应速率的是
A.升高温度 B.加入适当催化剂
C.缩小体积,增大压强 D.恒温、恒压下通入氦气
④下列叙述中不能说明上述反应达到平衡状态的是
A.混合气体的平均相对分子质量保持不变
B.混合气体的压强不随时间的变化而变化
C.
 在混合气体中的质量分数保持不变
在混合气体中的质量分数保持不变D.反应中
 与
与 的物质的量之比为1∶1
的物质的量之比为1∶1E.单位时间内每消耗1mol
 同时生成1mol
同时生成1mol
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
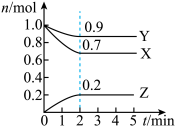
(1)该反应的化学方程式为___________ 。
(2)反应开始至2min,气体Z的平均反应速率为___________ 。
(3)若X、Y、Z均为气体,反应达平衡时:
①此时体系的压强是开始时的___________ 倍;
②若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为___________ 反应(填“放热”或“吸热”);达新平衡时,容器内混合气体的平均分子量比原平衡时___________ (填增大、减小或相等)。

(1)该反应的化学方程式为
(2)反应开始至2min,气体Z的平均反应速率为
(3)若X、Y、Z均为气体,反应达平衡时:
①此时体系的压强是开始时的
②若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示。由图中数据分析:
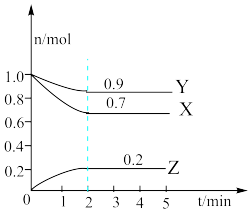
(1)该反应的化学方程式为___________ 。
(2)反应开始至2min,用X表示的平均反应速率为___________ mol•L﹣1•mi﹣1;平衡时,Y的转化率为___________ ,平衡时,Z的产率为___________ 。
(3)下列叙述能说明上述反应达到平衡状态的是___________ (填选项、多选)
A.X、Y、Z的物质的量之比为3︰1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3molX,同时生成2molZ
D.混合气体的总质量不随时间的变化而变化
E.混合气体的总物质的量不随时间的变化而变化。

(1)该反应的化学方程式为
(2)反应开始至2min,用X表示的平均反应速率为
(3)下列叙述能说明上述反应达到平衡状态的是
A.X、Y、Z的物质的量之比为3︰1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3molX,同时生成2molZ
D.混合气体的总质量不随时间的变化而变化
E.混合气体的总物质的量不随时间的变化而变化。
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H1
CH3OH(g)+H2O(g)△H1
②CO2(g)+H2(g) CO(g)+H2O(g)△H2
CO(g)+H2O(g)△H2
③CH3OH(g) CO(g)+2H2(g)△H3
CO(g)+2H2(g)△H3
回答下列问题:
(1)已知反应ⅱ中相关化学键键能数据如下:
由此计算△H2=___ kJ∙mol−1。已知△H1=−63 kJ∙mol−1,则△H3=___ kJ∙mol−1。
(2)一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图1所示。
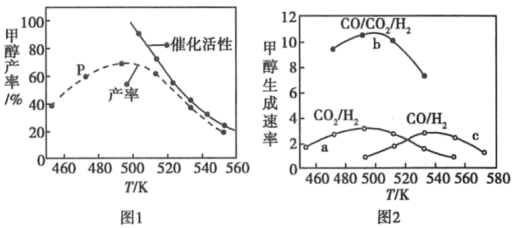
①温度为470K时,图中P点___ (填“是”或“不是”)处于平衡状态。490K之后,甲醇产率下降的原因是___ 。
②提高甲醇产率的措施是___ 。
A.增大压强 B.升高温度 C.选择合适催化剂 D.加入大量催化剂
(3)如图2为一定比例的CO2/H2,CO/H2、CO/CO2/H2条件下甲醇生成速率与温度的关系。当温度为490K时,根据曲线a、c,判断合成甲醇的反应机理是___ (填“I”或“II”)。
Ⅰ.CO2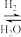 CO
CO CH3OH
CH3OH
Ⅱ.CO CO2
CO2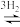 CH3OH+H2O
CH3OH+H2O
(4)490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从平衡移动的角度,并结合反应①、②分析原因___ 。
①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H1
CH3OH(g)+H2O(g)△H1②CO2(g)+H2(g)
 CO(g)+H2O(g)△H2
CO(g)+H2O(g)△H2③CH3OH(g)
 CO(g)+2H2(g)△H3
CO(g)+2H2(g)△H3回答下列问题:
(1)已知反应ⅱ中相关化学键键能数据如下:
| 化学键 | H—H | C=O | C≡O | H—O |
| E/( kJ∙mol−1) | 436 | 803 | 1076 | 465 |
(2)一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图1所示。

①温度为470K时,图中P点
②提高甲醇产率的措施是
A.增大压强 B.升高温度 C.选择合适催化剂 D.加入大量催化剂
(3)如图2为一定比例的CO2/H2,CO/H2、CO/CO2/H2条件下甲醇生成速率与温度的关系。当温度为490K时,根据曲线a、c,判断合成甲醇的反应机理是
Ⅰ.CO2
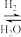 CO
CO CH3OH
CH3OHⅡ.CO
 CO2
CO2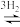 CH3OH+H2O
CH3OH+H2O(4)490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从平衡移动的角度,并结合反应①、②分析原因
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐3】(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示_______ ,K值大小与温度的关系是:温度升高,K值_______ 。(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生反应:CO(g) +H2O(g) CO2(g) +H2 (g) ΔH<0,CO和H2O浓度变化如图,则0~4min的平均反应速率υ(CO)=
CO2(g) +H2 (g) ΔH<0,CO和H2O浓度变化如图,则0~4min的平均反应速率υ(CO)=_______ mol∙L−1∙min−1。

(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表。
①表中3min~4min之间反应处于_______ 状态;c1数值_______ 0.08 mol∙L−1 (填大于、小于或等于)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是_______ (单选),表中5min~6min之间数值发生变化,可能的原因是_______ (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生反应:CO(g) +H2O(g)
 CO2(g) +H2 (g) ΔH<0,CO和H2O浓度变化如图,则0~4min的平均反应速率υ(CO)=
CO2(g) +H2 (g) ΔH<0,CO和H2O浓度变化如图,则0~4min的平均反应速率υ(CO)=
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表。
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①表中3min~4min之间反应处于
②反应在4min~5min间,平衡向逆方向移动,可能的原因是
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】下列事实中,不能用勒夏特列原理解释的是_____ (填序号)。
①溴水中存在如下平衡:Br2+H2O HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅
②对2H2O2 2H2O+O2↑的反应,使用MnO2可加快制O2的反应速率
2H2O+O2↑的反应,使用MnO2可加快制O2的反应速率
③反应:CO+NO2 CO2+NO ΔH<0,升高温度,平衡向逆反应方向移动
CO2+NO ΔH<0,升高温度,平衡向逆反应方向移动
④合成氨反应:N2+3H2 2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
⑤H2(g)+I2(g) 2HI(g),缩小体积加压颜色加深
2HI(g),缩小体积加压颜色加深
①溴水中存在如下平衡:Br2+H2O
 HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅②对2H2O2
 2H2O+O2↑的反应,使用MnO2可加快制O2的反应速率
2H2O+O2↑的反应,使用MnO2可加快制O2的反应速率③反应:CO+NO2
 CO2+NO ΔH<0,升高温度,平衡向逆反应方向移动
CO2+NO ΔH<0,升高温度,平衡向逆反应方向移动④合成氨反应:N2+3H2
 2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施⑤H2(g)+I2(g)
 2HI(g),缩小体积加压颜色加深
2HI(g),缩小体积加压颜色加深
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】密闭容器中发生反应: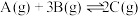
 ,根据下列
,根据下列 图象,回答问题:
图象,回答问题:
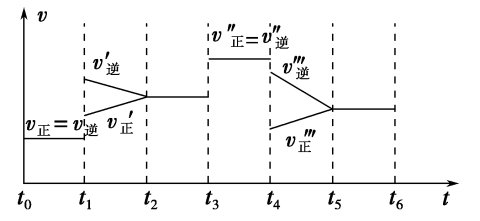
(1)下列时刻所改变的外界条件是
_______ ;
_______ ;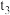
_______ 。
(2)反应速率最快的时间段是_______ 。
(3)下列措施能增大正反应速率的是_______。
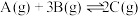
 ,根据下列
,根据下列 图象,回答问题:
图象,回答问题:
(1)下列时刻所改变的外界条件是


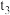
(2)反应速率最快的时间段是
(3)下列措施能增大正反应速率的是_______。
A.通入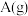 | B.分离出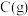 | C.降温 | D.增大容积 |
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐3】对于反应:2NO(g)+O2(g) 2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。

(1)比较p1、p2的大小关系:p1_____ p2。(填>、=或<)
(2)写出该反应的平衡常数表达式K=____ 。随温度升高,该反应平衡常数变化的趋势是____ (填“增大”或“减小”)。
 2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
(1)比较p1、p2的大小关系:p1
(2)写出该反应的平衡常数表达式K=
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐1】在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的ΔH___________ 0(填“大于”或“小于”);
(2) 100 ℃时,体系中各物质浓度随时间变化如图所示。
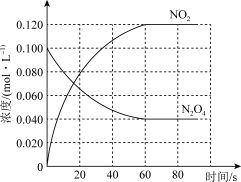
在0~60 s时段,反应速率v(N2O4)为___________ mol·L-1·s-1;反应的平衡常数K1为___________ 。
(3) 100 ℃时,反应达平衡后,将反应容器的容积减少一半。平衡向___________ (填“正反应”或“逆反应”)方向移动,判断理由是___________ 。
 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的ΔH
(2) 100 ℃时,体系中各物质浓度随时间变化如图所示。

在0~60 s时段,反应速率v(N2O4)为
(3) 100 ℃时,反应达平衡后,将反应容器的容积减少一半。平衡向
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】反应Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ/mol1,平衡常数为K;
FeO(s)+CO(g) ΔH=a kJ/mol1,平衡常数为K;
(1)若500℃时进行上述反应,CO2起始浓度为2 mol/L,CO的平衡浓度为________ 。
(2)上述反应中的a________ 0(填“大于”“小于”或“等于”)。
(3)700℃上述反应达到平衡,要使得该平衡向右移动,其他条件不变时,可以采取的措施有______ (填序号)。
A.缩小反应器体积 B.通入CO2
C.升高温度到900℃ D.使用合适的催化剂
 FeO(s)+CO(g) ΔH=a kJ/mol1,平衡常数为K;
FeO(s)+CO(g) ΔH=a kJ/mol1,平衡常数为K;| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
(1)若500℃时进行上述反应,CO2起始浓度为2 mol/L,CO的平衡浓度为
(2)上述反应中的a
(3)700℃上述反应达到平衡,要使得该平衡向右移动,其他条件不变时,可以采取的措施有
A.缩小反应器体积 B.通入CO2
C.升高温度到900℃ D.使用合适的催化剂
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐3】治理汽车尾气中NO和CO污染的一种方法是将其转化为无害的CO2和N2,反应原理为2NO(g)+2CO(g) 2CO2(g)+N2(g) △H<0。某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.4molNO和0.4molCO,在三种不同实验条件下进行上述反应体系各自保持温度不变),反应体系总压强随时间的变化如图所示。
2CO2(g)+N2(g) △H<0。某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.4molNO和0.4molCO,在三种不同实验条件下进行上述反应体系各自保持温度不变),反应体系总压强随时间的变化如图所示。
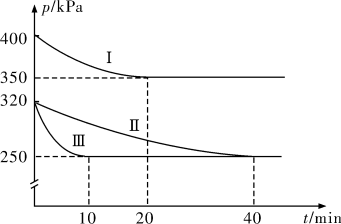
(1)与实验Ⅱ相比,实验Ⅰ和实验Ⅲ分别仅改变一种反应条件,所改变的条件为实验Ⅰ:__ ,实验Ⅲ:__
(2)三组实验中CO的平衡转化率αⅠ(CO)、αⅡ(CO)和αⅢ(CO)的大小关系为__ 。
(3)实验Ⅲ的平衡常数K=__ 。
 2CO2(g)+N2(g) △H<0。某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.4molNO和0.4molCO,在三种不同实验条件下进行上述反应体系各自保持温度不变),反应体系总压强随时间的变化如图所示。
2CO2(g)+N2(g) △H<0。某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.4molNO和0.4molCO,在三种不同实验条件下进行上述反应体系各自保持温度不变),反应体系总压强随时间的变化如图所示。
(1)与实验Ⅱ相比,实验Ⅰ和实验Ⅲ分别仅改变一种反应条件,所改变的条件为实验Ⅰ:
(2)三组实验中CO的平衡转化率αⅠ(CO)、αⅡ(CO)和αⅢ(CO)的大小关系为
(3)实验Ⅲ的平衡常数K=
您最近一年使用:0次



