汽车尾气的主要成分有CO、SO2、NO、NO2等。
(1)利用氨水可以将SO2、氮氧化物吸收,原理如下图所示。
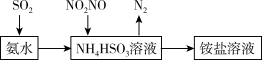
①25℃时,在pH=5的 NH4HSO3溶液中,c(SO32-)+c(NH3·H2O)-c(H2SO3)=__________ mol/L(填确值)
②请写出NO2和NO按体积比1:1被吸收时反应的离子方程式_____________________ 。
(2)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①已知:2NO(g)+O2(g)=2NO2(g) △H1=-113.0kJ·mol-1
3NO2(g)+H2O(g)=2HNO3(g)+NO(g) △H2=-138.0 kJ·mol-1
TiO2催化尾气降解原理可表示为:2COg)+O2(g) 2CO2(g) △H3
2CO2(g) △H3
则2H2O(g)+4NO(g)+3O2(g) 4HNO3(g) △H4=
4HNO3(g) △H4=______________________ 。
②在O2、H2O(g)浓度一定条件下,模拟CO、NO的降解,得到其降解率(即转化率)如图1所示。请解释T1后NO降解率下降的可能原因______________________ 。
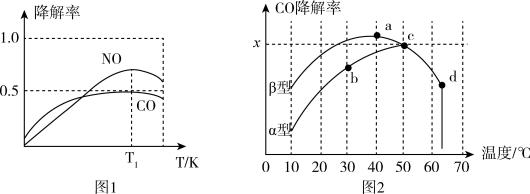
(3)沥青混凝土也可降解CO。如图2为在不同颗粒间隙的沥青混凝土(α、β型)在不同温度下,反应相同时间,测得CO降解率变化。结合如图回答下列问题:
①已知在50℃时在α型沥青混凝土容器中,平衡时O2浓度为0.01mol·L-1,求此温度下CO降解反应的平衡常数____________________________________________ 。(用含x的代数式表示)
②科研团队以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10℃~60℃范围内进行实验,请在如图中用线段与“ ”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(在图中画出)。
”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(在图中画出)。____________
(4)TiO2纳米管的制备是在弱酸性水溶液中以金属钛为阳极进行电解,写出阳极的电极反应式____________________________________________ 。
(1)利用氨水可以将SO2、氮氧化物吸收,原理如下图所示。

①25℃时,在pH=5的 NH4HSO3溶液中,c(SO32-)+c(NH3·H2O)-c(H2SO3)=
②请写出NO2和NO按体积比1:1被吸收时反应的离子方程式
(2)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①已知:2NO(g)+O2(g)=2NO2(g) △H1=-113.0kJ·mol-1
3NO2(g)+H2O(g)=2HNO3(g)+NO(g) △H2=-138.0 kJ·mol-1
TiO2催化尾气降解原理可表示为:2COg)+O2(g)
 2CO2(g) △H3
2CO2(g) △H3则2H2O(g)+4NO(g)+3O2(g)
 4HNO3(g) △H4=
4HNO3(g) △H4=②在O2、H2O(g)浓度一定条件下,模拟CO、NO的降解,得到其降解率(即转化率)如图1所示。请解释T1后NO降解率下降的可能原因

(3)沥青混凝土也可降解CO。如图2为在不同颗粒间隙的沥青混凝土(α、β型)在不同温度下,反应相同时间,测得CO降解率变化。结合如图回答下列问题:
①已知在50℃时在α型沥青混凝土容器中,平衡时O2浓度为0.01mol·L-1,求此温度下CO降解反应的平衡常数
②科研团队以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10℃~60℃范围内进行实验,请在如图中用线段与“
 ”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(在图中画出)。
”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(在图中画出)。(4)TiO2纳米管的制备是在弱酸性水溶液中以金属钛为阳极进行电解,写出阳极的电极反应式
更新时间:2019/02/13 09:54:51
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】氧气是一种常见的氧化剂,用途广泛。回答下列问题:
(1)用H2O2制取O2时,分解的热化学方程式为: 2H2O2(aq)=2H2O(l) +O2(g) ΔH= a kJ·mol-1
①相同条件下,H2O2分解时,无论是否使用催化剂,均不会改变的是_______ (填标号)。
A 反应速率 B 反应热 C 活化能 D 生成物
②以Fe3+作催化剂时,H2O2的分解反应分两步进行,第一步反应为: H2O2(aq) + 2Fe3+ (aq)=2Fe2+ (aq) +O2(g) +2H+ (aq)ΔH=b kJ·mol-1
第二步反应的热化学方程式为____________ 。
(2)工业上用Cl2生产某些含氯有机物时产生HCl副产物,可用O2将其转化为Cl2,实现循环利用[O2(g) + 4HCl(g) 2Cl2(g) + 2H2O(g)]。将1 molO2和4 molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
2Cl2(g) + 2H2O(g)]。将1 molO2和4 molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
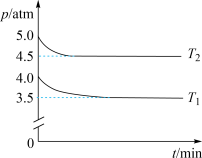
①该反应的速率v = k ca(O2)·cb(HCl)(k为速率常数),下列说法正确的是____________ (填标号)。
A 使用催化剂,k不变
B 温度升高,k增大
C 平衡后分离出水蒸气,k变小
D 平衡后再充入1molO2和4molHCl,反应物转化率都增大
②T1________ T2(填“>”或“<”)。该反应的ΔH______ 0(填“>”或“<”),判断的依据是_________ 。
③T2时,HCl的平衡转化率=________ ,反应的Kx=_____ (Kx为以物质的量分数表示的平衡常数)。
(1)用H2O2制取O2时,分解的热化学方程式为: 2H2O2(aq)=2H2O(l) +O2(g) ΔH= a kJ·mol-1
①相同条件下,H2O2分解时,无论是否使用催化剂,均不会改变的是
A 反应速率 B 反应热 C 活化能 D 生成物
②以Fe3+作催化剂时,H2O2的分解反应分两步进行,第一步反应为: H2O2(aq) + 2Fe3+ (aq)=2Fe2+ (aq) +O2(g) +2H+ (aq)ΔH=b kJ·mol-1
第二步反应的热化学方程式为
(2)工业上用Cl2生产某些含氯有机物时产生HCl副产物,可用O2将其转化为Cl2,实现循环利用[O2(g) + 4HCl(g)
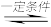 2Cl2(g) + 2H2O(g)]。将1 molO2和4 molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
2Cl2(g) + 2H2O(g)]。将1 molO2和4 molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
①该反应的速率v = k ca(O2)·cb(HCl)(k为速率常数),下列说法正确的是
A 使用催化剂,k不变
B 温度升高,k增大
C 平衡后分离出水蒸气,k变小
D 平衡后再充入1molO2和4molHCl,反应物转化率都增大
②T1
③T2时,HCl的平衡转化率=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】工业生产硫酸中, 的催化氧化是关键步骤,排放处理未达标的尾气会产生严重的空气污染。回答下列问题:
的催化氧化是关键步骤,排放处理未达标的尾气会产生严重的空气污染。回答下列问题:
(1) 是形成酸雨的污染物之一,酸雨的pH范围是
是形成酸雨的污染物之一,酸雨的pH范围是___________ 。
(2)已知:①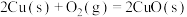
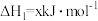
②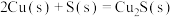
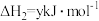
③
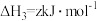
写出 和
和 反应生成
反应生成 和
和 的热化学方程式
的热化学方程式___________ 。
(3)硫酸工业中涉及反应: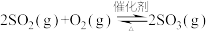
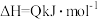 。一定条件下,在恒压密闭容器中,通入
。一定条件下,在恒压密闭容器中,通入 和
和 发生上述反应,
发生上述反应, 的平衡转化率和压强、温度的关系如图所示。a点时该反应的压强平衡常数Kp=
的平衡转化率和压强、温度的关系如图所示。a点时该反应的压强平衡常数Kp=___________ (保留三位有效数字,已知:分压=气体总压强×该气体的物质的量分数,用各气体物质的分压替代浓度计算的平衡常数叫压强平衡常数)。
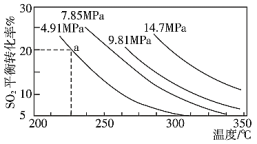
恒压条件下,关于该反应的下列说法中正确的是___________ 。
A.Q大于0
B.相同时间内生成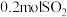 ,同时消耗
,同时消耗 ,反应达到平衡
,反应达到平衡
C.相同温度下压强越大, 的转化率就越大,该反应的平衡常数就越大
的转化率就越大,该反应的平衡常数就越大
D.反应达到平衡后,保持温度不变,再充入 和
和 ,
, 的平衡转化率不变
的平衡转化率不变
(4)已知:25℃时,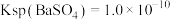 ,
,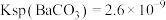 ,该温度下
,该温度下 与
与 沉淀共存的悬浊液中,
沉淀共存的悬浊液中,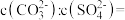
___________ 。
(5)用如图装置回收 ,可制得硫酸,电极均为惰性电极,a、b膜分别为阳离子、阴离子交换膜,写出阴极的电极反应式
,可制得硫酸,电极均为惰性电极,a、b膜分别为阳离子、阴离子交换膜,写出阴极的电极反应式___________ 。当阴极收集到标准状况下的 时,理论上在阳极能得到
时,理论上在阳极能得到___________ 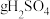 。
。

 的催化氧化是关键步骤,排放处理未达标的尾气会产生严重的空气污染。回答下列问题:
的催化氧化是关键步骤,排放处理未达标的尾气会产生严重的空气污染。回答下列问题:(1)
 是形成酸雨的污染物之一,酸雨的pH范围是
是形成酸雨的污染物之一,酸雨的pH范围是(2)已知:①
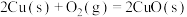
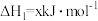
②
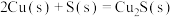
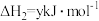
③

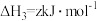
写出
 和
和 反应生成
反应生成 和
和 的热化学方程式
的热化学方程式(3)硫酸工业中涉及反应:
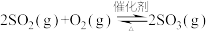
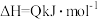 。一定条件下,在恒压密闭容器中,通入
。一定条件下,在恒压密闭容器中,通入 和
和 发生上述反应,
发生上述反应, 的平衡转化率和压强、温度的关系如图所示。a点时该反应的压强平衡常数Kp=
的平衡转化率和压强、温度的关系如图所示。a点时该反应的压强平衡常数Kp=
恒压条件下,关于该反应的下列说法中正确的是
A.Q大于0
B.相同时间内生成
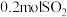 ,同时消耗
,同时消耗 ,反应达到平衡
,反应达到平衡C.相同温度下压强越大,
 的转化率就越大,该反应的平衡常数就越大
的转化率就越大,该反应的平衡常数就越大D.反应达到平衡后,保持温度不变,再充入
 和
和 ,
, 的平衡转化率不变
的平衡转化率不变(4)已知:25℃时,
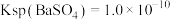 ,
,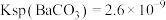 ,该温度下
,该温度下 与
与 沉淀共存的悬浊液中,
沉淀共存的悬浊液中,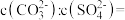
(5)用如图装置回收
 ,可制得硫酸,电极均为惰性电极,a、b膜分别为阳离子、阴离子交换膜,写出阴极的电极反应式
,可制得硫酸,电极均为惰性电极,a、b膜分别为阳离子、阴离子交换膜,写出阴极的电极反应式 时,理论上在阳极能得到
时,理论上在阳极能得到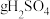 。
。
您最近一年使用:0次
【推荐3】碳热还原法广泛用于合金及材料的制备。回下列问题:
(1)一种制备氮氧化铝的反应原理为23Al2O3+15C+5N2=2Al23O27N5+15CO ,产物Al23O27N5中氮的化合价为______ ,该反应中每生成1 mol Al23O27N5,转移的电子数为________ NA。
(2)真空碳热冶铝法包含很多反应,其中的三个反应如下:
Al2O3(s)+3C(s) =Al2OC(s)+2CO(g) ΔH1
2Al2OC(s)+3C(s) =Al4C3(s)+2CO(g) ΔH2
2Al2O3(s)+9C(s)= Al4C3(s)+6CO(g) ΔH3
①ΔH3=_________ (用ΔH1、ΔH2表示)。
②Al4C3可与足量盐酸反应制备一种烃。该反应的化学方程式为____________ 。
(3)下列是碳热还原法制锰合金的三个反应,CO与CO2平衡分压比的自然对数值与温度的关系如图所示(已知Kp是用平衡分压代替浓度计算所得的平衡常数)。
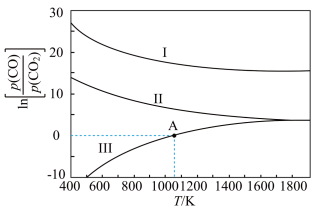
Ⅰ.Mn3C(s)+4CO2(g) 3MnO(s)+5CO(g) Kp(Ⅰ)
3MnO(s)+5CO(g) Kp(Ⅰ)
Ⅱ.Mn(s)+CO2(g) MnO(s)+CO(g) Kp(Ⅱ)
MnO(s)+CO(g) Kp(Ⅱ)
Ⅲ.Mn3C(s)+CO2(g) 3Mn(s)+2CO(g) Kp(Ⅲ)
3Mn(s)+2CO(g) Kp(Ⅲ)
①ΔH>0的反应是____ (填“Ⅰ”“Ⅱ”或“Ⅲ”)。
②1200 K时,在一体积为2 L的恒容密闭容器中有17.7 g Mn3C(s)和0.4 mol CO2,只发生反应Ⅰ,5 min后达到平衡,此时CO的浓度为0.125 mol/L,则0~5 min内v(CO2)=_________ 。
③在一体积可变的密闭容器中加入一定量的Mn(s)并充入一定量的CO2(g),只发生反应Ⅱ,下列能说明反应Ⅱ达到平衡的是____ (填字母)。
A.容器的体积不再改变
B.固体的质量不再改变
C.气体的总质量不再改变
(1)一种制备氮氧化铝的反应原理为23Al2O3+15C+5N2=2Al23O27N5+15CO ,产物Al23O27N5中氮的化合价为
(2)真空碳热冶铝法包含很多反应,其中的三个反应如下:
Al2O3(s)+3C(s) =Al2OC(s)+2CO(g) ΔH1
2Al2OC(s)+3C(s) =Al4C3(s)+2CO(g) ΔH2
2Al2O3(s)+9C(s)= Al4C3(s)+6CO(g) ΔH3
①ΔH3=
②Al4C3可与足量盐酸反应制备一种烃。该反应的化学方程式为
(3)下列是碳热还原法制锰合金的三个反应,CO与CO2平衡分压比的自然对数值与温度的关系如图所示(已知Kp是用平衡分压代替浓度计算所得的平衡常数)。

Ⅰ.Mn3C(s)+4CO2(g)
 3MnO(s)+5CO(g) Kp(Ⅰ)
3MnO(s)+5CO(g) Kp(Ⅰ)Ⅱ.Mn(s)+CO2(g)
 MnO(s)+CO(g) Kp(Ⅱ)
MnO(s)+CO(g) Kp(Ⅱ)Ⅲ.Mn3C(s)+CO2(g)
 3Mn(s)+2CO(g) Kp(Ⅲ)
3Mn(s)+2CO(g) Kp(Ⅲ)①ΔH>0的反应是
②1200 K时,在一体积为2 L的恒容密闭容器中有17.7 g Mn3C(s)和0.4 mol CO2,只发生反应Ⅰ,5 min后达到平衡,此时CO的浓度为0.125 mol/L,则0~5 min内v(CO2)=
③在一体积可变的密闭容器中加入一定量的Mn(s)并充入一定量的CO2(g),只发生反应Ⅱ,下列能说明反应Ⅱ达到平衡的是
A.容器的体积不再改变
B.固体的质量不再改变
C.气体的总质量不再改变
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料。
(1)乙烷在一定条件可发生如下反应:C2H6(g)=C2H4(g)+H2(g) ΔH,相关物质的燃烧热数据如表所示:
①ΔH=_______ kJ·mol−1.(用ΔH1、ΔH2、ΔH3 表示)
②在体积为0.15L的密闭容器中通入1mol乙烷和1mol氢气,乙烷的平衡转化率为0.2.反应的平衡常数K=_______ 。
(2)可逆反应2NO2(g) 2NO(g)+O2(g)在恒容密闭容器中进行,可说明该反应达到化学平衡状态的是
2NO(g)+O2(g)在恒容密闭容器中进行,可说明该反应达到化学平衡状态的是_______ 。
A.单位时间内生成n mol O2的同时,生成2n mol NO2
B.单位时间内生成n mol O2的同时,生成2n mol NO
C.用NO2、NO和O2的物质的量浓度变化表示的反应速率之比2:2:1
D.混合气体的颜色不再改变
E.混合气体的密度不再改变
F.混合气体的压强不再改变
(3)已知PbS与O2在高温时生成铅的氧化物和SO2,化学平衡常数(K)的表达式为: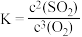 。写出上述反应的化学方程式
。写出上述反应的化学方程式_______ 。
(4)SO2、Na2S2O3、Na2S、Na2SO3、Na2SO4是五种含硫的化合物。
①上述物质中,Na2SO3溶液中各离子浓度由大到小的顺序是_______ 。
②Na2S又称臭碱,用离子方程式说明Na2S溶液呈碱性的原因_______ 。
(5)电解后的废水经过处理后,依然存在Mn2+。向含有0.020mol·L-1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4mol·L-1时,Mn2+开始沉淀,则a=_______ 。[已知:H2S的电离常数K1=1.0×10-7,K2=7.0×10-15;Ksp(MnS)=1.4×10-15]
(1)乙烷在一定条件可发生如下反应:C2H6(g)=C2H4(g)+H2(g) ΔH,相关物质的燃烧热数据如表所示:
| 物质 | C2H6(g) | C2H4(g) | H2(g) |
| E/( kJ·mol−1) | ΔH1 | ΔH2 | ΔH3 |
①ΔH=
②在体积为0.15L的密闭容器中通入1mol乙烷和1mol氢气,乙烷的平衡转化率为0.2.反应的平衡常数K=
(2)可逆反应2NO2(g)
 2NO(g)+O2(g)在恒容密闭容器中进行,可说明该反应达到化学平衡状态的是
2NO(g)+O2(g)在恒容密闭容器中进行,可说明该反应达到化学平衡状态的是A.单位时间内生成n mol O2的同时,生成2n mol NO2
B.单位时间内生成n mol O2的同时,生成2n mol NO
C.用NO2、NO和O2的物质的量浓度变化表示的反应速率之比2:2:1
D.混合气体的颜色不再改变
E.混合气体的密度不再改变
F.混合气体的压强不再改变
(3)已知PbS与O2在高温时生成铅的氧化物和SO2,化学平衡常数(K)的表达式为:
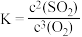 。写出上述反应的化学方程式
。写出上述反应的化学方程式(4)SO2、Na2S2O3、Na2S、Na2SO3、Na2SO4是五种含硫的化合物。
①上述物质中,Na2SO3溶液中各离子浓度由大到小的顺序是
②Na2S又称臭碱,用离子方程式说明Na2S溶液呈碱性的原因
(5)电解后的废水经过处理后,依然存在Mn2+。向含有0.020mol·L-1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4mol·L-1时,Mn2+开始沉淀,则a=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】 捕集技术能有效解决温室效应及能源短缺问题。
捕集技术能有效解决温室效应及能源短缺问题。
(1) 催化加氢制
催化加氢制 的反应体系中,发生的反应如下:
的反应体系中,发生的反应如下:
反应Ⅰ:

反应Ⅱ:

反应Ⅲ:

将 与
与 按照一定流速通过催化剂反应,测得
按照一定流速通过催化剂反应,测得 的转化率与产物的选择性
的转化率与产物的选择性 选择性
选择性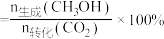 ]随温度变化如图所示:
]随温度变化如图所示:
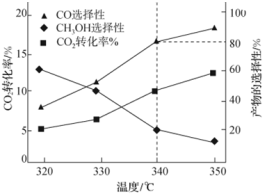
①
________ (用含 、
、 的式子表示)。
的式子表示)。
②反应Ⅲ的平衡常数表达式为________ 。
③340℃时,原料气按 相同流速通过催化剂反应,出口处测得气体中
相同流速通过催化剂反应,出口处测得气体中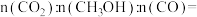
________ 。
(2)电催化还原 生成含碳产物(如CO、
生成含碳产物(如CO、 等)原理如图所示:
等)原理如图所示:

若阴极产物为 ,则该电极反应式为
,则该电极反应式为________ 。
(3)对于反应
 ,在一定条件下存在:
,在一定条件下存在: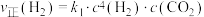 或
或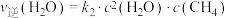 ,相应的速率与温度关系如图所示。
,相应的速率与温度关系如图所示。
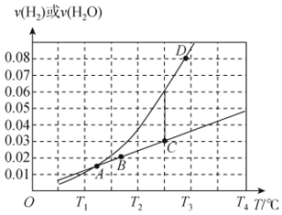
该反应的平衡常数
________ (用含 、
、 的代数式表示),图中A、B、C、D四个点中,能表示反应已达到平衡状态的是
的代数式表示),图中A、B、C、D四个点中,能表示反应已达到平衡状态的是________ 。
 捕集技术能有效解决温室效应及能源短缺问题。
捕集技术能有效解决温室效应及能源短缺问题。(1)
 催化加氢制
催化加氢制 的反应体系中,发生的反应如下:
的反应体系中,发生的反应如下:反应Ⅰ:


反应Ⅱ:


反应Ⅲ:


将
 与
与 按照一定流速通过催化剂反应,测得
按照一定流速通过催化剂反应,测得 的转化率与产物的选择性
的转化率与产物的选择性 选择性
选择性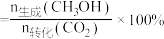 ]随温度变化如图所示:
]随温度变化如图所示:
①

 、
、 的式子表示)。
的式子表示)。②反应Ⅲ的平衡常数表达式为
③340℃时,原料气按
 相同流速通过催化剂反应,出口处测得气体中
相同流速通过催化剂反应,出口处测得气体中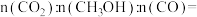
(2)电催化还原
 生成含碳产物(如CO、
生成含碳产物(如CO、 等)原理如图所示:
等)原理如图所示:
若阴极产物为
 ,则该电极反应式为
,则该电极反应式为(3)对于反应

 ,在一定条件下存在:
,在一定条件下存在: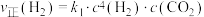 或
或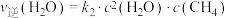 ,相应的速率与温度关系如图所示。
,相应的速率与温度关系如图所示。
该反应的平衡常数

 、
、 的代数式表示),图中A、B、C、D四个点中,能表示反应已达到平衡状态的是
的代数式表示),图中A、B、C、D四个点中,能表示反应已达到平衡状态的是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。消除汽车尾气中的NO、CO,有利于减少PM2.5 的排放。已知如下信息:
①2CO(g)+2NO(g) 2CO2(g)+N2(g) △H1=- 748kJ/mol
2CO2(g)+N2(g) △H1=- 748kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2 =-565kJ/mol
(1)在一定条件下N2和O2会转化为NO,写出该反应的热化学方程式:______________ 。
(2)为研究不同条件对反应的影响,在恒温条件下,向2L 恒容密闭容器中加入0.2molNO 和0.3molCO,在催化剂存在的条件下发生反应①,10min 时反应达到平衡,测得10min 内v(NO)=7.5×10-3mol/(L•min),则平衡后CO 的转化率为_______________ 。
(3)其他条件相同,t min 时不同温度下测得NO 的转化率如图( I)所示。A 点的反应速率v正___ (填“>”、“<”或“=”)v逆,A、B两点反应的平衡常数较大的是_______ (填“A”或“B”),理由是__________________ 。
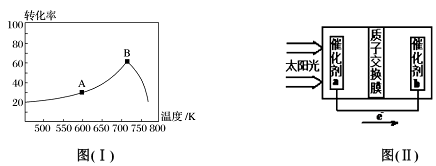
(4)已知常温下: Ka(HNO2)=7.1×10-4mol/L;Kb(NH3·H2O)=1.7×10-5mol/L。0.1mol/LNH4NO2溶液中离子浓度由大到小的顺序是_________ ,常温下NO2-水解反应的平衡常数K=____ 。
(5)人工光合作用能够借助太阳能用CO2和水制备化学原料,图(II )是通过人工光合作用制备HCOOH 的原理示意图,请写出催化剂b处的电极反应式:______________ 。
①2CO(g)+2NO(g)
 2CO2(g)+N2(g) △H1=- 748kJ/mol
2CO2(g)+N2(g) △H1=- 748kJ/mol②2CO(g)+O2(g)=2CO2(g) △H2 =-565kJ/mol
(1)在一定条件下N2和O2会转化为NO,写出该反应的热化学方程式:
(2)为研究不同条件对反应的影响,在恒温条件下,向2L 恒容密闭容器中加入0.2molNO 和0.3molCO,在催化剂存在的条件下发生反应①,10min 时反应达到平衡,测得10min 内v(NO)=7.5×10-3mol/(L•min),则平衡后CO 的转化率为
(3)其他条件相同,t min 时不同温度下测得NO 的转化率如图( I)所示。A 点的反应速率v正

(4)已知常温下: Ka(HNO2)=7.1×10-4mol/L;Kb(NH3·H2O)=1.7×10-5mol/L。0.1mol/LNH4NO2溶液中离子浓度由大到小的顺序是
(5)人工光合作用能够借助太阳能用CO2和水制备化学原料,图(II )是通过人工光合作用制备HCOOH 的原理示意图,请写出催化剂b处的电极反应式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】一定温度下,在三个体积均为5.0 L的恒容密闭容器中分别加入一定量的X,发生反应: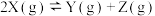 ,相关数据如下表所示:
,相关数据如下表所示:
回答下列问题:
(1)表中a=_______ ,c=_______ 。
(2)已知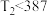 ℃,则该正反应为
℃,则该正反应为_______ (填放热或吸热)反应,判断理由是_______ 。
(3)容器Ⅱ中平衡常数
_______ ;容器Ⅰ和容器Ⅱ中X的转化率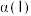
_______ (填“>”、“<”或“=”)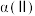 。
。
(4)387℃时,向容器Ⅰ中充入0.1 mol X、0.15 mol Y和0.10 mol Z,则反应将向_______ (填正或逆)反应方向进行,判断理由是_______ 。
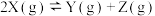 ,相关数据如下表所示:
,相关数据如下表所示:| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| X(g) | Y(g) | Z(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ |  | 0.40 | b | 0.160 |
| Ⅲ |  | 0.20 | c | 0.090 |
回答下列问题:
(1)表中a=
(2)已知
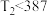 ℃,则该正反应为
℃,则该正反应为(3)容器Ⅱ中平衡常数

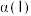
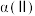 。
。(4)387℃时,向容器Ⅰ中充入0.1 mol X、0.15 mol Y和0.10 mol Z,则反应将向
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】Ⅰ 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题。
(1)如图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图(图中涉及物质为气态),请写出NO2和CO反应的热化学方程式___________ 。

(2)在体积为3L的恒容密闭容器中,投入4molN2和9molH2,在一定条件下合成氨,不同温度下测得的数据如下表所示:
已知:破坏1molN2(g)和3molH2(g)中的化学键消耗的总能量小于破坏2molNH3(g)中的化学键消耗的能量。
①则T1___________ T2 (填“>”“<”或“=”)
②在T2K下,经过5min达到化学平衡状态,则0~5min内H2的平均速率υ(H2)=___________ 。
Ⅱ.在一定温度下,向2L固定容积的密闭容器中通入2molCO2、3molH2,发生反应CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H3<0,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g) +H2O(g) △H3<0,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。

(1)能说明该反应已达平衡状态的是___________ 。
A.CO2的体积分数在混合气体中保持不变
B.体系中n(CO2)/n(H2)=1:1,且保持不变
C.混合气体的密度不随时间变化
D.单位时间内有n molH−H键断裂,同时又n mol O−H键生成
(2)下列措施能使n(CH3OH)/n(CO2)增大的是___________ 。
A.升高温度 B.恒温恒容充入He(g)
C.使用高效催化剂 D.恒温恒容下,再充入2molCO2、3molH2
(3)计算该温度下此反应的平衡常数K=___________ (L/mol)2;若使K的值变为1,则应采取的措施是___________ 。
A.增大压强 B.恒压加入一定量H2 C.降低温度 D.升高温度
(4)捕捉CO2可以利用Na2CO3溶液。用100mL 0.1 mol∙L−1Na2CO3溶液完全捕捉224mL(已换算为标准状况,溶液体积变化忽略不计)CO2气体,所得溶液中:]
①c( )+c(
)+c( )+c(H2CO3)=
)+c(H2CO3)=___________ mol∙L−1 (填数字)
②c( )+2c(
)+2c( )=
)=___________ (用相关离子浓度表示)
(1)如图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图(图中涉及物质为气态),请写出NO2和CO反应的热化学方程式

(2)在体积为3L的恒容密闭容器中,投入4molN2和9molH2,在一定条件下合成氨,不同温度下测得的数据如下表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
①则T1
②在T2K下,经过5min达到化学平衡状态,则0~5min内H2的平均速率υ(H2)=
Ⅱ.在一定温度下,向2L固定容积的密闭容器中通入2molCO2、3molH2,发生反应CO2(g) +3H2(g)
 CH3OH(g) +H2O(g) △H3<0,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g) +H2O(g) △H3<0,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
(1)能说明该反应已达平衡状态的是
A.CO2的体积分数在混合气体中保持不变
B.体系中n(CO2)/n(H2)=1:1,且保持不变
C.混合气体的密度不随时间变化
D.单位时间内有n molH−H键断裂,同时又n mol O−H键生成
(2)下列措施能使n(CH3OH)/n(CO2)增大的是
A.升高温度 B.恒温恒容充入He(g)
C.使用高效催化剂 D.恒温恒容下,再充入2molCO2、3molH2
(3)计算该温度下此反应的平衡常数K=
A.增大压强 B.恒压加入一定量H2 C.降低温度 D.升高温度
(4)捕捉CO2可以利用Na2CO3溶液。用100mL 0.1 mol∙L−1Na2CO3溶液完全捕捉224mL(已换算为标准状况,溶液体积变化忽略不计)CO2气体,所得溶液中:]
①c(
 )+c(
)+c( )+c(H2CO3)=
)+c(H2CO3)=②c(
 )+2c(
)+2c( )=
)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】硝酸广泛用于化肥、化纤、医药、染料、橡胶等的制造,在国防工业、冶金工业、印染工业以及其他工业部门中,也是不可缺少的重要的化学试剂。
(1)工业生产中未直接在一个设备中将 催化氧化至
催化氧化至 ,而设计了两步氧化,中间经过热交换器降温,这样做的目的除了节约能源,还有
,而设计了两步氧化,中间经过热交换器降温,这样做的目的除了节约能源,还有_____ 目的;
(2)实验发现,单位时间内 的氧化率[
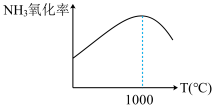
的氧化率[ ]会随着温度的升高先增大后减小(如图所示),分析1000℃后
]会随着温度的升高先增大后减小(如图所示),分析1000℃后 的氧化率减小的可能原因
的氧化率减小的可能原因_____
(3) 的反应历程如下:
的反应历程如下:
反应Ⅰ: (快)
(快) 


反应Ⅱ: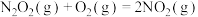 (慢)
(慢) 

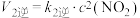
①一定条件下,反应 达到平衡状态,平衡常数
达到平衡状态,平衡常数
_____ (用含 、
、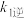 、
、 、
、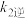 的代数式表示);
的代数式表示);
②已知反应速率常数k随温度升高而增大,则升高温度后 增大的倍数
增大的倍数_____ 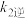 增大的倍数(填“大于”“小于”或“等于”)。
增大的倍数(填“大于”“小于”或“等于”)。
(Ⅱ)工业上也可以直接由 合成
合成 ,其中最关键的步骤为
,其中最关键的步骤为 ,利用现代手持技术传感器可以探究压强对该平衡的影响。
,利用现代手持技术传感器可以探究压强对该平衡的影响。
在恒定温度和标准压强条件下,往针筒中充入一定体积的 气体后密封并保持活塞位置不变。分别在
气体后密封并保持活塞位置不变。分别在 、
、 时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。
时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。

(4)有关该过程说法正确的是_____
a.E、H两点对应的 的体积分数较大的为E点
的体积分数较大的为E点
b.B向里快速推注射器活塞,E向外快速拉注射器活塞
c.B、C、D三点正反应速率最大的是B点
d.C点时体系的颜色比D点深X
(5)下列表述能表示该反应已达平衡的是_____ (填序号)
a.活塞位置不变时,针管中的压强不再改变
b.针管内各物质的物质的量相等
c.针管内气体的平均摩尔质量不再改变
d.针管中温度、压强不变时,管内气体的密度不再改变
(6)求D点
_____ (不必化成小数)
(7)图像中C、E两点气体平均摩尔质量最大的点为_____ (填代号)。
(1)工业生产中未直接在一个设备中将
 催化氧化至
催化氧化至 ,而设计了两步氧化,中间经过热交换器降温,这样做的目的除了节约能源,还有
,而设计了两步氧化,中间经过热交换器降温,这样做的目的除了节约能源,还有(2)实验发现,单位时间内
 的氧化率[
的氧化率[ ]会随着温度的升高先增大后减小(如图所示),分析1000℃后
]会随着温度的升高先增大后减小(如图所示),分析1000℃后 的氧化率减小的可能原因
的氧化率减小的可能原因
(3)
 的反应历程如下:
的反应历程如下:反应Ⅰ:
 (快)
(快) 


反应Ⅱ:
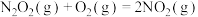 (慢)
(慢) 

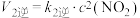
①一定条件下,反应
 达到平衡状态,平衡常数
达到平衡状态,平衡常数
 、
、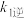 、
、 、
、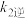 的代数式表示);
的代数式表示);②已知反应速率常数k随温度升高而增大,则升高温度后
 增大的倍数
增大的倍数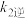 增大的倍数(填“大于”“小于”或“等于”)。
增大的倍数(填“大于”“小于”或“等于”)。(Ⅱ)工业上也可以直接由
 合成
合成 ,其中最关键的步骤为
,其中最关键的步骤为 ,利用现代手持技术传感器可以探究压强对该平衡的影响。
,利用现代手持技术传感器可以探究压强对该平衡的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的
 气体后密封并保持活塞位置不变。分别在
气体后密封并保持活塞位置不变。分别在 、
、 时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。
时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。
(4)有关该过程说法正确的是
a.E、H两点对应的
 的体积分数较大的为E点
的体积分数较大的为E点b.B向里快速推注射器活塞,E向外快速拉注射器活塞
c.B、C、D三点正反应速率最大的是B点
d.C点时体系的颜色比D点深X
(5)下列表述能表示该反应已达平衡的是
a.活塞位置不变时,针管中的压强不再改变
b.针管内各物质的物质的量相等
c.针管内气体的平均摩尔质量不再改变
d.针管中温度、压强不变时,管内气体的密度不再改变
(6)求D点

(7)图像中C、E两点气体平均摩尔质量最大的点为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】I.某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.0 mL于锥形瓶中,加入10.0 mL的KI溶液(足量),发生的反应为:Cl2+2KI=2KCl+I2,滴入指示剂2~3滴。
②取一滴定管依次用自来水、蒸馏水洗净后,再用0.01mol·L-1 Na2S2O3溶液润洗,然后装入0.01mol·L-1 Na2S2O3溶液到0刻度以上,排出下端尖嘴内的气泡,调整液面至0刻度或0刻度下某一位置,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+ 2Na2S4O6。试回答下列问答:
(1)步骤①加入的指示剂是_______________________________ 。
(2)步骤②应使用________ 式滴定管。
(3)判断达到滴定终点的实验现象是___________________________________ 。
Ⅱ.(4)若用0.1032 mol/L HCl溶液滴定未知浓度的NaOH溶液,下列情况对实验结果无影响的是____________ 。
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D.滴定时将标准液溅出锥形瓶外
(5)碳酸H2CO3,K1=4.3×10-7,K2=5.6×10-11,草酸H2C2O4 K1=5.9×10-2,K2=6.4×10-5。0.1 mol/L Na2CO3溶液的pH____________ 0.1 mol/L Na2C2O4溶液的pH(选填“大于”、“小于”或“等于”)。若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____________ 。
A.c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-)
B.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
C.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-)
D.c(H2CO3) >c(HCO3-)>c(HC2O4-)>c(CO32-)
①取水样10.0 mL于锥形瓶中,加入10.0 mL的KI溶液(足量),发生的反应为:Cl2+2KI=2KCl+I2,滴入指示剂2~3滴。
②取一滴定管依次用自来水、蒸馏水洗净后,再用0.01mol·L-1 Na2S2O3溶液润洗,然后装入0.01mol·L-1 Na2S2O3溶液到0刻度以上,排出下端尖嘴内的气泡,调整液面至0刻度或0刻度下某一位置,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+ 2Na2S4O6。试回答下列问答:
(1)步骤①加入的指示剂是
(2)步骤②应使用
(3)判断达到滴定终点的实验现象是
Ⅱ.(4)若用0.1032 mol/L HCl溶液滴定未知浓度的NaOH溶液,下列情况对实验结果无影响的是
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D.滴定时将标准液溅出锥形瓶外
(5)碳酸H2CO3,K1=4.3×10-7,K2=5.6×10-11,草酸H2C2O4 K1=5.9×10-2,K2=6.4×10-5。0.1 mol/L Na2CO3溶液的pH
A.c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-)
B.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
C.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-)
D.c(H2CO3) >c(HCO3-)>c(HC2O4-)>c(CO32-)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈_______ 性,原因是___________________________ ;(用离子方程式表示)
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于________ ;
(3)已知在H2S溶液中存在下列平衡:H2S HS﹣+H+①向H2S溶液中加入NaOH固体时,(不考虑温度变化)电离平衡向
HS﹣+H+①向H2S溶液中加入NaOH固体时,(不考虑温度变化)电离平衡向________ 移动,(填“左”或“右”)c(H+)________ .(填“增大”、“减小”或“不变”)
②向H2S溶液中加入NaHS固体时,电离平衡向________ 移动,(填“左”或“右”)c(S2﹣)________ .(填“增大”、“减小”或“不变”)
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是________ (填“A”或“B”);设盐酸中加入的Zn质量为m1 , 醋酸溶液中加入的Zn质量为m2 . 则m1________ m2 . (选填“<”、“=”、“>”)

(5)难溶电解质在水溶液中存在溶解平衡, 某MgSO4溶液里c(Mg2+)=0.002mol•L﹣1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于________ ;(该温度下Mg(OH)2的Ksp=2×10﹣11)
(6)常温下,在NH4Cl溶液中离子浓度由大到小的顺序为________ .
(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于
(3)已知在H2S溶液中存在下列平衡:H2S
 HS﹣+H+①向H2S溶液中加入NaOH固体时,(不考虑温度变化)电离平衡向
HS﹣+H+①向H2S溶液中加入NaOH固体时,(不考虑温度变化)电离平衡向②向H2S溶液中加入NaHS固体时,电离平衡向
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是

(5)难溶电解质在水溶液中存在溶解平衡, 某MgSO4溶液里c(Mg2+)=0.002mol•L﹣1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于
(6)常温下,在NH4Cl溶液中离子浓度由大到小的顺序为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】硫化氢(H2S)、二氧化硫(SO2)是有害气体,可用多种方法进行脱除。
(1)实验室制取乙炔时,用硫酸铜溶液除去乙炔气体中混有的H2S气体,发生反应:H2S(aq)+Cu2+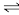 CuS(s)+2H+(aq),计算25℃时,该反应的平衡常数为
CuS(s)+2H+(aq),计算25℃时,该反应的平衡常数为___________ 。 (已知25℃时Ksp (CuS) =1.25×10−36,Ka1 (H2S) =10−7,Ka2 (H2S ) =10−12)
(2)通过电化学循环法可将H2S转化为H2SO4和H2(如图所示)。其中氧化过程发生如下两步反应: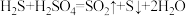 、
、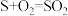 。
。
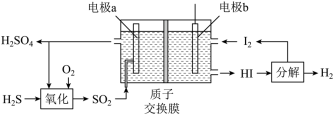
①电极a上发生反应的电极反应式为___________ 。
②理论上1 mol H2S参加反应可产生H2的物质的量为___________ 。
(3)硫酸工业的尾气中含SO2等污染性气体,通常用碱液如氨水进行吸收处理,实现绿色环保和废物利用。研究发现,Na2SO3溶液也可以用来处理废气中的SO2,发生反应Na2SO3+H2O+SO2=2NaHSO3。
查阅资料可知,常温下,部分弱酸的电离平衡常数如表:
①相同物质的量浓度的三种酸溶液HClO、H2CO3和H2SO3由水电离的c(H+)最大的是______ (填化学式)
②将浓度均为0.1 mol·L-1的NaHSO3和Na2SO3等体积混合,溶液pH=7.2,分析该溶液中c(HSO )
) _______ c(SO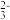 ) (填“>”,“>”或“=”)。
) (填“>”,“>”或“=”)。
③SO2也可用石灰乳吸收,得到的CaSO3浆料可用于制备NaHSO3溶液。写出用CaSO3浆料制备NaHSO3溶液实验方案:____ 。
已知:室温下,溶液中H2SO3、HSO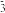 、SO
、SO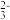 的物质的量分数随pH的分布如下图所示。
的物质的量分数随pH的分布如下图所示。
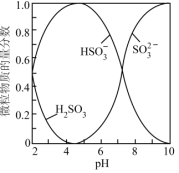
实验中可选用的试剂:
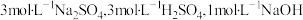
(1)实验室制取乙炔时,用硫酸铜溶液除去乙炔气体中混有的H2S气体,发生反应:H2S(aq)+Cu2+
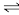 CuS(s)+2H+(aq),计算25℃时,该反应的平衡常数为
CuS(s)+2H+(aq),计算25℃时,该反应的平衡常数为(2)通过电化学循环法可将H2S转化为H2SO4和H2(如图所示)。其中氧化过程发生如下两步反应:
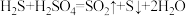 、
、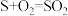 。
。
①电极a上发生反应的电极反应式为
②理论上1 mol H2S参加反应可产生H2的物质的量为
(3)硫酸工业的尾气中含SO2等污染性气体,通常用碱液如氨水进行吸收处理,实现绿色环保和废物利用。研究发现,Na2SO3溶液也可以用来处理废气中的SO2,发生反应Na2SO3+H2O+SO2=2NaHSO3。
查阅资料可知,常温下,部分弱酸的电离平衡常数如表:
| 弱酸 | HClO | H2CO3 | H2SO3 |
| 电离平衡常数(25℃) | Ka=4.0×10−8 | Ka1=4.3×10−7,Ka2=4.7×10−11 | Ka1=1.5×10−3,Ka2=6×10−8 |
①相同物质的量浓度的三种酸溶液HClO、H2CO3和H2SO3由水电离的c(H+)最大的是
②将浓度均为0.1 mol·L-1的NaHSO3和Na2SO3等体积混合,溶液pH=7.2,分析该溶液中c(HSO
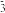 )
) 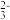 ) (填“>”,“>”或“=”)。
) (填“>”,“>”或“=”)。③SO2也可用石灰乳吸收,得到的CaSO3浆料可用于制备NaHSO3溶液。写出用CaSO3浆料制备NaHSO3溶液实验方案:
已知:室温下,溶液中H2SO3、HSO
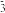 、SO
、SO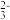 的物质的量分数随pH的分布如下图所示。
的物质的量分数随pH的分布如下图所示。
实验中可选用的试剂:
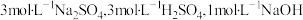
您最近一年使用:0次



