重晶石主要成分为BaSO4,含少量的SiO2、CaO和MgO杂质,以下是一种制取Ba(NO3)2的工业流程。
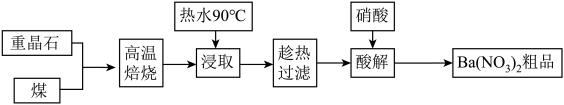
(1)上述流程中将重晶石和煤磨成粉状的目的是_______________________ 。
(2)焙烧过程中主反应为:BaSO4 + 4C BaS + 4CO,除此以外还可能有BaCO3等副产物生成,通过改变温度以及煤粉的用量可降低副反应发生。
BaS + 4CO,除此以外还可能有BaCO3等副产物生成,通过改变温度以及煤粉的用量可降低副反应发生。
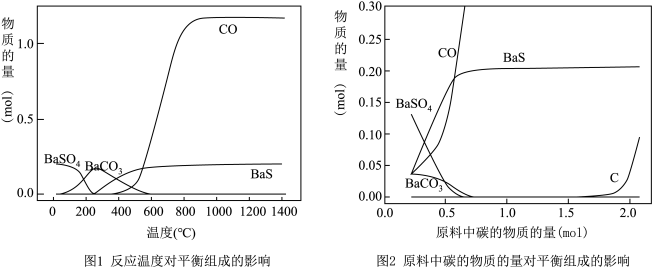
①依据如图判断生成BaS的反应是_______ 反应(填“放热”或“吸热”);反应温度至少应控制在____ 以上。
②控制BaSO4的量不变,改变C的量,测得原料中碳的物质的量对平衡组成的影响,如图所示,判断原料中n(C) / n(BaSO4)至少为________ (填字母):a. 1.5 、b. 2.0 、c.3.75。
(3)已知BaS的溶解度随温度的升高而明显增大,90℃时约为50g/100g水,浸取液中存在三种碱Mg(OH)2 、Ca(OH)2、Ba(OH)2。
①浸取过程中产生Ba(OH)2的原因是________________________ (写离子方程式)。
②三种碱的碱性由强到弱顺序为:_________ >_______ >________ (填化学式);结合元素周期律解释原因是:Mg、Ca、Ba处于同一主族,随着原子序数递增,________ 。
(4)酸解过程中,向滤液中加入硝酸,即有硝酸钡晶体析出,稍过量的HNO3有利于提高Ba(NO3)2晶体的析出率,用化学平衡原理分析其原因是:__________________________ 。

(1)上述流程中将重晶石和煤磨成粉状的目的是
(2)焙烧过程中主反应为:BaSO4 + 4C
 BaS + 4CO,除此以外还可能有BaCO3等副产物生成,通过改变温度以及煤粉的用量可降低副反应发生。
BaS + 4CO,除此以外还可能有BaCO3等副产物生成,通过改变温度以及煤粉的用量可降低副反应发生。
①依据如图判断生成BaS的反应是
②控制BaSO4的量不变,改变C的量,测得原料中碳的物质的量对平衡组成的影响,如图所示,判断原料中n(C) / n(BaSO4)至少为
(3)已知BaS的溶解度随温度的升高而明显增大,90℃时约为50g/100g水,浸取液中存在三种碱Mg(OH)2 、Ca(OH)2、Ba(OH)2。
①浸取过程中产生Ba(OH)2的原因是
②三种碱的碱性由强到弱顺序为:
(4)酸解过程中,向滤液中加入硝酸,即有硝酸钡晶体析出,稍过量的HNO3有利于提高Ba(NO3)2晶体的析出率,用化学平衡原理分析其原因是:
更新时间:2019-04-28 21:30:24
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】二甲醚(DME)被誉为“21世纪的清洁燃料”。合成气(主要成分为CO、CO2和H2)是重要的化工原料,可利用合成气在催化剂存在下直接制备二甲醚(CH3OCH3)。
已知:① CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.0kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.0kJ·mol-1
② CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.1 kJ·mol-1
CO(g)+H2O(g) △H2=+41.1 kJ·mol-1
③ 2CH3OH(g) CH3OCH3(g)+H2O(g) △H3=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H3=-24.5 kJ·mol-1
(1)工业上用CO2和H2在一定条件下反应直接制备二甲醚,主反应为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
①要使该反应速率和产率都增大,应该采取的措施是__________________________________ ;。
②一定条件下,上述主反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是__________ (填标号)。
a.逆反应速率先增大后减小 b.H2的转化率增大
c.反应物的体积百分含量减小 d.容器中的 变小
变小
③在某压强下,制备二甲醚的反应在不同温度、不同投料比时CO2的转化率如图(a)所示。T1温度下,将6molCO2和12molH2充入10L的密闭容器中, 5 min后反应达到平衡状态,则0〜5 min内的平均反应速率υ(CH3OCH3)=__________ ;KA、 KB、 KC三者之间的大小关系为___________ 。
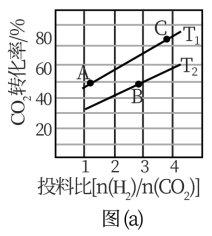

(2)在适当条件下由CO和H2直接制备二甲醚,另一产物为水蒸气。
①该反应的热化学方程式是_______________________________ 。
②CO的转化率、二甲醚的产率与反应温度的关系如图(b)所示,请解释290℃后升高温度,CH3OCH3产率逐渐走低的原因可能是________________________________ 。
已知:① CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.0kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.0kJ·mol-1② CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.1 kJ·mol-1
CO(g)+H2O(g) △H2=+41.1 kJ·mol-1③ 2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H3=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H3=-24.5 kJ·mol-1(1)工业上用CO2和H2在一定条件下反应直接制备二甲醚,主反应为:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)①要使该反应速率和产率都增大,应该采取的措施是
②一定条件下,上述主反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是
a.逆反应速率先增大后减小 b.H2的转化率增大
c.反应物的体积百分含量减小 d.容器中的
 变小
变小③在某压强下,制备二甲醚的反应在不同温度、不同投料比时CO2的转化率如图(a)所示。T1温度下,将6molCO2和12molH2充入10L的密闭容器中, 5 min后反应达到平衡状态,则0〜5 min内的平均反应速率υ(CH3OCH3)=


(2)在适当条件下由CO和H2直接制备二甲醚,另一产物为水蒸气。
①该反应的热化学方程式是
②CO的转化率、二甲醚的产率与反应温度的关系如图(b)所示,请解释290℃后升高温度,CH3OCH3产率逐渐走低的原因可能是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】低碳烯烃(乙烯、丙烯、丁烯等)作为重要的基本化工原料,在现代石油和化学工业中具有举足轻重的作用.
Ⅰ.小分子烃类(如丙烯)作为还原剂可以在催化剂上选择性还原 .
.
已知: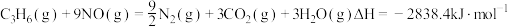
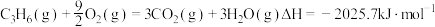
(1)反应
__________ kJ⋅mol−1。
Ⅱ.二氧化碳可将乙烷转化为更有工业价值的乙烯.相同反应时间,不同温度、不同催化剂的条件下测得的数据如表1(均未达到平衡状态):
(2)已知 选择性:转化的乙烷中生成乙烯的百分比.选择铬盐作催化剂时的最佳温度为
选择性:转化的乙烷中生成乙烯的百分比.选择铬盐作催化剂时的最佳温度为______________ .
Ⅲ.一定条件下,碘甲烷 热裂解制低碳烯烃的主要反应有:
热裂解制低碳烯烃的主要反应有:
反应ⅰ: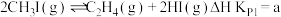
反应ⅱ: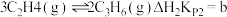
反应ⅲ: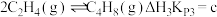
反应ⅰ、ⅱ、ⅲ在不同温度下的分压平衡常数 如表2,回答下列问题:
如表2,回答下列问题:
(3)根据表中数据推出反应ⅰ的活化能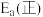
______________ (填“>”或“<”)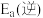 .
.
(4)实际工业生产中,若存在副反应: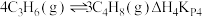 ,结合表数据分析
,结合表数据分析
______________ (填“>”或“<”)0,陈述理由:______________ .
(5)其他条件不变,起始压强为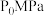 ,向容积为
,向容积为 的恒容密闭容器中投入
的恒容密闭容器中投入 ,只发生反应ⅰ、ⅱ、ⅲ,反应温度对平衡体系中乙烯、丙烯和丁烯所占气体组分物质的量分数的影响如图.
,只发生反应ⅰ、ⅱ、ⅲ,反应温度对平衡体系中乙烯、丙烯和丁烯所占气体组分物质的量分数的影响如图.

 条件下,平衡时,体系中
条件下,平衡时,体系中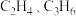 、
、 的质量比为
的质量比为______________ ,反应ⅰ的压强平衡常数
______________  .
.
Ⅰ.小分子烃类(如丙烯)作为还原剂可以在催化剂上选择性还原
 .
.已知:
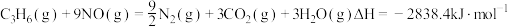
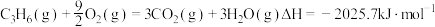
(1)反应

Ⅱ.二氧化碳可将乙烷转化为更有工业价值的乙烯.相同反应时间,不同温度、不同催化剂的条件下测得的数据如表1(均未达到平衡状态):
| 实验编号 | ① | ② | ③ | ④ |
反应温度 | 650 | 650 | 600 | 550 |
| 催化剂 | 钴盐 | 铬盐 | ||
 的转化率 的转化率 | 19.0 | 32.1 | 21.2 | 12.0 |
 的选择性 的选择性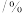 | 17.6 | 77.3 | 79.7 | 85.2 |
(2)已知
 选择性:转化的乙烷中生成乙烯的百分比.选择铬盐作催化剂时的最佳温度为
选择性:转化的乙烷中生成乙烯的百分比.选择铬盐作催化剂时的最佳温度为Ⅲ.一定条件下,碘甲烷
 热裂解制低碳烯烃的主要反应有:
热裂解制低碳烯烃的主要反应有:反应ⅰ:
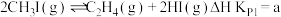
反应ⅱ:
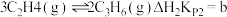
反应ⅲ:
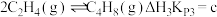
反应ⅰ、ⅱ、ⅲ在不同温度下的分压平衡常数
 如表2,回答下列问题:
如表2,回答下列问题: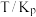 |  |  |  |  |  |  |
| 反应ⅰ | 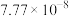 | 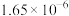 | 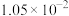 | 2.80 |  | 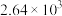 |
| 反应ⅱ | 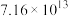 | 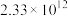 | 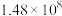 | 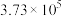 | 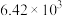 | 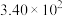 |
| 反应ⅲ | 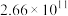 |  | 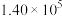 |  | 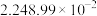 |
(3)根据表中数据推出反应ⅰ的活化能
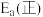
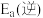 .
.(4)实际工业生产中,若存在副反应:
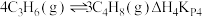 ,结合表数据分析
,结合表数据分析
(5)其他条件不变,起始压强为
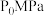 ,向容积为
,向容积为 的恒容密闭容器中投入
的恒容密闭容器中投入 ,只发生反应ⅰ、ⅱ、ⅲ,反应温度对平衡体系中乙烯、丙烯和丁烯所占气体组分物质的量分数的影响如图.
,只发生反应ⅰ、ⅱ、ⅲ,反应温度对平衡体系中乙烯、丙烯和丁烯所占气体组分物质的量分数的影响如图.
 条件下,平衡时,体系中
条件下,平衡时,体系中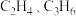 、
、 的质量比为
的质量比为
 .
.
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】天然气开采产生的废气普遍含有硫化氢,需要回收处理并加以利用。回答下列问题:
(1)已知下列反应的热化学方程式:
①
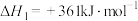 ;
;
②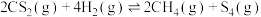
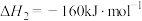 。
。
则反应③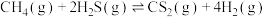 的
的
___________  ;下列叙述能说明反应③达到平衡状态的有
;下列叙述能说明反应③达到平衡状态的有___________ (填标号)。
A.断裂 的同时生成
的同时生成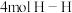
B.恒容条件下,体系压强不再变化
C.恒压条件下,气体的密度不再变化
D.容器内 、
、 、
、 、
、 的物质的量之比为
的物质的量之比为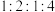
(2)反应②在___________ (填“高温”或“低温”)能自发进行。
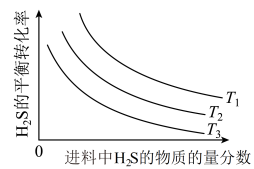
(3)反应①在不同温度、压强均为 、进料中
、进料中 的物质的量分数为0.1%~20%(其余为Ar)的条件下,
的物质的量分数为0.1%~20%(其余为Ar)的条件下, 的平衡转化率如图所示。
的平衡转化率如图所示。 、
、 和
和 的大小关系为
的大小关系为___________ ;进料中 的物质的量分数越大,
的物质的量分数越大, 的平衡转化率越小的原因是
的平衡转化率越小的原因是___________ 。
(4)在 、
、 条件下,向体积为VL的密闭容器中通入
条件下,向体积为VL的密闭容器中通入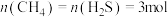 ,
,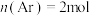 的混合气发生反应③,当达到平衡时,
的混合气发生反应③,当达到平衡时, 的分压与
的分压与 的分压相同,则反应③达到平衡时容器体积为开始体积的
的分压相同,则反应③达到平衡时容器体积为开始体积的___________ 倍。
(1)已知下列反应的热化学方程式:
①

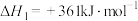 ;
;②
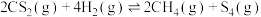
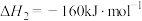 。
。则反应③
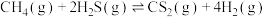 的
的
 ;下列叙述能说明反应③达到平衡状态的有
;下列叙述能说明反应③达到平衡状态的有A.断裂
 的同时生成
的同时生成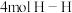
B.恒容条件下,体系压强不再变化
C.恒压条件下,气体的密度不再变化
D.容器内
 、
、 、
、 、
、 的物质的量之比为
的物质的量之比为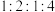
(2)反应②在
(3)反应①在不同温度、压强均为
 、进料中
、进料中 的物质的量分数为0.1%~20%(其余为Ar)的条件下,
的物质的量分数为0.1%~20%(其余为Ar)的条件下, 的平衡转化率如图所示。
的平衡转化率如图所示。 、
、 和
和 的大小关系为
的大小关系为 的物质的量分数越大,
的物质的量分数越大, 的平衡转化率越小的原因是
的平衡转化率越小的原因是
(4)在
 、
、 条件下,向体积为VL的密闭容器中通入
条件下,向体积为VL的密闭容器中通入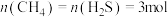 ,
,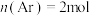 的混合气发生反应③,当达到平衡时,
的混合气发生反应③,当达到平衡时, 的分压与
的分压与 的分压相同,则反应③达到平衡时容器体积为开始体积的
的分压相同,则反应③达到平衡时容器体积为开始体积的
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】自然界中化合态硫主要以FeS2(黄铁矿)、CuFeS2(黄铜矿)等矿物形式存在。用黄铜矿炼铜的总反应为: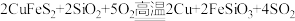 。
。
(1)该反应中_______ 元素被还原,如果在反应中生成1molCu,转移电子数为____ (用NA表示阿伏加德罗常数)。
(2)上述产生的SO2是一种大气污染物,不能直接排放到大气中,目前工业上常用的处理方法有多种。
I、用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4
①写出上述转化中生成NH4HSO3的化学方程式_______ (用一个方程式表示)若想提高该过程中SO2的除去速率,可采取的措施为_______ (填序号)
②25℃时0.lmol·L—1 (NH4)2SO4溶液的pH=5,其原因是_______ (用离子方程式表示),若水解常数用Kb表示,则该溶液中铵根离子的水解常数Kb约为______________ .
Ⅱ、“钠碱法”:用NaOH溶液作吸收剂吸收SO2
③当n(NaOH)∶n(SO2)=_______ 时,吸收SO2的成本最低,所得吸收液中各离子浓度大小关系是_______ ,向吸收液中加入NaOH可得到_______ 。
A. 增大氨水浓度
B. 升高反应温度
C. 使气体与氨水充分接触
D. 通入空气使HSO 转化为SO
转化为SO
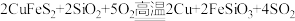 。
。(1)该反应中
(2)上述产生的SO2是一种大气污染物,不能直接排放到大气中,目前工业上常用的处理方法有多种。
I、用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4
①写出上述转化中生成NH4HSO3的化学方程式
②25℃时0.lmol·L—1 (NH4)2SO4溶液的pH=5,其原因是
Ⅱ、“钠碱法”:用NaOH溶液作吸收剂吸收SO2
③当n(NaOH)∶n(SO2)=
A. 增大氨水浓度
B. 升高反应温度
C. 使气体与氨水充分接触
D. 通入空气使HSO
 转化为SO
转化为SO
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】近年来,长江流域总磷超标的问题逐渐凸显,“三磷”(磷矿、磷肥和含磷农药制造等磷化工企业、磷石膏库)导致的区域环境污染问题日益受到关注。 、
、 和
和 是磷的三种含氧酸,请回答下列问题:
是磷的三种含氧酸,请回答下列问题:
(1)次磷酸不能与高铁酸钾混合使用,原因是二者会发生如下反应,请配平该反应_______ 。

(2)某含磷废水的主要成分为 和
和 ,向废水中加入适量漂白粉,再加入生石灰调节
,向废水中加入适量漂白粉,再加入生石灰调节 ,将磷元素转化为磷酸钙沉淀回收。加入漂白粉的作用是
,将磷元素转化为磷酸钙沉淀回收。加入漂白粉的作用是_______ ;若测得处理后的废水中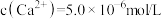 ,
, 的含量为
的含量为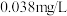 ,则
,则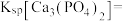
_______ 。
(3)25℃时,向一定体积的亚磷酸( ,二元弱酸)溶液中滴加等物质的量浓度的
,二元弱酸)溶液中滴加等物质的量浓度的 溶液,混合液中含磷粒子的物质的量分数(δ)与溶液
溶液,混合液中含磷粒子的物质的量分数(δ)与溶液 的关系如图所示。
的关系如图所示。
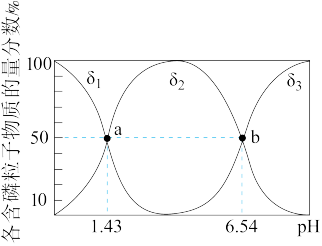
① 为
为_______ (填“正盐”或“酸式盐”),其溶液显碱性的离子方程式为_______ 。
② 点时,溶液中水电离出的
点时,溶液中水电离出的
_______ 。
③所加 溶液体积与亚磷酸溶液相同时,溶液中各离子的物质的量浓度由大到小的顺序为
溶液体积与亚磷酸溶液相同时,溶液中各离子的物质的量浓度由大到小的顺序为_______ 。
④将浓度均为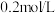 的
的 和
和 的混合液加水稀释10倍后,溶液中
的混合液加水稀释10倍后,溶液中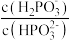 将
将_______ (填“增大”、“减小”或“不变”)。
 、
、 和
和 是磷的三种含氧酸,请回答下列问题:
是磷的三种含氧酸,请回答下列问题:(1)次磷酸不能与高铁酸钾混合使用,原因是二者会发生如下反应,请配平该反应

(2)某含磷废水的主要成分为
 和
和 ,向废水中加入适量漂白粉,再加入生石灰调节
,向废水中加入适量漂白粉,再加入生石灰调节 ,将磷元素转化为磷酸钙沉淀回收。加入漂白粉的作用是
,将磷元素转化为磷酸钙沉淀回收。加入漂白粉的作用是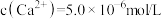 ,
, 的含量为
的含量为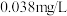 ,则
,则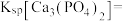
(3)25℃时,向一定体积的亚磷酸(
 ,二元弱酸)溶液中滴加等物质的量浓度的
,二元弱酸)溶液中滴加等物质的量浓度的 溶液,混合液中含磷粒子的物质的量分数(δ)与溶液
溶液,混合液中含磷粒子的物质的量分数(δ)与溶液 的关系如图所示。
的关系如图所示。
①
 为
为②
 点时,溶液中水电离出的
点时,溶液中水电离出的
③所加
 溶液体积与亚磷酸溶液相同时,溶液中各离子的物质的量浓度由大到小的顺序为
溶液体积与亚磷酸溶液相同时,溶液中各离子的物质的量浓度由大到小的顺序为④将浓度均为
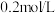 的
的 和
和 的混合液加水稀释10倍后,溶液中
的混合液加水稀释10倍后,溶液中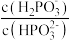 将
将
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】以镁铝复合氧化物(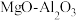 )为载体的负载型镍铜双金属催化剂(
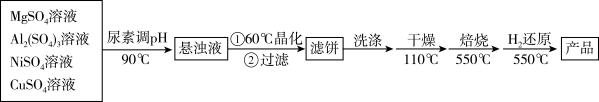
)为载体的负载型镍铜双金属催化剂(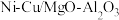 )是一种新型的高效加氢或脱氢催化剂,其制备流程如图:
)是一种新型的高效加氢或脱氢催化剂,其制备流程如图:
已知:常温下, 。
。
回答下列问题:
(1)在元素周期表中, 在
在_______ (填“s”“p”“d“f”或“ds”)区。
(2)在加热条件下,尿素( )在水中发生水解反应,放出
)在水中发生水解反应,放出 和
和 两种气体。
两种气体。
①尿素中C原子的杂化轨道类型为_______ ;尿素分子中 键与
键与 键的数目之比为
键的数目之比为_______ 。
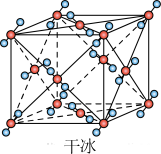
②如图为干冰的晶胞结构示意图,一个二氧化碳晶胞中含有_______ 个二氧化碳分子。
(3)“晶化”过程中,需保持恒温 ,可采用的加热方式为
,可采用的加热方式为_______ 。
(4)常温下,若“悬浊液”中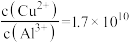 ,则溶液的
,则溶液的
_______ 。
(5)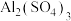 在消防工业中常用于与小苏打、发泡剂组成泡沫灭火剂,请写出其灭火原理:
在消防工业中常用于与小苏打、发泡剂组成泡沫灭火剂,请写出其灭火原理:_______ (用离子方程式表示)。
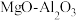 )为载体的负载型镍铜双金属催化剂(
)为载体的负载型镍铜双金属催化剂(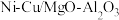 )是一种新型的高效加氢或脱氢催化剂,其制备流程如图:
)是一种新型的高效加氢或脱氢催化剂,其制备流程如图:
已知:常温下,
 。
。回答下列问题:
(1)在元素周期表中,
 在
在(2)在加热条件下,尿素(
 )在水中发生水解反应,放出
)在水中发生水解反应,放出 和
和 两种气体。
两种气体。①尿素中C原子的杂化轨道类型为
 键与
键与 键的数目之比为
键的数目之比为②如图为干冰的晶胞结构示意图,一个二氧化碳晶胞中含有

(3)“晶化”过程中,需保持恒温
 ,可采用的加热方式为
,可采用的加热方式为(4)常温下,若“悬浊液”中
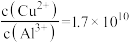 ,则溶液的
,则溶液的
(5)
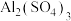 在消防工业中常用于与小苏打、发泡剂组成泡沫灭火剂,请写出其灭火原理:
在消防工业中常用于与小苏打、发泡剂组成泡沫灭火剂,请写出其灭火原理:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】铝在我国储量居世界前列,被广泛应用于钢铁、石油、化工、电气和电子技术、医药和农业等领域。钼酸钠晶体( )是一种金属腐蚀抑制剂。下图是利用钼精矿(主要成分是
)是一种金属腐蚀抑制剂。下图是利用钼精矿(主要成分是 ,含少量
,含少量 等)为原料生产钼酸钠晶体的工艺流程图。
等)为原料生产钼酸钠晶体的工艺流程图。
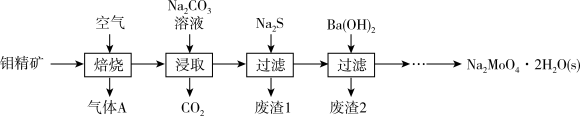
请回答下列问题:
(1)气体A的主要成分是_______ (填化学式),为了提高浸取率所采取的措施是_______ (写一条即可)。
(2)在焙烧炉中焙烧时,采用多层逆流(空气从炉底进入,钼精矿经粉碎后从炉顶进入)焙烧,采用“多层逆流”的目的是_______ 。
(3)“焙烧”时 转化为
转化为 ,浸取过程中含钼化合物发生反应的离子方程式为
,浸取过程中含钼化合物发生反应的离子方程式为_______ 。
(4)在加入 除
除 时,若溶液
时,若溶液 较小,会产生的不良后果是
较小,会产生的不良后果是_______ ,原因是_______ (用平衡移动原理解释)。
(5)流程中“…”在实验室的操作为_______ 、_______ 、过滤、洗涤、干燥。
(6)分析化学上测定钼的含量,通常是把 经过一系列变化得
经过一系列变化得 的方法来测定。实验室称量
的方法来测定。实验室称量 钼精矿,经过一系列变化得到
钼精矿,经过一系列变化得到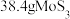 ,则理论上钼精矿中钼的百分含量为
,则理论上钼精矿中钼的百分含量为_______  。
。
 )是一种金属腐蚀抑制剂。下图是利用钼精矿(主要成分是
)是一种金属腐蚀抑制剂。下图是利用钼精矿(主要成分是 ,含少量
,含少量 等)为原料生产钼酸钠晶体的工艺流程图。
等)为原料生产钼酸钠晶体的工艺流程图。
请回答下列问题:
(1)气体A的主要成分是
(2)在焙烧炉中焙烧时,采用多层逆流(空气从炉底进入,钼精矿经粉碎后从炉顶进入)焙烧,采用“多层逆流”的目的是
(3)“焙烧”时
 转化为
转化为 ,浸取过程中含钼化合物发生反应的离子方程式为
,浸取过程中含钼化合物发生反应的离子方程式为(4)在加入
 除
除 时,若溶液
时,若溶液 较小,会产生的不良后果是
较小,会产生的不良后果是(5)流程中“…”在实验室的操作为
(6)分析化学上测定钼的含量,通常是把
 经过一系列变化得
经过一系列变化得 的方法来测定。实验室称量
的方法来测定。实验室称量 钼精矿,经过一系列变化得到
钼精矿,经过一系列变化得到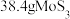 ,则理论上钼精矿中钼的百分含量为
,则理论上钼精矿中钼的百分含量为 。
。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】某科研人员以废镍催化剂(主要成分为 ,另含
,另含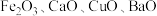 )为原料回收镍,工艺流程如图。
)为原料回收镍,工艺流程如图。
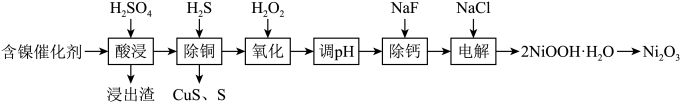
已知:常温下,有关氢氧化物开始沉淀和沉淀完全的 如表。
如表。
回答下列问题:
(1)浸出渣主要成分为_______ 、______ (填化学式) ,酸浸时除去不溶性杂质的操作名称是______ 。
(2)“除铜”时, 与
与 反应的离子方程式为
反应的离子方程式为_______ 。
(3)加入H2O2的目的是将溶液中 氧化为
氧化为 ,温度需控制在
,温度需控制在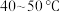 之间,在“氧化”时温度不能太高的原因是
之间,在“氧化”时温度不能太高的原因是______ 。
(4)“调 ” 是为了除去
” 是为了除去 ,操作时需控制pH值的范围为
,操作时需控制pH值的范围为____ ,此时试剂可以选择____ (填字母序号)。
A.Ni(OH)2 B.Na2O C.氨水 D.NiCO3
(5)“除钙”后,若溶液中 浓度为
浓度为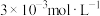 ,c(Ca2+)=
,c(Ca2+)=____ mol·L-1。[常温时Ksp(CaF2)=2.7×10-11]
 ,另含
,另含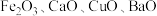 )为原料回收镍,工艺流程如图。
)为原料回收镍,工艺流程如图。
已知:常温下,有关氢氧化物开始沉淀和沉淀完全的
 如表。
如表。| 氢氧化物 |  |  |  |
开始沉淀的 | 1.5 | 6.5 | 8.2 |
沉淀完全的 | 3.7 | 9.7 | 9.2 |
(1)浸出渣主要成分为
(2)“除铜”时,
 与
与 反应的离子方程式为
反应的离子方程式为(3)加入H2O2的目的是将溶液中
 氧化为
氧化为 ,温度需控制在
,温度需控制在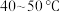 之间,在“氧化”时温度不能太高的原因是
之间,在“氧化”时温度不能太高的原因是(4)“调
 ” 是为了除去
” 是为了除去 ,操作时需控制pH值的范围为
,操作时需控制pH值的范围为A.Ni(OH)2 B.Na2O C.氨水 D.NiCO3
(5)“除钙”后,若溶液中
 浓度为
浓度为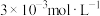 ,c(Ca2+)=
,c(Ca2+)=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】氯化亚铜(CuCl)是一种难溶于水和乙醇、在潮湿的空气中易水解氧化白色粉末,广泛应用于印染等行业。工业上用铜矿粉(主要含Cu2S及少量Al2O3和SiO2)为原料制备CuCl,其流程如下图。已知:常温下, 的
的 约为
约为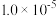 。
。

(1)“浸取”时,发生反应为: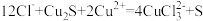 ,该反应分为两步进行:第一步为
,该反应分为两步进行:第一步为 ;第二步为
;第二步为___________ ;其中,滤渣的成分为___________ (填化学式)。
(2)除杂时,在常温下加入氨水,并控制混合溶液pH=4.0;此时,该溶液中
________ 。
(3)加水“稀释”时发生反应的相关离子反应方程式为___________ ; 若“稀释”时加水不足,会导致CuCl的产率___________ (选填“偏低”、“偏高”或“不变”);从溶液中过滤得到CuCl固体后需要用乙醇洗涤,其目的是___________ 。
(4)CuCl纯度的测定。在锥形瓶中,将ag CuCl样品溶解于H2O2和H2SO4的混合 溶液,得到CuSO4溶液;加热溶液,待没有气体逸出后,再加入过量KI溶液,充分反应;向所得溶液中滴加2滴淀粉溶液,用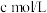 的
的 标准溶液滴定至终点,平均消耗
标准溶液滴定至终点,平均消耗 溶液V mL。已知:
溶液V mL。已知: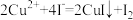 、
、 。
。
①“加热溶液,待没有气体逸出”的目的是___________ 。
②滴定终点的判断依据是___________ 。
 的
的 约为
约为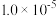 。
。
(1)“浸取”时,发生反应为:
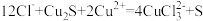 ,该反应分为两步进行:第一步为
,该反应分为两步进行:第一步为 ;第二步为
;第二步为(2)除杂时,在常温下加入氨水,并控制混合溶液pH=4.0;此时,该溶液中

(3)加水“稀释”时发生反应的相关离子反应方程式为
(4)CuCl纯度的测定。在锥形瓶中,将ag CuCl样品溶解于H2O2和H2SO4的混合 溶液,得到CuSO4溶液;加热溶液,待没有气体逸出后,再加入过量KI溶液,充分反应;向所得溶液中滴加2滴淀粉溶液,用
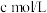 的
的 标准溶液滴定至终点,平均消耗
标准溶液滴定至终点,平均消耗 溶液V mL。已知:
溶液V mL。已知: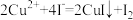 、
、 。
。①“加热溶液,待没有气体逸出”的目的是
②滴定终点的判断依据是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表是元素周期表的一部分。
请回答下列问题。
(1)非金属性最强的元素名称为___________ ,它位于元素周期表中的位置___________ 。
(2)硅元素的原子结构示意图是____________ ,其最高价氧化物是____________ (填“酸性”或“碱性”)氧化物。
(3)硼酸(H3BO3)的酸性_________ (填“>” 或“<”)碳酸(H2CO3)的酸性,说明你判断的理由:__________________________ 。
(4)NH3的电子式为________________ ,它属于____________ (填“离子”或“共价”)化合物。NH3的还原性_________ (填“>” 或“<”)PH3的还原性。
(5)第三周期元素的最高价氧化物对应的水化物中,有一种物质既能与强酸反应又能与强碱反应,写出这种物质跟氢氧化钠溶液反应的化学方程式______________ 。
| H | He | ||||||
| Li | Be | B | C | N | O | F | Ne |
| Na | Mg | Al | Si | P | S | Cl | Ar |
(1)非金属性最强的元素名称为
(2)硅元素的原子结构示意图是
(3)硼酸(H3BO3)的酸性
(4)NH3的电子式为
(5)第三周期元素的最高价氧化物对应的水化物中,有一种物质既能与强酸反应又能与强碱反应,写出这种物质跟氢氧化钠溶液反应的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】锌是一种常用金属,冶炼方法有火法和湿法。
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。氮化镓(GaN)是制造LED的重要材料,被誉为第三代半导体材料。
(1)Ga的原子结构示意图为____________________ 。
(2)GaN可由Ga和NH3在高温条件下合成,该反应的化学方程式为______________
(3)下列有关镓和镓的化合物的说法正确的是____________________ (填字母序号)。
A.一定条件下,Ga可溶于盐酸和氢氧化钠
B.常温下,Ga可与水剧烈反应放出氢气
C.Ga2O3可由Ga(OH)3受热分解得到
D.一定条件下,Ga2O3可与NaOH反应生成盐
II.工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示,回答下列问题:
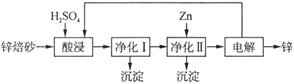
已知:Fe的活泼性强于Ni
(4)ZnFe2O4可以写成ZnO·Fe2O3,写出ZnFe2O4与H2SO4反应的化学方程式_______________________ 。
(5)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,只使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是_____________________________________________________ 。
(6)净化II中加入Zn的目的是______________________________________________ 。
(7)常温下,净化I中,如果要使c(Fe3+) < 10-5 mol/L,则应控制溶液pH的范围为_______________________ 。已知:Ksp[Fe(OH)3] =" 8.0" × 10-38;lg5 = 0.7
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。氮化镓(GaN)是制造LED的重要材料,被誉为第三代半导体材料。
(1)Ga的原子结构示意图为
(2)GaN可由Ga和NH3在高温条件下合成,该反应的化学方程式为
(3)下列有关镓和镓的化合物的说法正确的是
A.一定条件下,Ga可溶于盐酸和氢氧化钠
B.常温下,Ga可与水剧烈反应放出氢气
C.Ga2O3可由Ga(OH)3受热分解得到
D.一定条件下,Ga2O3可与NaOH反应生成盐
II.工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示,回答下列问题:

已知:Fe的活泼性强于Ni
(4)ZnFe2O4可以写成ZnO·Fe2O3,写出ZnFe2O4与H2SO4反应的化学方程式
(5)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,只使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是
(6)净化II中加入Zn的目的是
(7)常温下,净化I中,如果要使c(Fe3+) < 10-5 mol/L,则应控制溶液pH的范围为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】A、B、C、D、E、F、G、H是八种原子序数依次增大的短周期主族元素。常温下,A、C、D、H的常见单质均为气体且仅有H的单质为有色气体。A和B的原子序数之和等于C,A、E同主族,D、G同主族,F的最外层电子数等于其电子层数。请回答下列问题:
(1)F的原子结构示意图为_______ 。
(2)化合物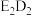 中所包含的化学键类型为
中所包含的化学键类型为_______ 。
(3)写出E的单质与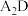 反应的化学方程式:
反应的化学方程式:_______ 。
(4)用电子式表示化合物EH的形成过程:_______ 。
(5)B、C、D三种元素形成的最简单氢化物的稳定性由强到弱的顺序是_______ (用化学式表示)。
(6)H的单质通入淀粉-KI溶液中,溶液变蓝,写出该反应的离子方程式:_______ ,该实验说明H的非金属性强于碘,请从原子结构的角度解释其原因:_______ 。
(1)F的原子结构示意图为
(2)化合物
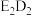 中所包含的化学键类型为
中所包含的化学键类型为(3)写出E的单质与
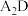 反应的化学方程式:
反应的化学方程式:(4)用电子式表示化合物EH的形成过程:
(5)B、C、D三种元素形成的最简单氢化物的稳定性由强到弱的顺序是
(6)H的单质通入淀粉-KI溶液中,溶液变蓝,写出该反应的离子方程式:
您最近一年使用:0次



