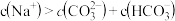25 ℃时,将1.0 L w mol·L-1的CH3COOH溶液与0.1 mol的NaOH固体混合,充分反应后向混合液中通(加)入HCl气体或NaOH固体。溶液pH随通(加)入HCl或NaOH的物质的量的变化如下图。下列叙述正确的是 ( )
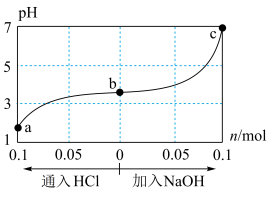

| A.a、b、c对应的混合液中,水的电离程度由大到小的顺序是a>b>c |
B.若忽略体积变化,则25 ℃时,CH3COOH的电离平衡常数K=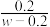 ×10-7 mol·L-1 ×10-7 mol·L-1 |
C.加入NaOH过程中,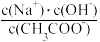 逐渐减小 逐渐减小 |
| D.加入NaOH过程中,c(Na+)·c(CH3COO-)逐渐减小 |
更新时间:2019-08-13 20:37:42
|
相似题推荐
单选题
|
较难
(0.4)
【推荐1】能够抵抗外加少量强酸、强碱或水稀释,而保持pH基本不变的溶液称为缓冲溶液。某化学学习小组配制不同浓度的NH4Cl-NH3缓冲溶液,探究c(NH4Cl)/c(NH3)对缓冲溶液抗酸和抗碱的影响。
实验1:配制缓冲溶液
该小组先配制0.1mol·L-1NH4Cl溶液和0.1mol·L-1氨水,再将NH4Cl溶液和氨水按照1:4、1:1和4:1的比例混合后,分别配制成15mL缓冲溶液①、②、③,测得pH分别为10.6、10.1和9.6。
实验2:探究c(NH4Cl)/c(NH3)对缓冲溶液抗酸、抗碱能力的影响
分别向滴定管中加入0.1mol·L-1盐酸和0.1mol·L-1NaOH溶液,逐滴滴入缓冲溶液①②③和等量蒸馏水中,测得pH与滴入的盐酸、NaOH溶液体积的关系如图所示。

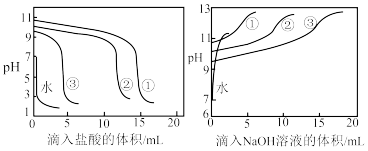
对于实验2,下列说法错误的是
实验1:配制缓冲溶液
该小组先配制0.1mol·L-1NH4Cl溶液和0.1mol·L-1氨水,再将NH4Cl溶液和氨水按照1:4、1:1和4:1的比例混合后,分别配制成15mL缓冲溶液①、②、③,测得pH分别为10.6、10.1和9.6。
实验2:探究c(NH4Cl)/c(NH3)对缓冲溶液抗酸、抗碱能力的影响
分别向滴定管中加入0.1mol·L-1盐酸和0.1mol·L-1NaOH溶液,逐滴滴入缓冲溶液①②③和等量蒸馏水中,测得pH与滴入的盐酸、NaOH溶液体积的关系如图所示。


对于实验2,下列说法错误的是
| A.c(NH4Cl)/c(NH3)=4:1时,缓冲溶液抗碱能力最强 |
| B.c(NH4Cl)/c(NH3)不变时,c(NH4Cl)+c(NH3)越大,抗酸抗碱能力越强 |
| C.缓冲溶液抗酸、抗碱最佳比例为c(NH4Cl)/c(NH3)=1:1 |
| D.向上述缓冲溶液中加入少量盐酸或NaOH溶液时,水的电离程度均增加 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】向含1molNaClO的稀溶液中通入1molCO2,充分反应后,生成1molHClO和1molNaHCO3,经检测,所得溶液呈酸性。下列有关说法中不正确 的是
| A.上述所得溶液中:c(HClO)>c(HCO3-)>c(CO32-) |
| B.上述反应的离子方程式为:ClO- + CO2 +H2O=HClO+ HCO3- |
| C.上述所得溶液中:c(ClO-)+c(HClO)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| D.上述所得溶液中:c(Na+)<c(HCO3-)+2c(CO32-)+c(ClO-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐3】已知:pOH=-lgc(OH-)。室温下,将稀盐酸滴加到某一元碱(BOH)溶液中,测得混合溶液的pOH 与微粒浓度的变化关系如图所示。 下列说法错误的是( )
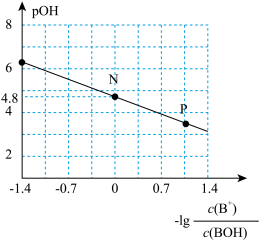

| A.若向0.1mol/L BOH溶液中加水稀释,则溶液中c(OH-)/c(BOH) 增大 |
| B.室温下,BOH的电离平衡常数K = 1×10-4.8 |
| C.P点所示的溶液中:c(Cl-) > c(B+) |
| D.N点所示的溶液中: c(H+) = c(Cl-) + c(OH-) - c(BOH) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】常温下,向100 mL 0.1 mol·L-1 HA溶液中逐滴加入0.2 mol·L-1 MOH溶液,所得溶液的pH变化曲线如图所示。下列有关说法正确的是 ( )


A.HA的电离方程式:HA H++A- H++A- |
| B.N点、K点水的电离程度:N<K |
| C.N点溶液中:c(A-)=c(M+)=c(H+)=c(OH-) |
| D.K点溶液中:c(OH-)+c(MOH)+c(A-)-c(H+)=0.1 mol·L-1 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】常温下,用 NaOH溶液滴定NH4HSO4溶液 ,混合溶液的相对导电能力变化曲线如图所示,已知: Kb(NH3• H2O) =10-5,下列叙述正确的是


A.X→Y 过程中发生反应的离子方程式为: +OH-= NH3• H2O +OH-= NH3• H2O |
B.Y点满足:c( ) +c(Na+) =2c( ) +c(Na+) =2c( ) ) |
| C.水的电离程度:X>Y>Z |
| D.若Z点溶液pH=1l,则此时溶液中氨水浓度约为0.1 mol•L-1 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】下列电解质溶液中微粒的物质的量浓度关系一定正确的是
A. 的 的 溶液(已知显酸性): 溶液(已知显酸性): |
B.等物质的量浓度的 和 和 混合溶液中: 混合溶液中: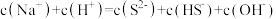 |
C.同一条件下, 相同的 相同的 溶液、 溶液、 溶液、 溶液、 溶液、 溶液、 溶液(相关酸的电离平衡常数参见第9题数据): 溶液(相关酸的电离平衡常数参见第9题数据):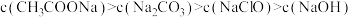 |
D.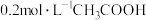 溶液和 溶液和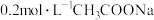 溶液等体积混合: 溶液等体积混合: |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】25℃时H2A的Ka1=4.3×10-7,Ka2=5.6×10-11,HB的Ka=3×10-8。下列说法正确的是
| A.加水稀释H2A溶液,水电离出的c(H+)•c(OH-)保持不变 |
| B.相同物质的量浓度的NaHA溶液和NaB溶液等体积混合后,溶液中c(HA-)<c(B-) |
| C.Na2A溶液中加H2A至中性,溶液中c(HA-)>c(H2A)>c(A2-) |
| D.将两份相同体积和物质的量浓度的NaOH溶液分别加到1L0.1mol·L-1H2A溶液和1L0.2mol·L-1HB溶液中,前者pH一定更小 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。用0.1 mol·L-1NaOH溶液滴定20mL 0.1mol·L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH)。下列说法正确的是
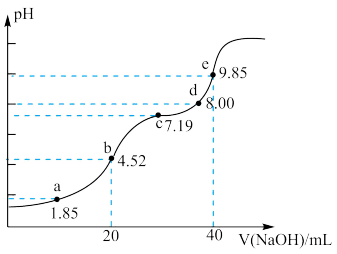

| A.b点所得溶液中:c(H+)+c(SO32-)=c(OH-)+c(H2SO3) |
| B.a点所得溶液中:2c(HSO3-)+c(SO32-)=0.1mol·L-1 |
| C.e点所得溶液中:c(Na+)> c(SO32-)> c(H+)> c(OH-) |
| D.c点所得溶液中:c(Na+)>3c(HSO3-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】常温下,用0.1000 mol·L-1 HCl溶液滴定20.00 mL 0.100 0 mol·L-1 NH3·H2O溶液,滴定曲线如下图。下列说法不正确的是
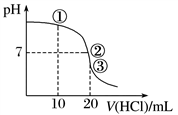

A.①溶液:c(NH3·H2O)+ c(NH )=2c(Cl-) )=2c(Cl-) |
B.①溶液:c(NH )+2c(H+)=2c(OH-)+c(NH3·H2O) )+2c(H+)=2c(OH-)+c(NH3·H2O) |
C.②溶液:c(NH )=c(Cl-)>c(OH-)=c(H+) )=c(Cl-)>c(OH-)=c(H+) |
D.③溶液:c(NH ) > c(Cl-) > c(H+) > c(OH-) ) > c(Cl-) > c(H+) > c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】常温下,向0.01 mol∙L-1的一元酸HX溶液中通入氨气,此过程混合溶液中 与pH之间关系如图所示(忽略溶液的体积变化)。下列叙述正确的是
与pH之间关系如图所示(忽略溶液的体积变化)。下列叙述正确的是

 与pH之间关系如图所示(忽略溶液的体积变化)。下列叙述正确的是
与pH之间关系如图所示(忽略溶液的体积变化)。下列叙述正确的是
A.pH=7时,溶液中c( )= )=  mol∙L-1 mol∙L-1 |
| B.常温下,K(HX)≈1×10- 5 |
| C.当溶液为碱性时,c(X- )<c(HX) |
D.混合溶液中不可能在:c(X-)>c( )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
您最近一年使用:0次

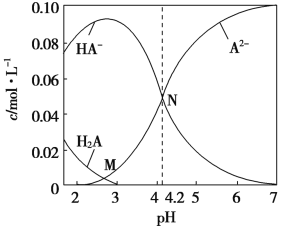

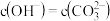
 时,
时,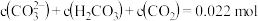
 时,溶液中不存在H2CO3分子
时,溶液中不存在H2CO3分子