某化学兴趣小组对碳、氮、磷等常见元素的化合物性质进行如下研究.请按要求回答问题.
 甲同学用图l所示装置
甲同学用图l所示装置 部分夹持装置略
部分夹持装置略 探究NO与
探究NO与 的反应.
的反应.
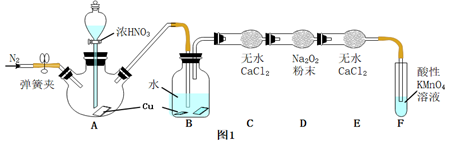
查阅资料:

酸性条件下,NO或 都能与
都能与 反应生成
反应生成 和
和
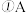 中反应的化学方程式是
中反应的化学方程式是 ______ 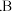 中观察到的主要现象是
中观察到的主要现象是 ______ ,F装置的作用是 ______ .
 在反应前,打开弹簧夹,通入一段时间
在反应前,打开弹簧夹,通入一段时间 ,目的是
,目的是 ______ .
 充分反应后,检验D装置中发生反应的实验是
充分反应后,检验D装置中发生反应的实验是 ______ .
 乙同学查阅有关弱酸的电离平衡常数:
乙同学查阅有关弱酸的电离平衡常数:
则该温度下相同pH的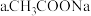 、
、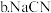 、
、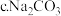 、
、 溶液的物质的量浓度由大到小的顺序为
溶液的物质的量浓度由大到小的顺序为 ______  填编号
填编号 .
.
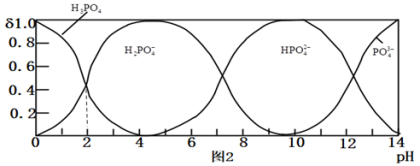
 磷酸
磷酸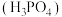 为一种三元酸,其在水溶液中各种存在形式物质的量分数
为一种三元酸,其在水溶液中各种存在形式物质的量分数 随pH的变化曲线如图2:
随pH的变化曲线如图2:
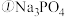 溶液中,
溶液中,
______ 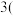 填“
填“ ”“
”“ ”或“
”或“ ”
”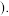 向
向 溶液中滴入稀盐酸后,pH从10降低到5的过程中发生的主要反应的离子方程式为
溶液中滴入稀盐酸后,pH从10降低到5的过程中发生的主要反应的离子方程式为 ______ .
 由图推断
由图推断 溶液中各种微粒浓度关系是
溶液中各种微粒浓度关系是 ______  填选项字母
填选项字母
A.
B.
C.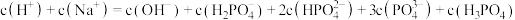
D.
 假设在
假设在 时测得
时测得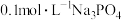 溶液的
溶液的 ,近似计算出
,近似计算出 第一步水解的水解常数
第一步水解的水解常数 用
用 表示
表示

______ 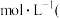 忽略
忽略 第二、第三步水解,结果保留两位有效数字
第二、第三步水解,结果保留两位有效数字 .
.
 甲同学用图l所示装置
甲同学用图l所示装置 部分夹持装置略
部分夹持装置略 探究NO与
探究NO与 的反应.
的反应. 

查阅资料:

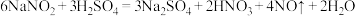
酸性条件下,NO或
 都能与
都能与 反应生成
反应生成 和
和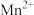
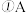 中反应的化学方程式是
中反应的化学方程式是 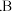 中观察到的主要现象是
中观察到的主要现象是  在反应前,打开弹簧夹,通入一段时间
在反应前,打开弹簧夹,通入一段时间 ,目的是
,目的是  充分反应后,检验D装置中发生反应的实验是
充分反应后,检验D装置中发生反应的实验是  乙同学查阅有关弱酸的电离平衡常数:
乙同学查阅有关弱酸的电离平衡常数: | 化学式 |  | HCN |  |
电离平衡常数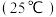 | 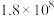 |  |  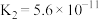 |
则该温度下相同pH的
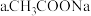 、
、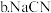 、
、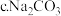 、
、 溶液的物质的量浓度由大到小的顺序为
溶液的物质的量浓度由大到小的顺序为  填编号
填编号 .
. 磷酸
磷酸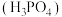 为一种三元酸,其在水溶液中各种存在形式物质的量分数
为一种三元酸,其在水溶液中各种存在形式物质的量分数 随pH的变化曲线如图2:
随pH的变化曲线如图2:  溶液中,
溶液中,
 填“
填“ ”“
”“ ”或“
”或“ ”
”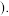 向
向 溶液中滴入稀盐酸后,pH从10降低到5的过程中发生的主要反应的离子方程式为
溶液中滴入稀盐酸后,pH从10降低到5的过程中发生的主要反应的离子方程式为  由图推断
由图推断 溶液中各种微粒浓度关系是
溶液中各种微粒浓度关系是 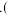 填选项字母
填选项字母
A.

B.

C.
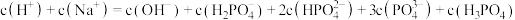
D.

 假设在
假设在 时测得
时测得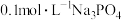 溶液的
溶液的 ,近似计算出
,近似计算出 第一步水解的水解常数
第一步水解的水解常数 用
用 表示
表示

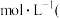 忽略
忽略 第二、第三步水解,结果保留两位有效数字
第二、第三步水解,结果保留两位有效数字 .
.
更新时间:2019/12/26 09:01:28
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】室温下,向20mL盐酸和硫酸的混合溶液中逐渐滴入0.05mol/L的Ba(OH)2溶液,生成的BaSO4沉淀的质量和pH的变化如图所示(不考虑溶液混合时体积的变化)。

(1)原混合溶液中HCl的物质的量的浓度为___________ 。
(2)图中A点对应溶液的pH=___________ 。
(3)pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后,CH3COONa溶液的pH___________ NaOH溶液的pH(填“>“=”或“<”)。
(4)将物质的量浓度相同的盐酸与氨水混合后,溶液中的c( )=c(Cl-),则盐酸的体积
)=c(Cl-),则盐酸的体积___________ 氨水的体积(填“>“=”或“<”)。
(5)将0.2mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中c(Na+)>c(A-),则:
①混合溶液中,c(A-)___________ c(HA)(填“>”“=”或“<”,下同)。
②混合溶液中,c(HA)+ c(A-)___________ 0.1mol/L。
(6)泡沫灭火器(硫酸铝和碳酸氢钠溶液)的作用原理是___________ (写出离子方程式)
(7)室温下,0.1mol/L的NaHA溶液中,测得溶液显碱性。则该溶液中c(H2A)___________ c(A2-) (填“>”<”或“=”)。

(1)原混合溶液中HCl的物质的量的浓度为
(2)图中A点对应溶液的pH=
(3)pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后,CH3COONa溶液的pH
(4)将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(
 )=c(Cl-),则盐酸的体积
)=c(Cl-),则盐酸的体积(5)将0.2mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中c(Na+)>c(A-),则:
①混合溶液中,c(A-)
②混合溶液中,c(HA)+ c(A-)
(6)泡沫灭火器(硫酸铝和碳酸氢钠溶液)的作用原理是
(7)室温下,0.1mol/L的NaHA溶液中,测得溶液显碱性。则该溶液中c(H2A)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】2022年11月15日,二十国集团领导人第十七次峰会上.习近平主席发表题为《共迎时代挑战共建美好未来》的重要讲话,其中提及应对气候变化挑战、向绿色低碳发展转型等话题。请回答下列问题:
(1)一定条件下, 与
与 反应可转化为
反应可转化为 、
、 ,该反应不仅可以应用于温室气体的消除,实现低碳发展,还可以应用于空间站中
,该反应不仅可以应用于温室气体的消除,实现低碳发展,还可以应用于空间站中 与
与 的循环,实现
的循环,实现 的再生。已知:
的再生。已知:
反应Ⅰ.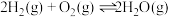

反应Ⅱ.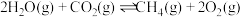

反应Ⅲ.

则
__________  。
。
(2)一定条件下,利用甲烷可将 还原为CO。在一容器中充入
还原为CO。在一容器中充入 、
、 气体各1.0 mol,发生反应
气体各1.0 mol,发生反应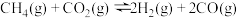
 ,测得
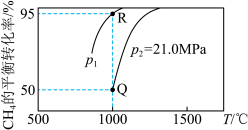
,测得 的平衡转化率随着温度、压强的变化曲线如图所示,则
的平衡转化率随着温度、压强的变化曲线如图所示,则
____  (填“
(填“ ”“
”“ ”或“
”或“ ”),理由是
”),理由是___________ ;Q点的压强平衡常数
____  (用平衡分压代替平衡浓度计算,气体的分压
(用平衡分压代替平衡浓度计算,气体的分压 气体总压强
气体总压强 该气体的物质的量分数)。
该气体的物质的量分数)。
(3)工业生产的烟气中常含有气态硫化物、氮化物等污染物,需经过除硫、除氮才能排放。
①利用 溶液可除去烟气中的
溶液可除去烟气中的 气体,除硫原理如图所示:
气体,除硫原理如图所示:
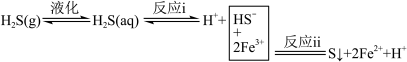
实验室测得脱硫率与溶液pH、 浓度(
浓度( )的关系如图所示,
)的关系如图所示, 浓度大于
浓度大于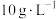 时,脱硫率逐渐降低,原因是
时,脱硫率逐渐降低,原因是_____________ 。
②利用强氧化剂可以对烟气进行脱硫脱硝。在某工厂尾气净化工艺探索中,利用NaClO溶液为氧化剂,控制 ,将烟气中
,将烟气中 价硫的氧化物和
价硫的氧化物和 价氮的氧化物转化为高价含氧酸根离子。测得溶液在不同温度时,脱除率如下表:
价氮的氧化物转化为高价含氧酸根离子。测得溶液在不同温度时,脱除率如下表:
温度高于50℃时,脱除率逐渐降低,原因是________________________ ; 的脱除率比NO的高,原因是
的脱除率比NO的高,原因是_______________________________ 。(答出一点即可)
(1)一定条件下,
 与
与 反应可转化为
反应可转化为 、
、 ,该反应不仅可以应用于温室气体的消除,实现低碳发展,还可以应用于空间站中
,该反应不仅可以应用于温室气体的消除,实现低碳发展,还可以应用于空间站中 与
与 的循环,实现
的循环,实现 的再生。已知:
的再生。已知:反应Ⅰ.
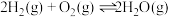

反应Ⅱ.
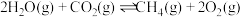

反应Ⅲ.


则

 。
。(2)一定条件下,利用甲烷可将
 还原为CO。在一容器中充入
还原为CO。在一容器中充入 、
、 气体各1.0 mol,发生反应
气体各1.0 mol,发生反应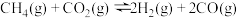
 ,测得
,测得 的平衡转化率随着温度、压强的变化曲线如图所示,则
的平衡转化率随着温度、压强的变化曲线如图所示,则
 (填“
(填“ ”“
”“ ”或“
”或“ ”),理由是
”),理由是
 (用平衡分压代替平衡浓度计算,气体的分压
(用平衡分压代替平衡浓度计算,气体的分压 气体总压强
气体总压强 该气体的物质的量分数)。
该气体的物质的量分数)。
(3)工业生产的烟气中常含有气态硫化物、氮化物等污染物,需经过除硫、除氮才能排放。
①利用
 溶液可除去烟气中的
溶液可除去烟气中的 气体,除硫原理如图所示:
气体,除硫原理如图所示:
实验室测得脱硫率与溶液pH、
 浓度(
浓度( )的关系如图所示,
)的关系如图所示, 浓度大于
浓度大于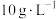 时,脱硫率逐渐降低,原因是
时,脱硫率逐渐降低,原因是
②利用强氧化剂可以对烟气进行脱硫脱硝。在某工厂尾气净化工艺探索中,利用NaClO溶液为氧化剂,控制
 ,将烟气中
,将烟气中 价硫的氧化物和
价硫的氧化物和 价氮的氧化物转化为高价含氧酸根离子。测得溶液在不同温度时,脱除率如下表:
价氮的氧化物转化为高价含氧酸根离子。测得溶液在不同温度时,脱除率如下表:温度/℃ | 10 | 20 | 40 | 50 | 60 | 80 | |
脱除率/% |
| 91.6 | 97.5 | 98.9 | 99.9 | 99.1 | 97.2 |
NO | 76.5 | 77.2 | 78.9 | 80.1 | 79.9 | 78.8 | |
 的脱除率比NO的高,原因是
的脱除率比NO的高,原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】研究电解质在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸的电离常数如下表:
①常温下,物质的量浓度相同的三种溶液NaF、 、
、 ,pH最大的是
,pH最大的是________ 。
②将过量 通入
通入 溶液,反应的离子方程式是
溶液,反应的离子方程式是________ 。
(2)二元弱酸 溶液中
溶液中 、
、 、
、 的物质的量分数
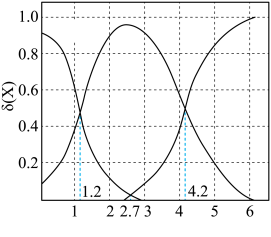
的物质的量分数 随pH的变化如图所示,则
随pH的变化如图所示,则 的电离平衡常数
的电离平衡常数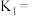
________ 。
(3)向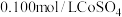 溶液中滴加NaOH溶液调节pH,
溶液中滴加NaOH溶液调节pH, 时开始出现
时开始出现 沉淀,继续滴加NaOH溶液至
沉淀,继续滴加NaOH溶液至
________ 时, 沉淀完全
沉淀完全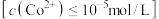 。
。
(4)已知: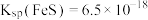 ,
,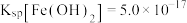 ,
, 的电离常数分别为
的电离常数分别为 、
、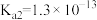 ,在酸性溶液中,反应
,在酸性溶液中,反应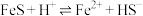 的平衡常数K的数值为
的平衡常数K的数值为________ 。
(5)某工业酸性废水中含有一定量的氨氮以 形式存在,向酸性废水中加入适量
形式存在,向酸性废水中加入适量 溶液,则氨氮转化为
溶液,则氨氮转化为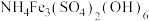 沉淀,处理后可使水中氨氮达到国家规定的排放标准。
沉淀,处理后可使水中氨氮达到国家规定的排放标准。
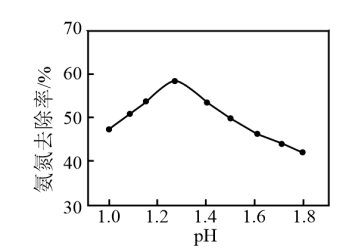
①该反应的离子方程式:________ 。
②废水中氨氮去除率随pH的变化如图所示,当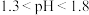 时,氨氮去除率随pH升高而降低的原因是
时,氨氮去除率随pH升高而降低的原因是________ 。
(1)已知部分弱酸的电离常数如下表:
化学式 | HF |
|
|
电离平衡常数K25℃ |
|
|
|
 、
、 ,pH最大的是
,pH最大的是②将过量
 通入
通入 溶液,反应的离子方程式是
溶液,反应的离子方程式是(2)二元弱酸
 溶液中
溶液中 、
、 、
、 的物质的量分数
的物质的量分数 随pH的变化如图所示,则
随pH的变化如图所示,则 的电离平衡常数
的电离平衡常数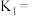

(3)向
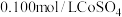 溶液中滴加NaOH溶液调节pH,
溶液中滴加NaOH溶液调节pH, 时开始出现
时开始出现 沉淀,继续滴加NaOH溶液至
沉淀,继续滴加NaOH溶液至
 沉淀完全
沉淀完全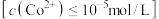 。
。(4)已知:
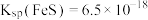 ,
,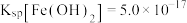 ,
, 的电离常数分别为
的电离常数分别为 、
、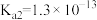 ,在酸性溶液中,反应
,在酸性溶液中,反应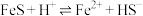 的平衡常数K的数值为
的平衡常数K的数值为(5)某工业酸性废水中含有一定量的氨氮以
 形式存在,向酸性废水中加入适量
形式存在,向酸性废水中加入适量 溶液,则氨氮转化为
溶液,则氨氮转化为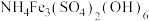 沉淀,处理后可使水中氨氮达到国家规定的排放标准。
沉淀,处理后可使水中氨氮达到国家规定的排放标准。
①该反应的离子方程式:
②废水中氨氮去除率随pH的变化如图所示,当
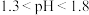 时,氨氮去除率随pH升高而降低的原因是
时,氨氮去除率随pH升高而降低的原因是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】工业上用磷铁渣(主要含FeP、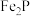 ,以及少量
,以及少量 、
、 等杂质)制备磷酸铁的工艺流程如下图。已知:①在密闭的反应釜中,稀硝酸首先分解生成
等杂质)制备磷酸铁的工艺流程如下图。已知:①在密闭的反应釜中,稀硝酸首先分解生成 和
和 ,
, 进一步将磷铁渣中的FeP、
进一步将磷铁渣中的FeP、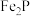 氧化成
氧化成 和
和 ;继而生成
;继而生成 和
和 。②
。② 难溶于水,可溶于无机强酸。
难溶于水,可溶于无机强酸。

(1)加入硫酸的目的有___________ 。
(2)“浸取”时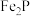 与
与 反应的化学方程式为
反应的化学方程式为___________ 。
(3)“浸取”时设定反应时间为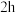 ,不同硝酸浓度下磷铁渣的溶解率如图1所示,当硝酸浓度在
,不同硝酸浓度下磷铁渣的溶解率如图1所示,当硝酸浓度在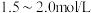 时,磷铁渣溶解率呈现降低的趋势,其原因是
时,磷铁渣溶解率呈现降低的趋势,其原因是___________ ,为了缓解这一问题,投料时加一定量的活性炭,活性炭的作用是___________ 。

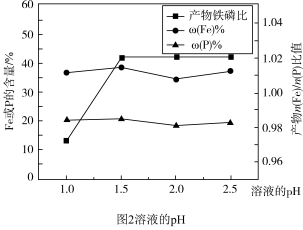
(4)“制备”过程中溶液的pH对磷酸铁产品中铁和磷的含量及 比值的影响如图2所示[考虑到微量金属杂质,在
比值的影响如图2所示[考虑到微量金属杂质,在 时,
时, 为0.973最接近理论值]。在pH范围为1~1.5时,随着pH增大,
为0.973最接近理论值]。在pH范围为1~1.5时,随着pH增大, 明显增大,其原因是
明显增大,其原因是___________ 。
(5)工业上也可以用可溶性三价铁盐在酸性溶液中与磷酸盐反应,通过氨水调节pH得到磷酸铁。将 与
与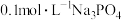 等体积混合充分反应后,静置,上层的清液中
等体积混合充分反应后,静置,上层的清液中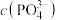 为
为___________  。【已知:
。【已知: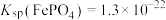 】
】
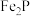 ,以及少量
,以及少量 、
、 等杂质)制备磷酸铁的工艺流程如下图。已知:①在密闭的反应釜中,稀硝酸首先分解生成
等杂质)制备磷酸铁的工艺流程如下图。已知:①在密闭的反应釜中,稀硝酸首先分解生成 和
和 ,
, 进一步将磷铁渣中的FeP、
进一步将磷铁渣中的FeP、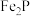 氧化成
氧化成 和
和 ;继而生成
;继而生成 和
和 。②
。② 难溶于水,可溶于无机强酸。
难溶于水,可溶于无机强酸。
(1)加入硫酸的目的有
(2)“浸取”时
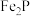 与
与 反应的化学方程式为
反应的化学方程式为(3)“浸取”时设定反应时间为
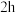 ,不同硝酸浓度下磷铁渣的溶解率如图1所示,当硝酸浓度在
,不同硝酸浓度下磷铁渣的溶解率如图1所示,当硝酸浓度在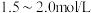 时,磷铁渣溶解率呈现降低的趋势,其原因是
时,磷铁渣溶解率呈现降低的趋势,其原因是
(4)“制备”过程中溶液的pH对磷酸铁产品中铁和磷的含量及
 比值的影响如图2所示[考虑到微量金属杂质,在
比值的影响如图2所示[考虑到微量金属杂质,在 时,
时, 为0.973最接近理论值]。在pH范围为1~1.5时,随着pH增大,
为0.973最接近理论值]。在pH范围为1~1.5时,随着pH增大, 明显增大,其原因是
明显增大,其原因是
(5)工业上也可以用可溶性三价铁盐在酸性溶液中与磷酸盐反应,通过氨水调节pH得到磷酸铁。将
 与
与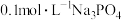 等体积混合充分反应后,静置,上层的清液中
等体积混合充分反应后,静置,上层的清液中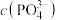 为
为 。【已知:
。【已知: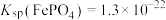 】
】
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】已知:25℃时,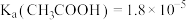 。
。
(1)常温下,将pH和体积均相同的 和
和 溶液分别稀释,溶液pH随加水体积的变化如图:
溶液分别稀释,溶液pH随加水体积的变化如图:___________ 溶液(填“ ”或“
”或“ ”)。
”)。
②a、b两点对应的溶液中,水的电离程度a___________ b(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
③酸度( )也可表示溶液的酸碱性,
)也可表示溶液的酸碱性,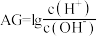 。常温下,
。常温下, 的硝酸溶液
的硝酸溶液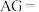
___________ 。
(2)常温下,向某浓度的二元弱酸草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中H2C2O4、HC2O 、C2O
、C2O 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:___________ 。
②如果所得溶液溶质为KHC2O4,则该溶液显___________ (填“酸性”、“碱性”或“中性”);原因是___________ (结合数据计算说明)。
③当所得溶液pH=2.7时,溶液中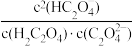 =
=___________ 。
④等浓度等体积的KHC2O4、K2C2O4混合,溶液中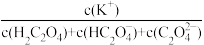 =
=___________ 。
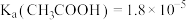 。
。(1)常温下,将pH和体积均相同的
 和
和 溶液分别稀释,溶液pH随加水体积的变化如图:
溶液分别稀释,溶液pH随加水体积的变化如图:
 ”或“
”或“ ”)。
”)。②a、b两点对应的溶液中,水的电离程度a
 ”、“
”、“ ”或“
”或“ ”)。
”)。③酸度(
 )也可表示溶液的酸碱性,
)也可表示溶液的酸碱性,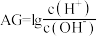 。常温下,
。常温下, 的硝酸溶液
的硝酸溶液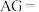
(2)常温下,向某浓度的二元弱酸草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中H2C2O4、HC2O
 、C2O
、C2O 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题: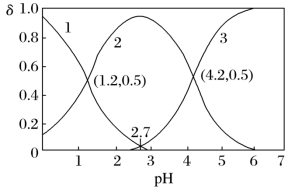
②如果所得溶液溶质为KHC2O4,则该溶液显
③当所得溶液pH=2.7时,溶液中
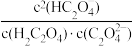 =
=④等浓度等体积的KHC2O4、K2C2O4混合,溶液中
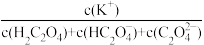 =
=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】盐酸、醋酸、碳酸钠和碳酸氢钠都是生活中常用的物质。某小组进行了以下实验。
(1)对比盐酸和醋酸与 的反应。常温下,用
的反应。常温下,用 溶液分别滴定
溶液分别滴定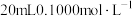 的盐酸和醋酸,滴定过程中溶液
的盐酸和醋酸,滴定过程中溶液 的变化曲线如下图所示。
的变化曲线如下图所示。
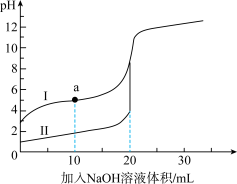
①表示滴定盐酸的曲线是___________ (填“Ⅰ”或“Ⅱ”)。
② 点溶液中,离子浓度由大到小的顺序为
点溶液中,离子浓度由大到小的顺序为___________ 。
③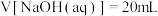 时,
时,
___________ 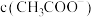 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)向相同体积、相同浓度的 和
和 溶液中分别滴加
溶液中分别滴加 的盐酸,溶液
的盐酸,溶液 变化如下。
变化如下。
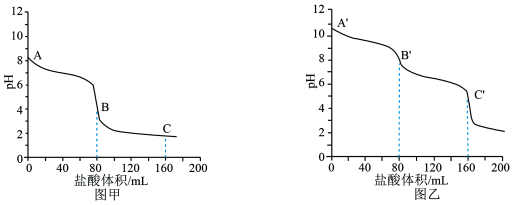
①图___________ (填“甲”或“乙”)是 的滴定曲线。
的滴定曲线。
②A'~B'发生反应的离子方程式为___________ 。
③下列说法正确的是___________ (填序号)。
a.B'点和C'点溶液中均满足: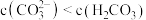
b.A、B、C均满足: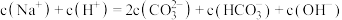
c.水的电离程度: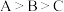
(3)向1mol/L的 和
和 溶液中分别滴加少量
溶液中分别滴加少量 溶液,均产生白色沉淀,后者有气体产生。
溶液,均产生白色沉淀,后者有气体产生。
资料:
ⅰ.1mol/L的 溶液中,
溶液中,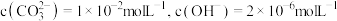
ⅱ. 时,
时,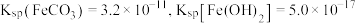
①补全 与
与 反应的离子方程式:
反应的离子方程式:_______
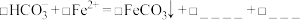
②通过计算说明 与
与 反应产生的沉淀为
反应产生的沉淀为 而不是
而不是 :
:___________ 。
(1)对比盐酸和醋酸与
 的反应。常温下,用
的反应。常温下,用 溶液分别滴定
溶液分别滴定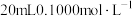 的盐酸和醋酸,滴定过程中溶液
的盐酸和醋酸,滴定过程中溶液 的变化曲线如下图所示。
的变化曲线如下图所示。
①表示滴定盐酸的曲线是
②
 点溶液中,离子浓度由大到小的顺序为
点溶液中,离子浓度由大到小的顺序为③
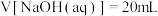 时,
时,
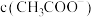 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(2)向相同体积、相同浓度的
 和
和 溶液中分别滴加
溶液中分别滴加 的盐酸,溶液
的盐酸,溶液 变化如下。
变化如下。
①图
 的滴定曲线。
的滴定曲线。②A'~B'发生反应的离子方程式为
③下列说法正确的是
a.B'点和C'点溶液中均满足:
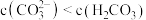
b.A、B、C均满足:
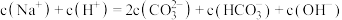
c.水的电离程度:
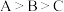
(3)向1mol/L的
 和
和 溶液中分别滴加少量
溶液中分别滴加少量 溶液,均产生白色沉淀,后者有气体产生。
溶液,均产生白色沉淀,后者有气体产生。资料:
ⅰ.1mol/L的
 溶液中,
溶液中,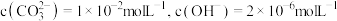
ⅱ.
 时,
时,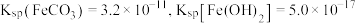
①补全
 与
与 反应的离子方程式:
反应的离子方程式: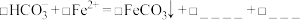
②通过计算说明
 与
与 反应产生的沉淀为
反应产生的沉淀为 而不是
而不是 :
:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】已知在25℃时,部分弱酸的电离常数如表所示:
(1)写出碳酸的第二级电离平衡常数表达式:Ka2=___ 。
(2)若保持温度不变,在醋酸溶液中加入少量醋酸钠固体,下列各量会变小的是___ (填字母)。
(3)pH相等的CH3COONa溶液、NaHCO3溶液、Na2SO3溶液中,溶质的物质的量浓度最大的是___ 溶液。
(4)向Na2CO3溶液中逐滴加入等物质的量浓度、等体积的NaHSO3溶液,充分反应后,溶液中各离子浓度由大到小的顺序为___ 。
| CH3COOH | Ka=1.75×10-5 |
| H2CO3 | Ka1=4.30×10-7、Ka2=5.61×10-11 |
| H2SO3 | Ka1=1.54×10-2、Ka2=1.02×10-7 |
(1)写出碳酸的第二级电离平衡常数表达式:Ka2=
(2)若保持温度不变,在醋酸溶液中加入少量醋酸钠固体,下列各量会变小的是
| A.c(CH3COO-) | B.c(H+) |
| C.醋酸的电离平衡常数 | D.醋酸的电离度 |
(4)向Na2CO3溶液中逐滴加入等物质的量浓度、等体积的NaHSO3溶液,充分反应后,溶液中各离子浓度由大到小的顺序为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】按要求回答下列问题
可乐中的食品添加剂有白砂糖、二氧化碳、焦糖色、磷酸、咖啡因等。可乐的辛辣味与磷酸(化学式为H3PO4,沸点高,难挥发)有一定关系。
(1)室温下,测得0.1 mol/L H3PO4溶液的pH= 1.5,用电离方程式解释原因:_______ 。
(2)羟基磷酸钙[Ca5(PO4)3OH]是牙齿表面起保护作用的一层坚硬物质, 在唾液中存在如下平衡:Ca5(PO4)3OH(s)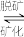 5Ca2+(aq) +3
5Ca2+(aq) +3 (aq) + OH-(aq),长期过量饮用可乐会破坏这层坚硬物质,造成龋齿。结合平衡移动原理解释原因:
(aq) + OH-(aq),长期过量饮用可乐会破坏这层坚硬物质,造成龋齿。结合平衡移动原理解释原因:_______ 。
(3)用含氟牙膏刷牙,氟离子会与牙釉质[主要成分为Ca5(PO4)3OH]发生反应: Ca5(PO4)3OH(s)+F-(aq) Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=
Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=_______ (已知Ksp[Ca5(PO4)3OH]=7×l0-37,Ksp[Ca5(PO4)3F]=2.8×l0-61)。
(4)向磷酸溶液中滴加NaOH溶液,含磷各微粒在溶液中的物质的量分数与pH的关系如图。
①向磷酸溶液中滴加NaOH溶液至pH = 10时发生的主要反应的离子方程式是_______ 。
②下列关于0.1 mol/L Na2HPO4溶液的说法正确的是_______ (填序号)。
a.Na2HPO4溶液显碱性,原因是 的水解程度大于其电离程度
的水解程度大于其电离程度
b.c(Na+) + c(H+) = c(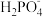 )+ 2c(
)+ 2c( ) + 3c(
) + 3c( )+ c(OH- )
)+ c(OH- )
c.c(Na+) = c(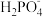 ) + c(
) + c( ) +c(
) +c( ) + c(H3PO4)
) + c(H3PO4)
可乐中的食品添加剂有白砂糖、二氧化碳、焦糖色、磷酸、咖啡因等。可乐的辛辣味与磷酸(化学式为H3PO4,沸点高,难挥发)有一定关系。
(1)室温下,测得0.1 mol/L H3PO4溶液的pH= 1.5,用电离方程式解释原因:
(2)羟基磷酸钙[Ca5(PO4)3OH]是牙齿表面起保护作用的一层坚硬物质, 在唾液中存在如下平衡:Ca5(PO4)3OH(s)
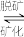 5Ca2+(aq) +3
5Ca2+(aq) +3 (aq) + OH-(aq),长期过量饮用可乐会破坏这层坚硬物质,造成龋齿。结合平衡移动原理解释原因:
(aq) + OH-(aq),长期过量饮用可乐会破坏这层坚硬物质,造成龋齿。结合平衡移动原理解释原因:(3)用含氟牙膏刷牙,氟离子会与牙釉质[主要成分为Ca5(PO4)3OH]发生反应: Ca5(PO4)3OH(s)+F-(aq)
 Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=
Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=(4)向磷酸溶液中滴加NaOH溶液,含磷各微粒在溶液中的物质的量分数与pH的关系如图。

①向磷酸溶液中滴加NaOH溶液至pH = 10时发生的主要反应的离子方程式是
②下列关于0.1 mol/L Na2HPO4溶液的说法正确的是
a.Na2HPO4溶液显碱性,原因是
 的水解程度大于其电离程度
的水解程度大于其电离程度b.c(Na+) + c(H+) = c(
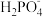 )+ 2c(
)+ 2c( ) + 3c(
) + 3c( )+ c(OH- )
)+ c(OH- )c.c(Na+) = c(
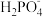 ) + c(
) + c( ) +c(
) +c( ) + c(H3PO4)
) + c(H3PO4)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g)△H1=-574 kJ·mol-1
CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g)△H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为____________________ 。
(2)脱碳。将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图1所示,则上述CO2转化为甲醇的反应的△H3________ 0(填“>”、“<”或“=”)。
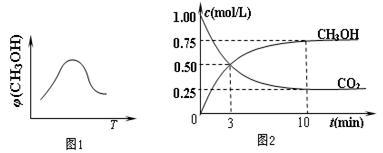
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图2所示。下列说法正确的是________ (填字母代号)。
A.第10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时c(CH3OH)=1.5mol/L
B.0~10 min内,氢气的平均反应速率为0.075 mol/(L·min)
C.达到平衡时,氢气的转化率为0.75
D.升高温度将使n(CH3OH)/n(CO2)减小
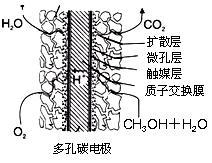
③甲醇燃料电池结构如下图所示。其工作时正极的电极反应式可表示为__________
(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。硫酸铵和硝酸铵的水溶液的pH<7,其中原因可用一个离子方程式表示为:_____________________ ;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,溶液的pH=7,则溶液中c(Na+)+c(H+)____ c(NO )+c(OH-)(填“>”“=”或“<”)
)+c(OH-)(填“>”“=”或“<”)
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g)△H1=-574 kJ·mol-1
CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g)△H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为
(2)脱碳。将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图1所示,则上述CO2转化为甲醇的反应的△H3

②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图2所示。下列说法正确的是
A.第10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时c(CH3OH)=1.5mol/L
B.0~10 min内,氢气的平均反应速率为0.075 mol/(L·min)
C.达到平衡时,氢气的转化率为0.75
D.升高温度将使n(CH3OH)/n(CO2)减小
③甲醇燃料电池结构如下图所示。其工作时正极的电极反应式可表示为

(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。硫酸铵和硝酸铵的水溶液的pH<7,其中原因可用一个离子方程式表示为:
 )+c(OH-)(填“>”“=”或“<”)
)+c(OH-)(填“>”“=”或“<”)
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发黏、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品,氯气过量则会生在SCl2。____________ ,装置F中试剂的作用是____________ 。
②装置连接顺序:A→________ →________ →________ →E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是____________ 。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和____________ 。
(2)少量S2Cl2泄漏时应喷水减慢其挥发(或扩散),并产生酸性悬浊液,但不要对泄漏物或泄漏点直接喷水,其原因是____________ 。
(3)S2Cl2遇水会生成SO2、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中SO2的体积分数。____________ (填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中二氧化硫的体积分数为____________ (用含V、m的式子表示)。
| 物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
| 剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
| 化学性质 | ①300℃以上完全分解 ②S2Cl2+Cl2 ④受热或遇水分解放热,放出腐蚀性烟气 | ||||
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品,氯气过量则会生在SCl2。
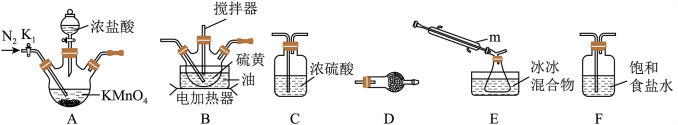
②装置连接顺序:A→
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是
④为了提高S2Cl2的纯度,实验的关键是控制好温度和
(2)少量S2Cl2泄漏时应喷水减慢其挥发(或扩散),并产生酸性悬浊液,但不要对泄漏物或泄漏点直接喷水,其原因是
(3)S2Cl2遇水会生成SO2、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中SO2的体积分数。
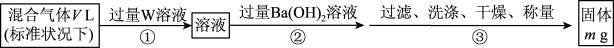
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中二氧化硫的体积分数为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】 还原
还原 是工业上制备单质硅的重要方法,化学小组在实验室模拟该过程进行如下探究。已知相关物质的部分性质如下表所示:
是工业上制备单质硅的重要方法,化学小组在实验室模拟该过程进行如下探究。已知相关物质的部分性质如下表所示:
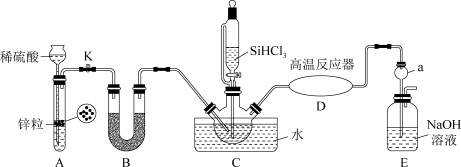
请回答下列问题:
(1)装置A中盛放稀硫酸的仪器名称为_______ ,装置E的作用为_______ 。
(2)检验装置A气密性的方法为_______ 。
(3)向装置C的三颈烧瓶中滴加 前,需先用
前,需先用 排尽装置中的空气,原因为
排尽装置中的空气,原因为___ ,验证空气已排尽的方法为__ 。
(4)实验时,先加热_______ (填“C”或“D”)更合理。
(5)装置D中反应的化学方程式为_______ 。
(6)该小组为了检验 中是否含有
中是否含有 ,进行如下实验:取
,进行如下实验:取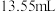 样品配成
样品配成 溶液;取出
溶液;取出 所配溶液,以
所配溶液,以 溶液作指示剂,用
溶液作指示剂,用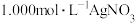 标准溶液滴定,达到滴定终点时,消耗标准液的体积为
标准溶液滴定,达到滴定终点时,消耗标准液的体积为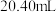 ,则样品中
,则样品中___ (填“是”或“否”)含有 。
。
 还原
还原 是工业上制备单质硅的重要方法,化学小组在实验室模拟该过程进行如下探究。已知相关物质的部分性质如下表所示:
是工业上制备单质硅的重要方法,化学小组在实验室模拟该过程进行如下探究。已知相关物质的部分性质如下表所示:| 物质 | 密度/ | 沸点/℃ | 溶解性 | 化学性质 |
 | 1.48 | 57.6 | 易溶于有机溶剂 | 与水反应生成两种酸,高温下与氧气反应 |
 | 1.34 | 33 | 易溶于有机溶剂 | 与水反应生成两种酸和一种可燃性气体,能自燃 |

请回答下列问题:
(1)装置A中盛放稀硫酸的仪器名称为
(2)检验装置A气密性的方法为
(3)向装置C的三颈烧瓶中滴加
 前,需先用
前,需先用 排尽装置中的空气,原因为
排尽装置中的空气,原因为(4)实验时,先加热
(5)装置D中反应的化学方程式为
(6)该小组为了检验
 中是否含有
中是否含有 ,进行如下实验:取
,进行如下实验:取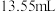 样品配成
样品配成 溶液;取出
溶液;取出 所配溶液,以
所配溶液,以 溶液作指示剂,用
溶液作指示剂,用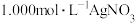 标准溶液滴定,达到滴定终点时,消耗标准液的体积为
标准溶液滴定,达到滴定终点时,消耗标准液的体积为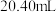 ,则样品中
,则样品中 。
。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】实验室以FeCl2溶液为原料制备高密度磁记录材料Fe/Fe3O4复合物。
(1)在氩气气氛下,向装有50mL1mol·L-1FeCl2溶液的三颈烧瓶中逐滴加入100mL14mol·L-1KOH溶液,用磁力搅拌器持续搅拌,在100℃下回流3h,得到成分为Fe和Fe3O4的黑色沉淀。
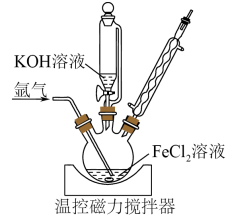
①三颈烧瓶发生反应的离子方程式为_______ 。
②检验反应是否进行完全的操作是_______ 。
(2)待三颈烧瓶中的混合物冷却后,过滤,再依次用沸水和乙醇洗涤,在40℃干燥后焙烧3h,得到Fe/Fe3O4复合物产品3.24g。
①焙烧需在隔绝空气条件下进行,原因是_______ 。
②计算实验所得产品的产率_______ (写出计算过程)。
(3)以FeCl2溶液为原料还可制备软磁性材料α−Fe2O3.已知:Fe(OH)2开始沉淀的pH=6.5。请补充完整实验方案:在搅拌下向FeCl2溶液中缓慢加入氨水-NH4HCO3混合溶液,控制溶液pH不大于6.5,_______ ,将固体干燥,得到纯净的FeCO3,将其放入管式炉内煅烧2h,获得产品α−Fe2O3(可选用的试剂:2mol•L−1盐酸、2mol•L−1硝酸、AgNO3溶液、蒸馏水)。
(1)在氩气气氛下,向装有50mL1mol·L-1FeCl2溶液的三颈烧瓶中逐滴加入100mL14mol·L-1KOH溶液,用磁力搅拌器持续搅拌,在100℃下回流3h,得到成分为Fe和Fe3O4的黑色沉淀。

①三颈烧瓶发生反应的离子方程式为
②检验反应是否进行完全的操作是
(2)待三颈烧瓶中的混合物冷却后,过滤,再依次用沸水和乙醇洗涤,在40℃干燥后焙烧3h,得到Fe/Fe3O4复合物产品3.24g。
①焙烧需在隔绝空气条件下进行,原因是
②计算实验所得产品的产率
(3)以FeCl2溶液为原料还可制备软磁性材料α−Fe2O3.已知:Fe(OH)2开始沉淀的pH=6.5。请补充完整实验方案:在搅拌下向FeCl2溶液中缓慢加入氨水-NH4HCO3混合溶液,控制溶液pH不大于6.5,
您最近一年使用:0次

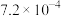
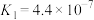

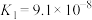
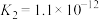
 2SCl2
2SCl2 

