下列叙述正确的是
| A.反应活化能越高,该反应越易进行 |
| B.在恒温条件下,增大压强,化学反应速率一定加快 |
| C.强电解质溶液中一定不存在电离平衡 |
| D.某温度下,一元弱酸HA的Ka越小,则NaA的Kh(水解平衡常数)越大 |
更新时间:2019-12-26 21:16:04
|
相似题推荐
单选题
|
较易
(0.85)
【推荐1】在0.1mol•L﹣1NH3•H2O溶液中存在如下电离平衡:NH3•H2O⇌NH4++OH﹣.对于该平衡,下列叙述中正确的是( )
A.加入水时,溶液中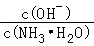 增大 增大 |
| B.加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小 |
| C.加入少量0.1 mol•L﹣1HCl溶液,溶液中c(OH﹣)增大 |
| D.降低温度,溶液中c(NH4+)增大 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】常温下,在20.0mL0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图。已知0.10mol•L-1氨水的电离度为1.32%,下列叙述错误的是


| A.该滴定过程应该选择甲基橙作为指示剂 | B.M点对应的盐酸体积小于20.0mL |
| C.M点处的溶液中c(H+)=c(OH-) | D.N点处的溶液中pH>12 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐3】常温下,用 0.10 mol/LKOH 溶液滴定 10.00mL 0.10 mol/L 某二元弱酸H2R 溶液,滴定曲线如图(混合溶液总体积看作混合前两种溶液体积之和),下列关系不正确的是
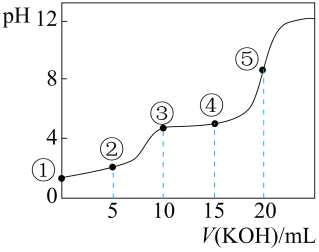

| A.点②所示溶液中:c(K+)+c(H+)=c(HR-)+2c(R2-)+c(OH-) |
| B.点③所示溶液中:c(K+)> c(HR-)> c(R2-)>c(H2R) |
| C.点④所示溶液中:c(H2R)+ c(HR-)+ c(R2-)=0.04mol·L-1 |
| D.点⑤所示溶液中:c(H+)= c(HR-)+2 c(H2R)+ c(OH-) |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
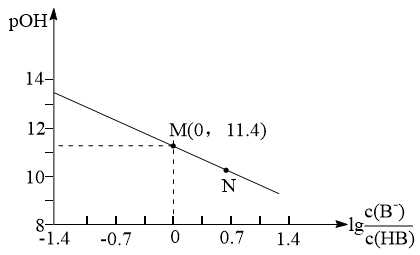
【推荐1】已知: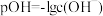 ,它也能较方便地表示溶液的酸碱性。室温下,将稀NaOH溶液滴加到一元酸HB溶液中,混合溶液的pOH随
,它也能较方便地表示溶液的酸碱性。室温下,将稀NaOH溶液滴加到一元酸HB溶液中,混合溶液的pOH随 上的变化如图所示。下列说法错误的是
上的变化如图所示。下列说法错误的是
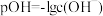 ,它也能较方便地表示溶液的酸碱性。室温下,将稀NaOH溶液滴加到一元酸HB溶液中,混合溶液的pOH随
,它也能较方便地表示溶液的酸碱性。室温下,将稀NaOH溶液滴加到一元酸HB溶液中,混合溶液的pOH随 上的变化如图所示。下列说法错误的是
上的变化如图所示。下列说法错误的是
| A.当酸碱完全中和时,水的电离程度最大 |
B.室温下,HB的Ka数量级为 |
| C.将HB与NaB两溶液等体积等浓度混合,所得溶液呈碱性 |
D.N点对应溶液中: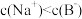 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐2】常温下,其他条件不变,加水稀释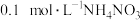 溶液。图中横坐标轴代表加水量,则纵坐标轴代表
溶液。图中横坐标轴代表加水量,则纵坐标轴代表

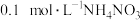 溶液。图中横坐标轴代表加水量,则纵坐标轴代表
溶液。图中横坐标轴代表加水量,则纵坐标轴代表
A. 的水解常数 的水解常数 | B.溶液的pH |
C.溶液中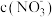 | D.溶液中 的数目 的数目 |
您最近一年使用:0次

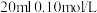 的
的 溶液中逐滴加入
溶液中逐滴加入 的
的 溶液,溶液中由水电离出的
溶液,溶液中由水电离出的 浓度的负对数
浓度的负对数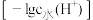 与所加
与所加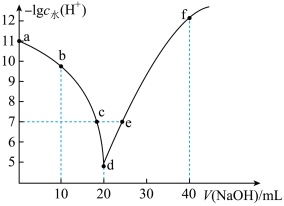
 约为
约为




