 是燃烧和代谢的最终产物,也是造成温室效应的废气,但
是燃烧和代谢的最终产物,也是造成温室效应的废气,但 作为一种资源,开发和利用的前景十分诱人.
作为一种资源,开发和利用的前景十分诱人.I、利用太阳能,以
 为原料制取炭黑的流程如图所示.过程2的化学方程式为
为原料制取炭黑的流程如图所示.过程2的化学方程式为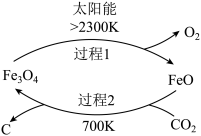
Ⅱ、近年科学家提出“绿色自由”构想.把含有大量
 的空气吹入
的空气吹入 溶液中,再把
溶液中,再把 从溶液中提取出来,并使之与
从溶液中提取出来,并使之与 反应生成.其工艺流程如图所示:
反应生成.其工艺流程如图所示: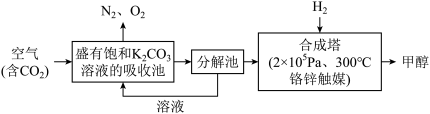
 由吸收池导入分解池中的主要物质的化学式是
由吸收池导入分解池中的主要物质的化学式是 上述流程中
上述流程中 填化学式
填化学式 可循环使用,体现了该流程的“绿色”.
可循环使用,体现了该流程的“绿色”. 不同温度下,在1L恒容密闭容器中充入2mol
不同温度下,在1L恒容密闭容器中充入2mol  和5mol
和5mol  ,相同时间内测得
,相同时间内测得 的转化率随温度变化如图所示:
的转化率随温度变化如图所示: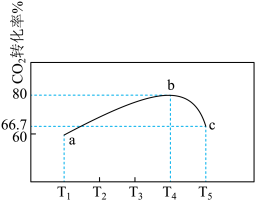
 合成塔中发生的化学反应方程式为
合成塔中发生的化学反应方程式为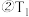 时a点ʋ(正)
时a点ʋ(正) ”,“
”,“ ”,“
”,“ ”);
”); 计算温度为
计算温度为 时b的平衡常数为
时b的平衡常数为 为检验吸收池中饱和
为检验吸收池中饱和 溶液是否充足,量取100mL吸收液用
溶液是否充足,量取100mL吸收液用 盐酸滴定,生成的
盐酸滴定,生成的 标准状况下
标准状况下 随
随 盐酸
盐酸 变化关系如图所示:
变化关系如图所示: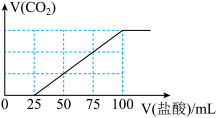
则该100mL吸收液还可吸收标准状况下
 .
.Ⅲ
 以稀硫酸为电解质溶液,惰性材料为电极,利用太阳能将
以稀硫酸为电解质溶液,惰性材料为电极,利用太阳能将 转化为低碳烯烃,工作原理如图所示.
转化为低碳烯烃,工作原理如图所示.
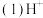 的移动方向是
的移动方向是 填从左至右或从右至左
填从左至右或从右至左
 产生乙烯的电极反应式为
产生乙烯的电极反应式为
更新时间:2020-01-07 19:10:41
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】二氧化碳加氢制甲醇和甲烷重整对碳资源利用具有重要的战略意义。回答下列问题:
(1) 加氢选择合成甲醇的主要反应如下:
加氢选择合成甲醇的主要反应如下:
反应ⅰ: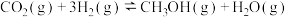

反应ⅱ: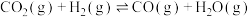
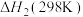
反应ⅲ:
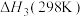
①在一定温度下,由最稳定单质生成1mol某物质的焓变叫做该物质的标准摩尔生成焓,下表为298K时几种物质的标准摩尔生成焓( )。
)。
有利于反应ⅰ自发进行的条件是___________ (填“高温”或“低温”);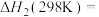
___________  。
。
②反应ⅱ的反应速率 ,其中
,其中 、
、 分别为正、逆反应速率常数。该反应的平衡常数
分别为正、逆反应速率常数。该反应的平衡常数 ,则m=
,则m=___________ ,升高温度时,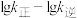
___________ (填“增大”、“减小”或“不变”)。
(2)甲烷重整工艺主要包括甲烷三重整制氢、甲烷二氧化碳重整制氢等。
甲烷三重整制氢的逆反应为 。将
。将 与CO按物质的量之比3∶1加入反应装置,在不同条件下达到平衡时甲烷的物质的量分数为
与CO按物质的量之比3∶1加入反应装置,在不同条件下达到平衡时甲烷的物质的量分数为 ,在
,在 条件下
条件下 与p的关系、在
与p的关系、在 条件下
条件下 与t的关系如图所示:
与t的关系如图所示:
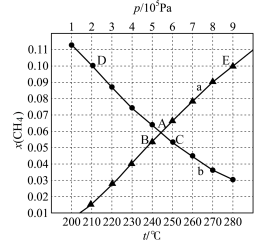
①当CO的平衡转化率为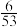 时,反应条件可能是
时,反应条件可能是___________ ;图中能表示相同状态下、相同平衡状态的点是___________ 。
②210℃时,甲烷三重整制氢反应的标准平衡常数
___________ 。(已知:分压=总压×该组分物质的量分数,对于反应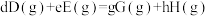 ,
, ,其中
,其中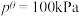 ,
,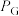 、
、 、
、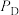 、
、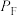 为各组分的平衡分压)
为各组分的平衡分压)
(1)
 加氢选择合成甲醇的主要反应如下:
加氢选择合成甲醇的主要反应如下:反应ⅰ:
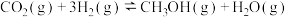

反应ⅱ:
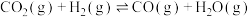
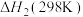
反应ⅲ:

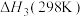
①在一定温度下,由最稳定单质生成1mol某物质的焓变叫做该物质的标准摩尔生成焓,下表为298K时几种物质的标准摩尔生成焓(
 )。
)。| 物质 |  |  |  |  |  |  |
 | 0 | 0 | -110.5 | -393.5 | -241.8 | -201.2 |
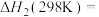
 。
。②反应ⅱ的反应速率
 ,其中
,其中 、
、 分别为正、逆反应速率常数。该反应的平衡常数
分别为正、逆反应速率常数。该反应的平衡常数 ,则m=
,则m=
(2)甲烷重整工艺主要包括甲烷三重整制氢、甲烷二氧化碳重整制氢等。
甲烷三重整制氢的逆反应为
 。将
。将 与CO按物质的量之比3∶1加入反应装置,在不同条件下达到平衡时甲烷的物质的量分数为
与CO按物质的量之比3∶1加入反应装置,在不同条件下达到平衡时甲烷的物质的量分数为 ,在
,在 条件下
条件下 与p的关系、在
与p的关系、在 条件下
条件下 与t的关系如图所示:
与t的关系如图所示:
①当CO的平衡转化率为
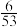 时,反应条件可能是
时,反应条件可能是②210℃时,甲烷三重整制氢反应的标准平衡常数

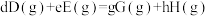 ,
, ,其中
,其中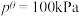 ,
,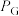 、
、 、
、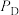 、
、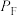 为各组分的平衡分压)
为各组分的平衡分压)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】CO、氮氧化物( )均为大气污染物,研究它们的反应机理,对于消除污染、建设生态文明具有重要意义。回答下列问题:
)均为大气污染物,研究它们的反应机理,对于消除污染、建设生态文明具有重要意义。回答下列问题:
(1)已知:
①

②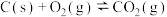
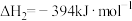
③
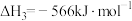
则相同条件下反应

_______ ;若 逆反应的活化能为
逆反应的活化能为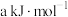 ,则正反应的活化能
,则正反应的活化能
_______ 。
(2)在10L恒容密闭容器中,保持温度不变,将物质的量之和为4mol的CO和 以不同的碳氮比
以不同的碳氮比 进行反应
进行反应 ,平衡时某反应物的转化率(
,平衡时某反应物的转化率( )与碳氮比的关系如图所示:
)与碳氮比的关系如图所示:

①图中纵坐标为_______ (填化学式)的转化率。
②经过10min到达A点,该时间段内以 物质的量浓度变化表示的化学反应速率
物质的量浓度变化表示的化学反应速率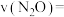
_______ 。
③若容器内起始压强为40MPa,则B点的压强平衡常数
_______ ( 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
(3)汽车尾气中含有CO、NO,已知
 。未达平衡前要同时提高汽车尾气中CO、NO的转化率和化学反应速率,应选择的最佳措施是_______(填标号)。
。未达平衡前要同时提高汽车尾气中CO、NO的转化率和化学反应速率,应选择的最佳措施是_______(填标号)。
(4)氮氧化物( )也可以利用惰性电极间接电解法进行处理,获得硝酸等化工原料,其原理如图所示:
)也可以利用惰性电极间接电解法进行处理,获得硝酸等化工原料,其原理如图所示:

①N极为电解池的_______ (填“阴极”或“阳极”);物质P是_______ (填化学式)。
②写出气体吸收柱内吸收NO的离子方程式:_______ 。
 )均为大气污染物,研究它们的反应机理,对于消除污染、建设生态文明具有重要意义。回答下列问题:
)均为大气污染物,研究它们的反应机理,对于消除污染、建设生态文明具有重要意义。回答下列问题:(1)已知:
①


②
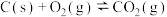
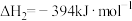
③

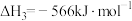
则相同条件下反应


 逆反应的活化能为
逆反应的活化能为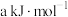 ,则正反应的活化能
,则正反应的活化能
(2)在10L恒容密闭容器中,保持温度不变,将物质的量之和为4mol的CO和
 以不同的碳氮比
以不同的碳氮比 进行反应
进行反应 ,平衡时某反应物的转化率(
,平衡时某反应物的转化率( )与碳氮比的关系如图所示:
)与碳氮比的关系如图所示:
①图中纵坐标为
②经过10min到达A点,该时间段内以
 物质的量浓度变化表示的化学反应速率
物质的量浓度变化表示的化学反应速率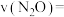
③若容器内起始压强为40MPa,则B点的压强平衡常数

 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。(3)汽车尾气中含有CO、NO,已知

 。未达平衡前要同时提高汽车尾气中CO、NO的转化率和化学反应速率,应选择的最佳措施是_______(填标号)。
。未达平衡前要同时提高汽车尾气中CO、NO的转化率和化学反应速率,应选择的最佳措施是_______(填标号)。| A.降低温度 | B.增大压强 | C.使用合适的催化剂 | D.降低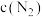 |
 )也可以利用惰性电极间接电解法进行处理,获得硝酸等化工原料,其原理如图所示:
)也可以利用惰性电极间接电解法进行处理,获得硝酸等化工原料,其原理如图所示:
①N极为电解池的
②写出气体吸收柱内吸收NO的离子方程式:
您最近一年使用:0次
【推荐3】碳及其含碳化合物在人们的生产生活中应用广泛。
(1)天然气是人们日常生活中的清洁能源。
已知①CH4(g)+2O2(g)=CO2(g)+2 H2O(l) △H1=-890.3kJ·mol-1
②2 CO(g)+O2(g)=2CO2(g) △H2=-566 kJ·mol-1
则反应2 CH4(g)+3O2(g)=2CO (g)+4H2O(l)的△H=_____________ 。
(2)甲烷燃料电池的化学方程式为CH4+2O2=CO2+2H2O。某甲烷燃料电池以甲烷为燃料,以空气为氧化剂,以熔融的K2CO3(其中不含O2-和HCO3—)为电解质,以具有催化作用和导电性能的稀土金属为电极。该燃料电池的负极电极反应式为:CH4-8e-+4CO32—=5CO2+2H2O,则其正极电极反应式为____________ ;为使电解质的组成保持稳定,使该燃料电池长时间稳定运行,在通入的空气中必须加入________________ 物质。
(3)以该燃料电池为电源,以铂作电极电解1000g 4.55%的NaOH溶液,一段时间后,溶液中溶质的质量分数变为5.00%,则阳极产生的气体在标准状况下的体积为_______ L。
(4)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
①实验A中以v(H2)表示的反应速率为___________________ 。
②通过计算可知,CO的转化率实验A_______________ 实验B(填“大于”、“等于”或“小于”),该反应的正反应为______________ 热反应(填“吸”或“放”)。
③若实验C要达到与实验B相同的平衡状态,则a、b应满足的关系是_________________ (用含a、b的数学式表示)。
(1)天然气是人们日常生活中的清洁能源。
已知①CH4(g)+2O2(g)=CO2(g)+2 H2O(l) △H1=-890.3kJ·mol-1
②2 CO(g)+O2(g)=2CO2(g) △H2=-566 kJ·mol-1
则反应2 CH4(g)+3O2(g)=2CO (g)+4H2O(l)的△H=
(2)甲烷燃料电池的化学方程式为CH4+2O2=CO2+2H2O。某甲烷燃料电池以甲烷为燃料,以空气为氧化剂,以熔融的K2CO3(其中不含O2-和HCO3—)为电解质,以具有催化作用和导电性能的稀土金属为电极。该燃料电池的负极电极反应式为:CH4-8e-+4CO32—=5CO2+2H2O,则其正极电极反应式为
(3)以该燃料电池为电源,以铂作电极电解1000g 4.55%的NaOH溶液,一段时间后,溶液中溶质的质量分数变为5.00%,则阳极产生的气体在标准状况下的体积为
(4)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)
 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO2 | CO | |||
| A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| C | 900 | a | b | c | d | t |
①实验A中以v(H2)表示的反应速率为
②通过计算可知,CO的转化率实验A
③若实验C要达到与实验B相同的平衡状态,则a、b应满足的关系是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验Ⅰ:将Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为_________________________________ 。
(2)某学生用对比实验法探究白色沉淀产生的原因,请填写实验万案:
查阅资料:
已知:①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为③___________________________________ 。
实验Ⅱ:将Fe2+转化为Fe3+
探究上述现象出现的原因:
查阅资料:Fe2++NO Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因___________________________________ 。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:反应Ⅰ:Fe2+与HNO3反应;反应Ⅱ:Fe2+与NO反应。请用化学平衡移动原理解释溶液由棕色变为黄色的原因_____________________________ 。
实验Ⅰ:将Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为
(2)某学生用对比实验法探究白色沉淀产生的原因,请填写实验万案:
实验方案 | 现象 | 结论 |
| 步骤1:取4mL① | 产生白色沉淀 | CuSO4溶液与KSCN溶液反应产生了白色沉淀 |
| 步骤2:取4mL② | 无明显现象 |
已知:①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为③
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
| 向3mL0.1mol/LFeSO4溶液中加入3mL0.5mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
查阅资料:Fe2++NO
 Fe(NO)2+(棕色)
Fe(NO)2+(棕色)(3)用离子方程式解释NO产生的原因
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:反应Ⅰ:Fe2+与HNO3反应;反应Ⅱ:Fe2+与NO反应。请用化学平衡移动原理解释溶液由棕色变为黄色的原因
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】以生物材质(以C计)与水蒸气反应制取H2是一种低耗能、高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及的反应有:
I.C(s)+H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
Ⅱ.CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
Ⅲ.CaO(s)+CO2(g) CaCO3(s)
CaCO3(s)
(1)对于反应I,不同温度和压强对H2产率影响如下表。
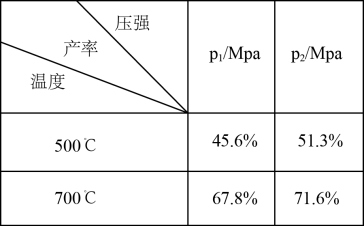
该反应是___________ (填“吸热”或“放热”)反应,p1___________ p2(填“>、<或=”);下列图像正确的是___________ 。
(2)在某恒容、绝热密闭容器中模拟上述气化炉制氢中的反应Ⅱ,下列能说明该反应达到平衡状态的是___________。
(3)对于反应Ⅲ,其他条件不变,平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡___________ 移动(填“向右”、“向左”或“不”);当重新平衡后,CO2浓度___________ (填“变大”、“变小”或“不变”),理由是___________ 。
I.C(s)+H2O(g)
 CO(g)+H2(g)
CO(g)+H2(g)Ⅱ.CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)Ⅲ.CaO(s)+CO2(g)
 CaCO3(s)
CaCO3(s)(1)对于反应I,不同温度和压强对H2产率影响如下表。

该反应是

(2)在某恒容、绝热密闭容器中模拟上述气化炉制氢中的反应Ⅱ,下列能说明该反应达到平衡状态的是___________。
| A.混合气体的温度不再变化 |
| B.H2O(g)、H2(g)的物质的量之比为1:1,且各质量不再变化 |
| C.混合气体的密度保持不变 |
| D.断裂amolH—H键的同时形成2amolH—O键 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式___ 。
(2)在2L恒容密闭容器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
①结合表中数据,判断该反应的ΔH___ 0(填“>”或“<”),理由是___ 。
②判断该反应达到平衡状态的依据是___ (填字母)。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)=v逆(N2)
(3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g) C(s)+2NO(g);其中N2、NO物质的量随时间变化的曲线如图所示。请回答下列问题。
C(s)+2NO(g);其中N2、NO物质的量随时间变化的曲线如图所示。请回答下列问题。
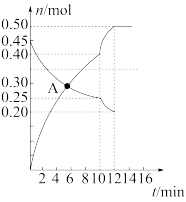
①图中A点v正___ v逆(填“>”“<”或“=”)。
②第10min时,外界改变的条件可能是___ (填字母)。
A.加催化剂 B.增大C的物质的量 C.减小CO2的物质的量 D.升温 E.降温
(4)采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。

容易得到的副产物有CO和CH2O,其中相对较多的副产物为___ ;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中___ (填字母)的能量变化。
A.*CO+*OH→*CO+*H2O B.*CO→*OCH
C.*OCH2→*OCH3 D.*OCH3→*CH3OH
 N2(g)+CO2(g)。
N2(g)+CO2(g)。(1)写出上述反应的平衡常数表达式
(2)在2L恒容密闭容器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
| 实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
| 1 | 700 | 0.40 | 0.09 |
| 2 | 800 | 0.24 | 0.08 |
②判断该反应达到平衡状态的依据是
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)=v逆(N2)
(3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)
 C(s)+2NO(g);其中N2、NO物质的量随时间变化的曲线如图所示。请回答下列问题。
C(s)+2NO(g);其中N2、NO物质的量随时间变化的曲线如图所示。请回答下列问题。
①图中A点v正
②第10min时,外界改变的条件可能是
A.加催化剂 B.增大C的物质的量 C.减小CO2的物质的量 D.升温 E.降温
(4)采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。

容易得到的副产物有CO和CH2O,其中相对较多的副产物为
A.*CO+*OH→*CO+*H2O B.*CO→*OCH
C.*OCH2→*OCH3 D.*OCH3→*CH3OH
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
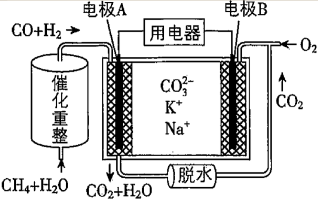
【推荐1】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题。
(1)CO2与CH4经催化重整制得合成气:CH4(g)+CO2(g) 2CO(g)+2H2(g)。已知上述反应中相关的化学键键能数据如下:
2CO(g)+2H2(g)。已知上述反应中相关的化学键键能数据如下:
则该反应的△H=__________ 。
(2)利用CO2可制取甲醇,其反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在恒温恒容密闭容器中,充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)。为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在恒温恒容密闭容器中,充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示。

从反应开始到达平衡这段时间, (H2)=
(H2)=___________ ;该温度下的化学平衡常数数值=__________ (保留三位有效数字)。
(3)一定条件下,将工业排放的CO2通过灼热焦炭层可以合成气体燃料CO,发生反应CO2(g)+C(s) 2CO(g),实验测知用不同物质表示的正、逆反应速率符合如下公式:
2CO(g),实验测知用不同物质表示的正、逆反应速率符合如下公式: 正(CO2)=k正·C(CO2),
正(CO2)=k正·C(CO2), 逆(CO)=k逆·C2(CO),则该反应的化学平衡常数K与k正、k逆之间的关系式为
逆(CO)=k逆·C2(CO),则该反应的化学平衡常数K与k正、k逆之间的关系式为_____________ 。
(4)工业上产生的CO2还可以用NaOH溶液捕获。常温下,如果实验测得捕获CO2后溶液中c(HCO ):c(CO
):c(CO )=2:1,则此时溶液的pH=
)=2:1,则此时溶液的pH=_______ (已知常温下,H2CO3的Ka1=4.0×10-7;Ka2=5.0×10-11)。
(5)一种和CO2相关的熔融碳酸盐燃料电池原理如图所示,则该电池的负极电极反应式为_____________ 。
(1)CO2与CH4经催化重整制得合成气:CH4(g)+CO2(g)
 2CO(g)+2H2(g)。已知上述反应中相关的化学键键能数据如下:
2CO(g)+2H2(g)。已知上述反应中相关的化学键键能数据如下:| 化学键 | C-H | C=O | H-H | C O(CO) O(CO) |
| 键能(kJ/mol) | 413 | 745 | 436 | 1075 |
则该反应的△H=
(2)利用CO2可制取甲醇,其反应为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在恒温恒容密闭容器中,充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)。为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在恒温恒容密闭容器中,充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
从反应开始到达平衡这段时间,
 (H2)=
(H2)=(3)一定条件下,将工业排放的CO2通过灼热焦炭层可以合成气体燃料CO,发生反应CO2(g)+C(s)
 2CO(g),实验测知用不同物质表示的正、逆反应速率符合如下公式:
2CO(g),实验测知用不同物质表示的正、逆反应速率符合如下公式: 正(CO2)=k正·C(CO2),
正(CO2)=k正·C(CO2), 逆(CO)=k逆·C2(CO),则该反应的化学平衡常数K与k正、k逆之间的关系式为
逆(CO)=k逆·C2(CO),则该反应的化学平衡常数K与k正、k逆之间的关系式为(4)工业上产生的CO2还可以用NaOH溶液捕获。常温下,如果实验测得捕获CO2后溶液中c(HCO
 ):c(CO
):c(CO )=2:1,则此时溶液的pH=
)=2:1,则此时溶液的pH=(5)一种和CO2相关的熔融碳酸盐燃料电池原理如图所示,则该电池的负极电极反应式为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】 既是一种重要的能源,也是一种重要的化工原料。
既是一种重要的能源,也是一种重要的化工原料。
(1)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时,要通入适量空气使部分甲烷燃烧,其目的是___________ 。已知25℃、101kPa时,1mol甲烷完全燃烧生成 和液态水时放出896kJ热量,则甲烷的热值为
和液态水时放出896kJ热量,则甲烷的热值为___________  。
。
(2)甲烷可以消除氮氧化物污染,写出甲烷与二氧化氮反应的化学方程式___________ 。
(3)甲烷可直接应用于燃料电池,该电池采用可传导 的固体氧化物为电解质,其工作原理如图所示:
的固体氧化物为电解质,其工作原理如图所示:

①b极电极反应式为___________ 。
②若燃料电池消耗的空气在标准状况下的体积是5.6L(假设空气中 体积分数为20%),则理论上消耗甲烷
体积分数为20%),则理论上消耗甲烷___________ mol。
 既是一种重要的能源,也是一种重要的化工原料。
既是一种重要的能源,也是一种重要的化工原料。(1)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时,要通入适量空气使部分甲烷燃烧,其目的是
 和液态水时放出896kJ热量,则甲烷的热值为
和液态水时放出896kJ热量,则甲烷的热值为 。
。(2)甲烷可以消除氮氧化物污染,写出甲烷与二氧化氮反应的化学方程式
(3)甲烷可直接应用于燃料电池,该电池采用可传导
 的固体氧化物为电解质,其工作原理如图所示:
的固体氧化物为电解质,其工作原理如图所示:
①b极电极反应式为
②若燃料电池消耗的空气在标准状况下的体积是5.6L(假设空气中
 体积分数为20%),则理论上消耗甲烷
体积分数为20%),则理论上消耗甲烷
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】氢能是发展中的新能源,它的利用包括氢的制备、保存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是______________ (至少答出两点)。但是氢气直接燃烧的能量及转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:_____________________________ 。
(2)氢气可用于制备H2O2。已知:H2(g)+A(l)=B(l) ΔH1O2(g)+B(l)=A(l)+H2O2(l) ΔH2,其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)=H2O2(l)的ΔH____ 0(填“>”、“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)=MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________ 。
a.容器内气体压强保持不变b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______ 。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH− FeO42−+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42−+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
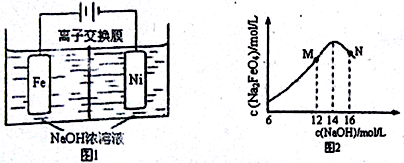
①电解一段时间后,c(OH-)降低的区域在_______ (填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是________________ 。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_______________________________________________ 。
(1)与汽油相比,氢气作为燃料的优点是
(2)氢气可用于制备H2O2。已知:H2(g)+A(l)=B(l) ΔH1O2(g)+B(l)=A(l)+H2O2(l) ΔH2,其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)=H2O2(l)的ΔH
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)=MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是
a.容器内气体压强保持不变b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH−
 FeO42−+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42−+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
①电解一段时间后,c(OH-)降低的区域在
②电解过程中,须将阴极产生的气体及时排出,其原因是
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】亚硝酰氯(ClNO)是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味、遇水反应生成一种氯化物和两种氮化物。某学习小组在实验空用Cl2和NO制备ClNO并测定其纯度,相关实验装置(夹持装置略去)如下图所示。请回答:

(1)制备C12发生装置可以选用____ (填写字母代号),请写出发生反应的离子方程式:____________ 。
(2)欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→_______ (按气流方向,用小写字母表示)。
(3)实验室可用下图装置制备亚硝酰氯(C1NO):

①实验室也可用B装置制备NO,X装置的优点为__________ 。
②检验装置气密性并装入药品,打开K2,然后再打开K1,通入一段时间气体,其目的为_______ ,然后进行其他操作,当Z有一定量液体生成时,停止实验。
③若无装置Y,则Z中C1NO可能发生反应的化学方程式为________ 。
(4)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol•L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。则亚硝酰氯(C1NO)的质量分数为______ (用代数式表示)。[已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(K2CrO4)=1×10-12]

(1)制备C12发生装置可以选用
(2)欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→
(3)实验室可用下图装置制备亚硝酰氯(C1NO):

①实验室也可用B装置制备NO,X装置的优点为
②检验装置气密性并装入药品,打开K2,然后再打开K1,通入一段时间气体,其目的为
③若无装置Y,则Z中C1NO可能发生反应的化学方程式为
(4)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol•L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。则亚硝酰氯(C1NO)的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】ClO2气体的氧化性与Cl2的氧化性相近,是安全、无毒的绿色消毒剂和保鲜剂。某兴趣小组对其制备、吸收、释放和应用进行了研究,如图。
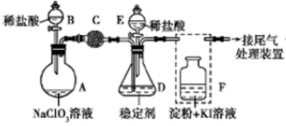
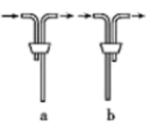
(1)安装F中导管时,应选用下图中的______ (填字母)。
(2)A装置用于制备ClO2,在制备过程中会生成Cl2,则发生反应的化学方程式为:_____ 。C装置的作用_____ ,ClO2在D中会被稳定剂完全吸收生成NaClO2,整个过程中,F溶液的颜色不变。
(3)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为____ 。设计实验证明NaClO2具有氧化性:______ (可供选择的试剂:稀HNO3、稀H2SO4、K2SO3溶液、BaCl2溶液、FeCl2溶液、KSCN溶液)。
(4)设计以下装置测ClO2的质量。如图所示:
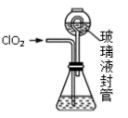
过程如下:
步骤1:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;
步骤2:按图组装好仪器;在玻璃液封管中加入步骤1配制的溶液,浸没导管口
步骤3:将生成的ClO2由导管通入锥形瓶的溶液中,充分吸收后,把玻璃液封管中的水封溶液倒入锥形瓶中,洗涤玻璃液封管2—3次,都倒入锥形瓶,再向锥形瓶中加入几滴淀粉溶液;
步骤4:用cmol•L−1Na2S2O3标准液滴定锥形瓶中的液体,共用去VmLNa2S2O3溶液(已知:I2+2 =2I−+
=2I−+ )。
)。
①装置中玻璃液封管的作用是_____ 。
②测得通入ClO2的质量m(ClO2)=_____ g(用整理过的含c、V的代数式表示)。

(1)安装F中导管时,应选用下图中的

(2)A装置用于制备ClO2,在制备过程中会生成Cl2,则发生反应的化学方程式为:
(3)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为
(4)设计以下装置测ClO2的质量。如图所示:

过程如下:
步骤1:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;
步骤2:按图组装好仪器;在玻璃液封管中加入步骤1配制的溶液,浸没导管口
步骤3:将生成的ClO2由导管通入锥形瓶的溶液中,充分吸收后,把玻璃液封管中的水封溶液倒入锥形瓶中,洗涤玻璃液封管2—3次,都倒入锥形瓶,再向锥形瓶中加入几滴淀粉溶液;
步骤4:用cmol•L−1Na2S2O3标准液滴定锥形瓶中的液体,共用去VmLNa2S2O3溶液(已知:I2+2
 =2I−+
=2I−+ )。
)。①装置中玻璃液封管的作用是
②测得通入ClO2的质量m(ClO2)=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】工业生产中,海水提取溴常用空气吹出法。某化学实验小组设计了如下实验装置(夹持装置略去)模拟该法从浓缩的海水中提取溴。
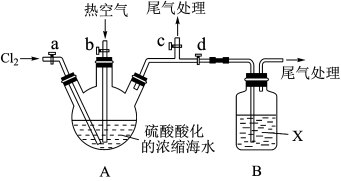
已知:Br2的沸点为58.78℃,密度为3.119g·cm-3,微溶于水,有毒。
(1)实验步骤如下:
①关闭活塞b,d,打开活塞a、c,向A中缓慢通入Cl2至反应结束;
②关闭活塞___________ ,打开活塞___________ ,向A中鼓入足量热空气;
③关闭活塞b,打开活塞a,再通过A向B中通入足量Cl2;
④取B中所得溶液进行蒸馏,收集液溴。
(2)步骤①A中主要反应的离子方程式为___________ 。
(3)X试剂可以是___________ (填序号),步骤②B中X试剂与Br2发生反应的离子方程式为___________ 。
a.H2O b.饱和食盐水 c.饱和Na2SO3溶液
(4)该实验中尾气处理所用的Y溶液可以为___________ 。配制200mL1.00mol·L-1Y溶液,需要的玻璃仪器有烧杯、玻璃棒___________ 、___________ 等。
(5)步骤④蒸馏操作中应控制温度为___________ 。

已知:Br2的沸点为58.78℃,密度为3.119g·cm-3,微溶于水,有毒。
(1)实验步骤如下:
①关闭活塞b,d,打开活塞a、c,向A中缓慢通入Cl2至反应结束;
②关闭活塞
③关闭活塞b,打开活塞a,再通过A向B中通入足量Cl2;
④取B中所得溶液进行蒸馏,收集液溴。
(2)步骤①A中主要反应的离子方程式为
(3)X试剂可以是
a.H2O b.饱和食盐水 c.饱和Na2SO3溶液
(4)该实验中尾气处理所用的Y溶液可以为
(5)步骤④蒸馏操作中应控制温度为
您最近一年使用:0次



