下列叙述中不正确的是(已知Ksp(AgCl)=4.0×10-10,Ksp(AgBr)=4.9×10-13,Ksp(Ag2CrO4)=2.0×10-12)
| A.0.lmol·L-1 NH4HS溶液中有:c(NH4+)+c(NH3·H2O)>c(HS-)+c(S2-) |
| B.将AgCl和AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,AgCl沉淀质量大于AgBr沉淀 |
| C.向浓度均为1×10-3mol/L的KCl和K2CrO4混合液中滴加1×10-3mol/LAgNO3溶液,CrO42-先形成沉淀 |
| D.常温下,pH=4.75、浓度均为0.l mol/L的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
19-20高三上·安徽·阶段练习 查看更多[2]
更新时间:2020-02-14 14:39:50
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】25℃时,往水中不断加入NaHC2O4 固体,部分微粒浓度随加入的c(HC2O4-)的变化趋势如下图所示。下列说法正确的是
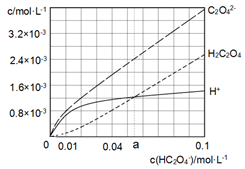

| A.当c(HC2O4-)=0.1mol/L时,c(H+)>c(C2O42-)-c(H2C2O4) |
| B.当c(HC2O4-)>amol/L时,c (H+) < c(H2C2O4),HC2O4-的水解程度大于电离程度 |
C.HC2O4- C2O42-+H+,Ka(HC2O4-) =a C2O42-+H+,Ka(HC2O4-) =a |
| D.将0.08mol/L H2C2O4溶液与等浓度NaOH溶液等体积混合后(忽略体积变化),c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)>c(H+)>c(OH-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】常温下,向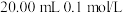 氨水中滴入
氨水中滴入 盐酸(忽略溶液混合过程中的体积变化),溶液中由水电离出的
盐酸(忽略溶液混合过程中的体积变化),溶液中由水电离出的 的负对数[
的负对数[ ]与所加盐酸体积的关系如图所示,下列说法不正确的是
]与所加盐酸体积的关系如图所示,下列说法不正确的是

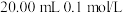 氨水中滴入
氨水中滴入 盐酸(忽略溶液混合过程中的体积变化),溶液中由水电离出的
盐酸(忽略溶液混合过程中的体积变化),溶液中由水电离出的 的负对数[
的负对数[ ]与所加盐酸体积的关系如图所示,下列说法不正确的是
]与所加盐酸体积的关系如图所示,下列说法不正确的是
A.常温下,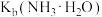 约为 约为 |
B.R、N、Q点都有: |
| C.R、Q两点对应溶液都是中性的 |
D.N点有: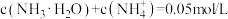 |
您最近一年使用:0次
单选题
|
适中
(0.65)
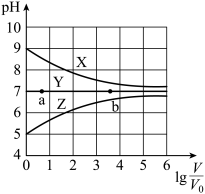
【推荐3】常温下,向等体积(V0mL)等浓度(0.1 mol .L-1)的盐MCl、NaR、MR溶液中分别加入蒸馏水,使其稀释VmL,稀释过程中,溶液的pH与lg 的关系如图所示。下列有关说法正确的是
的关系如图所示。下列有关说法正确的是
 的关系如图所示。下列有关说法正确的是
的关系如图所示。下列有关说法正确的是
| A.曲线X对应的盐为NaR,MCl为强酸强碱盐 |
| B.对于曲线Y,a点水的电离程度比b点小 |
| C.常温下,MOH的电离平衡常数Kb的数量级为10-3 |
| D.曲线Z上任何一点对应溶液中均存在c(H+) =c(OH-) +c( MOH) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】已知常温下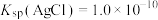 ,
, ,现有等体积的AgCl和AgI的饱和溶液的清液。下列说法错误的是
,现有等体积的AgCl和AgI的饱和溶液的清液。下列说法错误的是
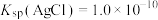 ,
, ,现有等体积的AgCl和AgI的饱和溶液的清液。下列说法错误的是
,现有等体积的AgCl和AgI的饱和溶液的清液。下列说法错误的是A.若向AgI清液加入 固体,则溶液中 固体,则溶液中 增大, 增大,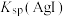 不变 不变 |
B.若将等体积的两饱和清液混合,向其中加入 溶液,当AgCl开始沉淀时,溶液中 溶液,当AgCl开始沉淀时,溶液中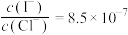 |
C.若向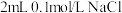 溶液中滴加2滴 溶液中滴加2滴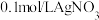 溶液,产生白色沉淀;再向其中滴加4滴 溶液,产生白色沉淀;再向其中滴加4滴 的KI溶液,有黄色沉淀产生,则可验证 的KI溶液,有黄色沉淀产生,则可验证 |
D.若将等体积的两饱和清液混合,再加入足量 固体,则AgCl和AgI都可沉淀,以AgI为主 固体,则AgCl和AgI都可沉淀,以AgI为主 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】已知25℃时FeS、CuS的Ksp分别为6.3×10-18、1.3×10-36,H2S的电离平衡常数Ka1=9.1×10-8、Ka2=1.1×10-12,下列有关说法正确的是( )
| A.除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
| B.将足量CuSO4固体溶解在0.1mol/L H2S溶液中,Cu2+的最大浓度为1.3×10-35mol/L |
| C.因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+ H2SO4不能发生 |
| D.向H2S的饱和溶液中通入少量SO2气体,溶液的酸性增强 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】常温下,取一定量的PbI2固体配成饱和溶液,t时刻改变某一条件,离子浓度变化如图所示。下列有关说法正确的是


A.常温下,Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液,反应PbI2(s)+S2-(aq) PbS(s)+2I-(aq)的化学平衡常数为5×1018 PbS(s)+2I-(aq)的化学平衡常数为5×1018 |
| B.常温下,PbI2的Ksp为2×10-6 |
| C.温度不变,t时刻改变的条件可能是向溶液中加入了KI固体,PbI2的Ksp增大 |
| D.温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,平衡向左移动,Pb2+的浓度减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】加沉淀剂使溶液中某种离子浓度低于 时,可认为该离子沉淀完全。25℃时,
时,可认为该离子沉淀完全。25℃时,
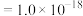 ,
,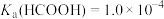 ,
,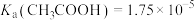 。室温下,下列说法正确的是
。室温下,下列说法正确的是
 时,可认为该离子沉淀完全。25℃时,
时,可认为该离子沉淀完全。25℃时,
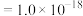 ,
,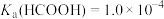 ,
,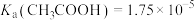 。室温下,下列说法正确的是
。室温下,下列说法正确的是A.等体积 的HCOOH、 的HCOOH、 溶液与足量Zn反应,HCOOH生成 溶液与足量Zn反应,HCOOH生成 多 多 |
B.欲使溶液中的 完全沉淀,应调节溶液的 完全沉淀,应调节溶液的 |
C.0.1mol/L的 溶液中 溶液中 |
D.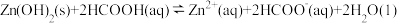 的平衡常数 的平衡常数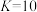 |
您最近一年使用:0次
【推荐1】下列根据实验操作和现象所得出的结论合理的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向0.1mol/L的硅酸钠溶液中滴加稀盐酸 | 产生白色胶状沉淀 | 非金属性:Cl>Si |
| B | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | 酸性:HA>HB |
| C | 向浓度均为0.1mol·L-1NaCl和NaI的混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 用导线将镁片和铝片相连后插入NaOH溶液中 | 铝片不断溶解,镁片上有气泡冒出 | 金属活动性:铝>镁 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.3×10-17,将AgCl与AgI的饱和溶液等体积混合,再向混合液中加入足量的浓硝酸银溶液,充分反应,下列说法正确的是( )
| A.混合液中只有AgI沉淀生成 |
| B.常温下,AgCl在NaCl溶液中的溶解度与在纯水中的溶解度相同 |
| C.混合液中生成AgCl沉淀物质的量多于AgI沉淀 |
| D.常温下,AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】下列实验操作、对应的现象以及结论都正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 氨水中滴加酚酞溶液 | 溶液变红 | NH3·H2O 是一元弱碱 |
| B | 向久置的Na2SO3 溶液中加入足量BaCl2溶液, 再加入足量稀盐酸 | 先产生白色沉淀,后部分沉淀溶解 | 部分Na2SO3 被氧化 |
| C | 向FeCl3溶液中加入NaHCO3 溶液 | 产生白色沉淀和气泡 | Fe3+和HCO3-发生双水解 |
| D | 将0.1mol/L ZnCl2溶液滴入Na2S溶液中至不再有沉淀产生,再滴加0.1mol/L CuSO4溶液 | 先产生白色沉淀,后生成黑色沉淀 | Ksp(ZnS )<Ksp(CuS) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次

 在酸性条件下氧化I-
在酸性条件下氧化I-

