依据题目要求回答下列问题。
(1)常温下,浓度均为0.1 mol/L的下列六种溶液的pH如表所示。
①上述盐溶液中的阴离子结合H+能力最强的是________ 。
②根据表中数据,浓度均为0.01 mol/L的下列五种物质的溶液中,酸性最强的是________ (填字母编号,下同);将各溶液分别稀释100倍,pH变化最小的是________ 。
a. HCN b.HClO c. C6H5OH d. CH3COOH e. H2CO3
③下列关于NaHCO3饱和溶液的表述,正确的是________
A. c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B. c(Na+)+c(H+)=c(HCO3-)+c(OH-)
C.HCO3-的电离程度大于HCO3-的水解程度
④根据上表数据,请你判断下列反应不能成立的是________ 。
a. CH3COOH+Na2CO3=NaHCO3+CH3COONa
b. CH3COOH+NaCN=CH3COONa+HCN
c. CO2+H2O+NaClO=NaHCO3+HClO
d. CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
⑤要增大氯水中 的浓度,可向氯水中加入少量的碳酸氢钠溶液,写出Cl2与HCO3-反应的离子方程式为
的浓度,可向氯水中加入少量的碳酸氢钠溶液,写出Cl2与HCO3-反应的离子方程式为________ 。
(2)依据表中数据计算CH3COOH的电离常数Ka=________ (已知100.4=2.5,用科学记数法表示)
(1)常温下,浓度均为0.1 mol/L的下列六种溶液的pH如表所示。
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
①上述盐溶液中的阴离子结合H+能力最强的是
②根据表中数据,浓度均为0.01 mol/L的下列五种物质的溶液中,酸性最强的是
a. HCN b.HClO c. C6H5OH d. CH3COOH e. H2CO3
③下列关于NaHCO3饱和溶液的表述,正确的是
A. c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B. c(Na+)+c(H+)=c(HCO3-)+c(OH-)
C.HCO3-的电离程度大于HCO3-的水解程度
④根据上表数据,请你判断下列反应不能成立的是
a. CH3COOH+Na2CO3=NaHCO3+CH3COONa
b. CH3COOH+NaCN=CH3COONa+HCN
c. CO2+H2O+NaClO=NaHCO3+HClO
d. CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
⑤要增大氯水中
 的浓度,可向氯水中加入少量的碳酸氢钠溶液,写出Cl2与HCO3-反应的离子方程式为
的浓度,可向氯水中加入少量的碳酸氢钠溶液,写出Cl2与HCO3-反应的离子方程式为(2)依据表中数据计算CH3COOH的电离常数Ka=
更新时间:2020-02-21 14:07:42
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】实验测得
 溶液、
溶液、
 溶液以及
溶液以及 的pH随温度变化的曲线如图所示。回答下列问题:
的pH随温度变化的曲线如图所示。回答下列问题:

(1)30℃时 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为_______ ;
(2)40℃时 溶液中物料守恒的表达式为
溶液中物料守恒的表达式为_______ ;
(3)50℃时a、b、c三点对应试剂中 与
与 乘积的大小关系是
乘积的大小关系是_______ ;
(4)随温度升高, 溶液的
溶液的
_______ (填“增大”或“减小”)。

 溶液、
溶液、
 溶液以及
溶液以及 的pH随温度变化的曲线如图所示。回答下列问题:
的pH随温度变化的曲线如图所示。回答下列问题:
(1)30℃时
 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为(2)40℃时
 溶液中物料守恒的表达式为
溶液中物料守恒的表达式为(3)50℃时a、b、c三点对应试剂中
 与
与 乘积的大小关系是
乘积的大小关系是(4)随温度升高,
 溶液的
溶液的
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】硫化氢 有臭鸡蛋气味,能溶于水。研究发现,
有臭鸡蛋气味,能溶于水。研究发现, 具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1) 与
与 在高温条件下发生反应:
在高温条件下发生反应: 。在610K时,将
。在610K时,将 与
与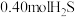 充入2.5L的空钢瓶中,反应平衡后测得水的物质的量分数为2%。
充入2.5L的空钢瓶中,反应平衡后测得水的物质的量分数为2%。
① 的平衡转化率
的平衡转化率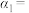
___________ %,反应平衡常数
___________ (保留两位有效数字)。
②在620K下重复试验,平衡后水的物质的量分数为3%, 的转化率
的转化率
___________  ,该反应的
,该反应的
___________ 0(填“>”“<”“=”,上同)。
③向反应器中再分别充入下列气体,能使 转化率增大的是
转化率增大的是___________ (填序号)。
A. B.
B. C.
C. D.
D.
(2)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
煤的气化过程中产生的 可用足量的
可用足量的 溶液吸收,该反应的离子方程式为
溶液吸收,该反应的离子方程式为___________ 。
(3)常温下,在某酸性溶液中通入 至饱和时,测得
至饱和时,测得 ,硫化氢的平衡浓度为
,硫化氢的平衡浓度为 ,计算此时溶液中
,计算此时溶液中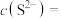
___________  (保留两位有效数字)。
(保留两位有效数字)。
 有臭鸡蛋气味,能溶于水。研究发现,
有臭鸡蛋气味,能溶于水。研究发现, 具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:(1)
 与
与 在高温条件下发生反应:
在高温条件下发生反应: 。在610K时,将
。在610K时,将 与
与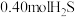 充入2.5L的空钢瓶中,反应平衡后测得水的物质的量分数为2%。
充入2.5L的空钢瓶中,反应平衡后测得水的物质的量分数为2%。①
 的平衡转化率
的平衡转化率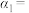

②在620K下重复试验,平衡后水的物质的量分数为3%,
 的转化率
的转化率
 ,该反应的
,该反应的
③向反应器中再分别充入下列气体,能使
 转化率增大的是
转化率增大的是A.
 B.
B. C.
C. D.
D.
(2)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
| 电离平衡常数 |  |  |
 |  | 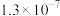 |
 | 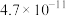 |  |
 可用足量的
可用足量的 溶液吸收,该反应的离子方程式为
溶液吸收,该反应的离子方程式为(3)常温下,在某酸性溶液中通入
 至饱和时,测得
至饱和时,测得 ,硫化氢的平衡浓度为
,硫化氢的平衡浓度为 ,计算此时溶液中
,计算此时溶液中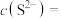
 (保留两位有效数字)。
(保留两位有效数字)。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】常温下,浓度均为0.1mol·L-1的五种溶液的pH如下表:
(1)NaOH溶液中,水电离出的c(OH-)为_______ 。
(2)将 NaClO溶液和Na2CO3溶液等体积混合,各离子浓度关系正确的是____ (填标号)
a. c(ClO-)>c(CO )>c(H+)
)>c(H+)
b. c(Na+)=3[c(HClO)+c(ClO-)]
c. c(H+)=2c(CO )+c(HCO
)+c(HCO )+ c(HClO)
)+ c(HClO)
d. c(HClO)+c(ClO-)=c(H2CO3)+ c(HCO )
)
(3)H2CO3、HClO中,酸性更弱的是_______ 。若向NaClO溶液中通入少量CO2,反应的化学方程式为_______ 。
(4)将SO2通入0.1 mol·L-1Na2SO3溶液中至溶液呈中性,溶液中2c(SO )+c(HSO
)+c(HSO )=
)= _______ (忽略溶液体积的变化)
(5)将上述5种溶液稀释100倍时,pH变化最大的是_______ 溶液。
(6)为探究 NaHCO3溶液的pH随温度的变化情况,实验测绘0.1mol ·L- 1NaHCO3溶液的温度—pH变化情况如图所示。

①45℃前温度升高 NaHCO3溶液pH减小的原因可能是_______ (写一条)。
②加热溶液至45℃附近时,溶液pH陡然增大,说明生成了新的物质,写出该新物质水溶液显碱性的离子方程式_______ 。
溶质 | NaHCO3 | Na2CO3 | Na2SO3 | NaClO | NaOH |
pH | 9.7 | 11.6 | 9.8 | 10.3 | 13 |
(1)NaOH溶液中,水电离出的c(OH-)为
(2)将 NaClO溶液和Na2CO3溶液等体积混合,各离子浓度关系正确的是
a. c(ClO-)>c(CO
 )>c(H+)
)>c(H+)b. c(Na+)=3[c(HClO)+c(ClO-)]
c. c(H+)=2c(CO
 )+c(HCO
)+c(HCO )+ c(HClO)
)+ c(HClO) d. c(HClO)+c(ClO-)=c(H2CO3)+ c(HCO
 )
) (3)H2CO3、HClO中,酸性更弱的是
(4)将SO2通入0.1 mol·L-1Na2SO3溶液中至溶液呈中性,溶液中2c(SO
 )+c(HSO
)+c(HSO )=
)= (5)将上述5种溶液稀释100倍时,pH变化最大的是
(6)为探究 NaHCO3溶液的pH随温度的变化情况,实验测绘0.1mol ·L- 1NaHCO3溶液的温度—pH变化情况如图所示。

①45℃前温度升高 NaHCO3溶液pH减小的原因可能是
②加热溶液至45℃附近时,溶液pH陡然增大,说明生成了新的物质,写出该新物质水溶液显碱性的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】回答下列问题:
(1)已知:H2S:Ka1=1.3×10-7 Ka2=7.1×10-15 H2CO3:Ka1=4.3×10-7 Ka2=5.6×10-11 CH3COOH:Ka=1.8×10-5 NH3·H2O:Kb=1.8×10-5
①常温下,0.1mol·L-1Na2S溶液和0.1mol·L-1Na2CO3溶液,碱性更强的是______ ,其原因是_______ 。
②25℃时,CH3COONH4溶液显______ 性。NaHCO3溶液的pH______ (填“大于”或“小于”)CH3COONa溶液的pH。
③NH4HCO3溶液显______ 性,原因是_______ 。
(2)25 ℃时,H2SO3⇌HSO +H+的电离常数Ka=1.0×10-2,则该温度下NaHSO3的水解常数Kh=
+H+的电离常数Ka=1.0×10-2,则该温度下NaHSO3的水解常数Kh=___ ;若向NaHSO3溶液中加入少量的I2,则溶液中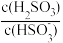 将
将______ (填“增大”“减小”或“不变”)。
(3)能证明Na2SO3溶液中存在SO +H2O⇌HSO
+H2O⇌HSO +OH-水解平衡的事实是
+OH-水解平衡的事实是_____ (填字母,下同)。
A.滴入酚酞溶液变红,再加H2SO4溶液红色褪去
B.滴入酚酞溶液变红,再加BaCl2溶液后产生沉淀且红色褪去
C.滴入酚酞溶液变红,再加氯水后红色褪去
(4)已知:Ka(HClO2)=1.1×10-2,Ka(CH3COOH)=1.8×10-5。25℃时,浓度均为0.1mol·L-1的NaClO2溶液和CH3COONa溶液,两溶液中c(ClO )
)______ (填“>”“<”或“=”)c(CH3COO-)。若要使两溶液的pH相等应________ 。
a.向NaClO2溶液中加适量水
b.向NaClO2溶液中加适量NaOH
c.向CH3COONa溶液中加CH3COONa固体
d.向CH3COONa溶液中加适量的水
(5)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是_______ (用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是________ 。
(1)已知:H2S:Ka1=1.3×10-7 Ka2=7.1×10-15 H2CO3:Ka1=4.3×10-7 Ka2=5.6×10-11 CH3COOH:Ka=1.8×10-5 NH3·H2O:Kb=1.8×10-5
①常温下,0.1mol·L-1Na2S溶液和0.1mol·L-1Na2CO3溶液,碱性更强的是
②25℃时,CH3COONH4溶液显
③NH4HCO3溶液显
(2)25 ℃时,H2SO3⇌HSO
 +H+的电离常数Ka=1.0×10-2,则该温度下NaHSO3的水解常数Kh=
+H+的电离常数Ka=1.0×10-2,则该温度下NaHSO3的水解常数Kh=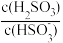 将
将(3)能证明Na2SO3溶液中存在SO
 +H2O⇌HSO
+H2O⇌HSO +OH-水解平衡的事实是
+OH-水解平衡的事实是A.滴入酚酞溶液变红,再加H2SO4溶液红色褪去
B.滴入酚酞溶液变红,再加BaCl2溶液后产生沉淀且红色褪去
C.滴入酚酞溶液变红,再加氯水后红色褪去
(4)已知:Ka(HClO2)=1.1×10-2,Ka(CH3COOH)=1.8×10-5。25℃时,浓度均为0.1mol·L-1的NaClO2溶液和CH3COONa溶液,两溶液中c(ClO
 )
)a.向NaClO2溶液中加适量水
b.向NaClO2溶液中加适量NaOH
c.向CH3COONa溶液中加CH3COONa固体
d.向CH3COONa溶液中加适量的水
(5)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
①0.1 mol/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______ c(HCO3 -)(填“>”、“<”或“=”)。②常温下,pH相同的三种溶液A.CH3COONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是________ (填编号)。
③已知25℃时,CH3COOH(aq)+OH -( aq)=CH3COO-(aq) +H2O(1) △H=-akJ/mol,H+(aq) +OH-(aq) =H2O(1) △H=-b kJ/mol,醋酸电离的热化学方程式为________________________________________ 。
④将少量CO2通入NaCN溶液,反应的离子方程式是______________________________ 。
⑤室温下,—定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是________________ ,溶液中c(CH3COO—)/c(CH3COOH)___________ 。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示。
①d点所示的溶液中离子浓度由大到小的顺序依次为_______________ 。
②b点所示的溶液中c(NH3·H2O)-c(NH4+)=__________ (用溶液中的其它离子浓度表示)。
③pH =10的氨水与pH =4的NH4C1溶液中,由水电离出的c(H+)之比为____ 。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka = 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
③已知25℃时,CH3COOH(aq)+OH -( aq)=CH3COO-(aq) +H2O(1) △H=-akJ/mol,H+(aq) +OH-(aq) =H2O(1) △H=-b kJ/mol,醋酸电离的热化学方程式为
④将少量CO2通入NaCN溶液,反应的离子方程式是
⑤室温下,—定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示。
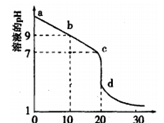
①d点所示的溶液中离子浓度由大到小的顺序依次为
②b点所示的溶液中c(NH3·H2O)-c(NH4+)=
③pH =10的氨水与pH =4的NH4C1溶液中,由水电离出的c(H+)之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】根据信息回答下列问题:
Ⅰ.(1)25℃时,将0.02 mol/L 的Ba(OH)2溶液与物质的量浓度相同的NaHSO4溶液等体积混合,所得的溶液的pH=_______ 。
(2)25 ℃时,有0.1mol·L-1的四种溶液:① HCl ② Na2CO3 ③ CH3COOH ④NaOH。上述四种溶液中,其中水的电离程度最大的是_______ ( 填序号,下同,),溶液的pH值由大到小的顺序是_______ 。
(3)向碳酸钠溶液中加入明矾会产生沉淀和气体,反应的离子方程式为:_______ 。
(4) 25 ℃某浓度的NaHCO3溶液的pH=9,则此时溶液中c(CO ):c(HCO
):c(HCO )=
)=_______ 。(已知H2CO3的电离常数:K1=4.4×10-7 ,K2=4.7×10-11.)
Ⅱ.(5)食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于0.035g/mL。选择酚酞作指示剂,用标准NaOH溶液可以测定食醋中醋酸的浓度,以检测白醋是否符合国家标准。某品牌白醋的醋酸浓度测定过程如图所示,回答下列问题:
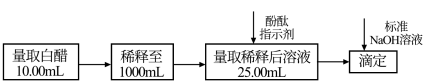
①滴定达到终点时的现象是_______ 。
②某次实验滴定开始和结束时,碱式滴定管中的液面如图所示,则所用NaOH溶液的体积为_______ mL。
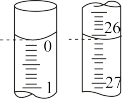
③若通过实验测得稀释后白醋的浓度为0.0600mol·L-1,则该白醋_______ (填“符合”或“不符合”)国家标准。
④下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是_______ (填编号)。
A.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定过程中振荡时有液滴溅出
D.读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数
E.碱式滴定管在滴定前有气泡,滴定后气泡消失
Ⅰ.(1)25℃时,将0.02 mol/L 的Ba(OH)2溶液与物质的量浓度相同的NaHSO4溶液等体积混合,所得的溶液的pH=
(2)25 ℃时,有0.1mol·L-1的四种溶液:① HCl ② Na2CO3 ③ CH3COOH ④NaOH。上述四种溶液中,其中水的电离程度最大的是
(3)向碳酸钠溶液中加入明矾会产生沉淀和气体,反应的离子方程式为:
(4) 25 ℃某浓度的NaHCO3溶液的pH=9,则此时溶液中c(CO
 ):c(HCO
):c(HCO )=
)=Ⅱ.(5)食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于0.035g/mL。选择酚酞作指示剂,用标准NaOH溶液可以测定食醋中醋酸的浓度,以检测白醋是否符合国家标准。某品牌白醋的醋酸浓度测定过程如图所示,回答下列问题:

①滴定达到终点时的现象是
②某次实验滴定开始和结束时,碱式滴定管中的液面如图所示,则所用NaOH溶液的体积为

③若通过实验测得稀释后白醋的浓度为0.0600mol·L-1,则该白醋
④下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是
A.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定过程中振荡时有液滴溅出
D.读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数
E.碱式滴定管在滴定前有气泡,滴定后气泡消失
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】(1)一定温度下,有a.盐酸;b.硫酸;c.醋酸三种酸,用字母填写下列空格:
①当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是_____________________ 。
②若三者c(H+)相同时,物质的量浓度由大到小的顺序是______________________ 。
(2)常温下,0.1 mol·L-1的HCl溶液中,由水电离出来的H+浓度为______ mol·L-1。
(3)在一元强碱MOH溶液中加入一元酸HA溶液,充分反应后,溶液呈中性。甲同学认为溶液中c(A-)=c(M+),而乙同学认为c(A-)和c(M+)是否相等,要看一元酸HA是强酸还是弱酸。你认为__________ 同学的说法正确,理由是______________________ 。
(4)明矾[KAl(SO4)2·12H2O]常用作净水剂,其原理是________ (用离子方程式表示)。
(5)将FeCl3溶液蒸干并灼烧,最终得到的固体物质是______________________ (填写化学式)。
①当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是
②若三者c(H+)相同时,物质的量浓度由大到小的顺序是
(2)常温下,0.1 mol·L-1的HCl溶液中,由水电离出来的H+浓度为
(3)在一元强碱MOH溶液中加入一元酸HA溶液,充分反应后,溶液呈中性。甲同学认为溶液中c(A-)=c(M+),而乙同学认为c(A-)和c(M+)是否相等,要看一元酸HA是强酸还是弱酸。你认为
(4)明矾[KAl(SO4)2·12H2O]常用作净水剂,其原理是
(5)将FeCl3溶液蒸干并灼烧,最终得到的固体物质是

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】已知某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。
②c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
③c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
④c(CH3COO-)>c(Na+)>c(OH-) >c(H+)
(1)若溶液中只溶解了一种溶质,则该溶质是________ ,上述四种离子浓度的大小顺序为_______ (填编号)。
(2)若上述关系中③是正确的,则溶液中的溶质为_________ 。
(3)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好呈中性,则混合前两溶液的物质的量浓度大小关系为c(NaOH)_______ c(CH3COOH)(填“大于”、“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系是c(H+)_____ c(OH-)。
①c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。
②c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
③c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
④c(CH3COO-)>c(Na+)>c(OH-) >c(H+)
(1)若溶液中只溶解了一种溶质,则该溶质是
(2)若上述关系中③是正确的,则溶液中的溶质为
(3)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好呈中性,则混合前两溶液的物质的量浓度大小关系为c(NaOH)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】亚砷酸(H3AsO3)可用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH的关系如图所示。

回答下列问题:
(1)人体血液的pH在7.35~7.45之间,用药后人体中含砷元素的主要微粒是___________ 。
(2)将KOH溶液滴入亚砷酸溶液中,当pH调至9时发生反应的离子方程式为___________ 。
(3)下列说法错误的是___________ 。(填序号)
A.n(H3AsO3)∶n(H2AsO )=1∶1时,溶液显碱性
)=1∶1时,溶液显碱性
B.H3AsO3溶液中:c(H2AsO )+2c(HAsO
)+2c(HAsO )+3c(AsO
)+3c(AsO )+c(OH-)=c(H+)
)+c(OH-)=c(H+)
C.K3AsO3溶液中:c((AsO )>c(HAsO
)>c(HAsO )>c(H2AsO
)>c(H2AsO )>c(H3AsO3)
)>c(H3AsO3)
D.H3AsO3的电离平衡常数Ka1∶Ka2 =10b+a
(4)P和As位于同主族元素,存在亚磷酸(H3PO3),常温下,0.10 mol·L-1H3PO3溶液的pH=1.6,该酸与足量NaOH溶液反应生成Na2HPO3。
①Na2HPO3为___________ (填“正盐”或“酸式盐”);常温下Na2HPO3溶液的pH___________ 7(填“>”“<”或“=”)。
②亚磷酸可由PCl3完全水解制取,反应的化学方程式为___________ 。

回答下列问题:
(1)人体血液的pH在7.35~7.45之间,用药后人体中含砷元素的主要微粒是
(2)将KOH溶液滴入亚砷酸溶液中,当pH调至9时发生反应的离子方程式为
(3)下列说法错误的是
A.n(H3AsO3)∶n(H2AsO
 )=1∶1时,溶液显碱性
)=1∶1时,溶液显碱性B.H3AsO3溶液中:c(H2AsO
 )+2c(HAsO
)+2c(HAsO )+3c(AsO
)+3c(AsO )+c(OH-)=c(H+)
)+c(OH-)=c(H+)C.K3AsO3溶液中:c((AsO
 )>c(HAsO
)>c(HAsO )>c(H2AsO
)>c(H2AsO )>c(H3AsO3)
)>c(H3AsO3)D.H3AsO3的电离平衡常数Ka1∶Ka2 =10b+a
(4)P和As位于同主族元素,存在亚磷酸(H3PO3),常温下,0.10 mol·L-1H3PO3溶液的pH=1.6,该酸与足量NaOH溶液反应生成Na2HPO3。
①Na2HPO3为
②亚磷酸可由PCl3完全水解制取,反应的化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】按要求答题:
(1)金属焊接时可用NH4Cl溶液作除锈剂的原因(用离子方程式回答)_____________________________ 。
(2)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=_____________ mol·L-1(填精确值)。
(3)常温下,将pH=a的NaOH溶液与pH=b的醋酸溶液等体积混合后,两者恰好完全反应,则该温度下醋酸的电离平衡常数约为_______________________ (用含代数a、b等表示)。
(4)常温,PH=5 的H2SO4溶液加水稀释至原溶液体积的1000倍,求稀释后溶液中c(H+):c(SO42-)=________
(5)已知:H2CO3的电离平衡常数 K1=4.4×10-7 ; K2=4.7×10-11,HClO的电离平衡常数K=3.0×10-8,则将少量CO2气体通入NaClO溶液中的离子方程式____________________
(6)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为_____________________
(1)金属焊接时可用NH4Cl溶液作除锈剂的原因(用离子方程式回答)
(2)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=
(3)常温下,将pH=a的NaOH溶液与pH=b的醋酸溶液等体积混合后,两者恰好完全反应,则该温度下醋酸的电离平衡常数约为
(4)常温,PH=5 的H2SO4溶液加水稀释至原溶液体积的1000倍,求稀释后溶液中c(H+):c(SO42-)=
(5)已知:H2CO3的电离平衡常数 K1=4.4×10-7 ; K2=4.7×10-11,HClO的电离平衡常数K=3.0×10-8,则将少量CO2气体通入NaClO溶液中的离子方程式
(6)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】研究电解质在水溶液中的平衡能了解它的存在形式。已知25℃时部分弱酸的电离平衡常数如下表:
(1)NaCN溶液呈碱性的原因是______ (用离子方程式表示)。向NaCN溶液中通入少量的CO2发生的离子反应为______ 。
(2)常温下,KHC2O4水解平衡常数的数值为______ 。
(3)根据以上数据,判断下列反应可以成立的是______ 。
A.HCOOH+Na2CO3=NaHCO3+HCOONa
B.HCOOH+NaHC2O4=HCOONa+H2C2O4
C.H2C2O4+2NaCN=Na2C2O4+2HCN
D.NaHCO3+HCN=NaCN+H2O+CO2↑
(4)25℃时,pH=3的HCOOH溶液与pH=3的NH4Cl溶液中由水电离出的c(H+)之比为______ 。
(5)25℃时,等体积、等物质的量浓度的HCOOH和HCOONa的混合溶液pH<7,则溶液中①H+;②Na+;③HCOO-;④OH-的物质的量浓度由大到小的顺序依次为______ (填序号)。
| 弱酸 | HCOOH | HCN | H2CO3 | H2C2O4 |
| 电离平衡常数 | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=5.0×10-2 Ka2=5.4×10-5 |
(1)NaCN溶液呈碱性的原因是
(2)常温下,KHC2O4水解平衡常数的数值为
(3)根据以上数据,判断下列反应可以成立的是
A.HCOOH+Na2CO3=NaHCO3+HCOONa
B.HCOOH+NaHC2O4=HCOONa+H2C2O4
C.H2C2O4+2NaCN=Na2C2O4+2HCN
D.NaHCO3+HCN=NaCN+H2O+CO2↑
(4)25℃时,pH=3的HCOOH溶液与pH=3的NH4Cl溶液中由水电离出的c(H+)之比为
(5)25℃时,等体积、等物质的量浓度的HCOOH和HCOONa的混合溶液pH<7,则溶液中①H+;②Na+;③HCOO-;④OH-的物质的量浓度由大到小的顺序依次为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】完成下列问题
(1) 可用氨水吸收生成
可用氨水吸收生成 。
。 时,将
时,将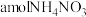 溶于水,溶液呈酸性,原因是
溶于水,溶液呈酸性,原因是_______ (用离子方程式表示)。
向该溶液中滴加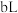 氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将
氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将_______ (填“正向”“不”或“逆向”)移动,所滴加氨水的浓度_______  (
( 的电离平衡常数取
的电离平衡常数取 )。
)。
(2)向氨水中加入 稀硫酸至溶液正好呈中性,则
稀硫酸至溶液正好呈中性,则
_______ (填“>”“<”或“=”) ,此时混合溶液中
,此时混合溶液中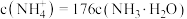 ,则
,则 的电离常数
的电离常数 为
为_______ 。
(3)向 的氨水中加入
的氨水中加入 的
的 溶液,通过计算说明是否会生成沉淀[已知
溶液,通过计算说明是否会生成沉淀[已知 的
的 ,氨水中
,氨水中 ]。
]。_______
(1)
 可用氨水吸收生成
可用氨水吸收生成 。
。 时,将
时,将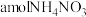 溶于水,溶液呈酸性,原因是
溶于水,溶液呈酸性,原因是向该溶液中滴加
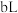 氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将
氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将 (
( 的电离平衡常数取
的电离平衡常数取 )。
)。(2)向氨水中加入
 稀硫酸至溶液正好呈中性,则
稀硫酸至溶液正好呈中性,则
 ,此时混合溶液中
,此时混合溶液中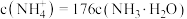 ,则
,则 的电离常数
的电离常数 为
为(3)向
 的氨水中加入
的氨水中加入 的
的 溶液,通过计算说明是否会生成沉淀[已知
溶液,通过计算说明是否会生成沉淀[已知 的
的 ,氨水中
,氨水中 ]。
]。
您最近一年使用:0次



