已知如表数据。
(1)25℃时,pH=11的NaCN溶液中水电离出的c(OH-)=_____ mol•L-1。
(2)25℃时,等浓度的NaCN、Na2CO3溶液、CH3COONa三种溶液的pH值由大到小的顺序为_____ 。
(3)0.100mol•L-1NH4HCO3溶液中物质的量浓度最大的离子是_____ (填化学式)。
(4)向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_____ 。
(5)25℃1.10mol•L-1CH3COOH溶液中,CH3COOH的电离度约为_____ 。
(6)25℃时等体积等浓度的NaCl与NaCN两溶液中,离子总数NaCl_____ NaCN(填“大于”、“小于”或“等于”);
(7)HCN与NaOH反应后的溶液中存在:c(Na+)=c(CN-),该溶液呈_____ 性(填“酸”“碱”或“中”)。
| 化学式 | 电离平衡常数(25℃) |
| HCN | Ka=4.93×10-10 |
| CH3COOH | Ka=1.76×10-5 |
| H2CO3 | Ka1=4.30×10-7  Ka2=5.61×10-11 Ka2=5.61×10-11 |
| NH3·H2O | Kb=1.77×10-5 |
(2)25℃时,等浓度的NaCN、Na2CO3溶液、CH3COONa三种溶液的pH值由大到小的顺序为
(3)0.100mol•L-1NH4HCO3溶液中物质的量浓度最大的离子是
(4)向NaCN溶液中通入少量CO2,所发生反应的化学方程式为
(5)25℃1.10mol•L-1CH3COOH溶液中,CH3COOH的电离度约为
(6)25℃时等体积等浓度的NaCl与NaCN两溶液中,离子总数NaCl
(7)HCN与NaOH反应后的溶液中存在:c(Na+)=c(CN-),该溶液呈
更新时间:2020-02-21 10:49:30
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】盐类的水解在生产生活中应用广泛
(1) 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比
具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比 高效,且腐蚀性小。
高效,且腐蚀性小。 在溶液中分三步水解,请回答下列问题:
在溶液中分三步水解,请回答下列问题:






①以上水解反应的平衡常数 、
、 、
、 由大到小的顺序是
由大到小的顺序是_______ 。
②通过控制条件,以上水解产物聚合,生成聚合氯化铁,离子方程式为xFe3++yH2O⇌Fe (OH)
(OH) 。欲使平衡正向移动可采用的方法是
。欲使平衡正向移动可采用的方法是_______ (填标号)。
a.降温 b.加水稀释 c.加入 d.加入
d.加入
③室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是_______ 。
(2)现有常温下的0.1mol/L纯碱溶液。
①你认为该溶液呈碱性的原因是(用离子方程式表示)_______ 。为证明你的上述观点 ,请设计实验,简述实验操作,现象和结论:_______ 。
②同学甲认为该溶液中 的水解是微弱的,发生水解的
的水解是微弱的,发生水解的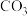 不超过其总量的10%,请你设计实验证明该同学的观点是否正确(忽略
不超过其总量的10%,请你设计实验证明该同学的观点是否正确(忽略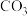 的第二步水解):
的第二步水解):_______ 。
(1)
 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比
具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比 高效,且腐蚀性小。
高效,且腐蚀性小。 在溶液中分三步水解,请回答下列问题:
在溶液中分三步水解,请回答下列问题:





①以上水解反应的平衡常数
 、
、 、
、 由大到小的顺序是
由大到小的顺序是②通过控制条件,以上水解产物聚合,生成聚合氯化铁,离子方程式为xFe3++yH2O⇌Fe
 (OH)
(OH) 。欲使平衡正向移动可采用的方法是
。欲使平衡正向移动可采用的方法是a.降温 b.加水稀释 c.加入
 d.加入
d.加入
③室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是
(2)现有常温下的0.1mol/L纯碱溶液。
①你认为该溶液呈碱性的原因是(用离子方程式表示)
②同学甲认为该溶液中
 的水解是微弱的,发生水解的
的水解是微弱的,发生水解的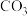 不超过其总量的10%,请你设计实验证明该同学的观点是否正确(忽略
不超过其总量的10%,请你设计实验证明该同学的观点是否正确(忽略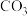 的第二步水解):
的第二步水解):
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】已知常温下部分弱电解质的电离平衡常数如下表:
(1)写出醋酸电离平衡常数表达式___________ 。
(2) 时,将
时,将 的醋酸与
的醋酸与 氢氧化钠等体积混合,写出反应的离子方程式
氢氧化钠等体积混合,写出反应的离子方程式___________ ;反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为___________ 。
(3)常温下, 相同的三种溶液a.
相同的三种溶液a. 溶液;b.
溶液;b. 溶液;c.
溶液;c. 溶液,其物质的量浓度由大到小的顺序是
溶液,其物质的量浓度由大到小的顺序是___________ (填序号)。
(4)已知在常温时,将浓度相等的 与
与 溶液等体积混合,溶液呈酸性。根据表格数据
溶液等体积混合,溶液呈酸性。根据表格数据 水解平衡常数数值为
水解平衡常数数值为___________ ,用平衡常数解释溶液呈酸性的原因___________ 。
(5)同浓度的 溶液和
溶液和 溶液相比:
溶液相比:
___________ 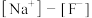 (填字母)。
(填字母)。
A.大于 B.小于
(6)写出向次氯酸钠溶液中通入少量 的离子方程式:
的离子方程式:___________ 。小苏打和明矾能作为泡沫灭火剂,写出反应的离子方程式:___________ 。
| 化学式 |  |  |  |  |
| 电离常数 |  | 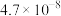 | 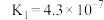 ; ; |  |
(2)
 时,将
时,将 的醋酸与
的醋酸与 氢氧化钠等体积混合,写出反应的离子方程式
氢氧化钠等体积混合,写出反应的离子方程式(3)常温下,
 相同的三种溶液a.
相同的三种溶液a. 溶液;b.
溶液;b. 溶液;c.
溶液;c. 溶液,其物质的量浓度由大到小的顺序是
溶液,其物质的量浓度由大到小的顺序是(4)已知在常温时,将浓度相等的
 与
与 溶液等体积混合,溶液呈酸性。根据表格数据
溶液等体积混合,溶液呈酸性。根据表格数据 水解平衡常数数值为
水解平衡常数数值为(5)同浓度的
 溶液和
溶液和 溶液相比:
溶液相比:
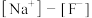 (填字母)。
(填字母)。A.大于 B.小于
(6)写出向次氯酸钠溶液中通入少量
 的离子方程式:
的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式__________________________ 。
(2)若溶液M由10mL 2 mol•L-1NaHA溶液与2mol•L-1NaOH溶液等体积混合而得,则溶液M的pH________ 7 (填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为__________________________ 。
(3)若溶液M由下列三种情况:①0.01mol•L-1的H2A溶液②0.01mol•L-1的NaHA溶液(常温下,其pH>7)③0.02mol•L-1的HCl与0.04mol•L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为______________ ;pH由大到小的顺序为___________________ 。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为_________ (填“大于、等于、小于”或“均有可能”)。
(5)已知Ksp(BaA)= 1.8×10-10,向⑵的混合溶液中加入10mL 1 mol•L-1 BaCl2溶液,混合后溶液中的Ba2+浓度为___________ mol•L-1。
(1)写出酸H2A的电离方程式
(2)若溶液M由10mL 2 mol•L-1NaHA溶液与2mol•L-1NaOH溶液等体积混合而得,则溶液M的pH
(3)若溶液M由下列三种情况:①0.01mol•L-1的H2A溶液②0.01mol•L-1的NaHA溶液(常温下,其pH>7)③0.02mol•L-1的HCl与0.04mol•L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为
(5)已知Ksp(BaA)= 1.8×10-10,向⑵的混合溶液中加入10mL 1 mol•L-1 BaCl2溶液,混合后溶液中的Ba2+浓度为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】天然水体中的H2CO3与空气中的CO2保持平衡。某温度下,溶洞水体中lgc(X) (X为H2CO3、 、
、 或Ca2+)与pH的关系如图所示。
或Ca2+)与pH的关系如图所示。

(1)用方程式和文字说明溶液中H2CO3浓度几乎不变的原因_______
(2)图中的线段_______ (填“①”、 “②”或“③”)表示lgc( )随pH变化关系
)随pH变化关系
(3)从图中可以计算出,H2CO3的Ka2=_______ ( 用以10为底的指数形式表示)
(4)计算该条件下,pH=10.3 时溶液中Ca2+的浓度_______ (用以10为底的指数形式表示)
 、
、 或Ca2+)与pH的关系如图所示。
或Ca2+)与pH的关系如图所示。
(1)用方程式和文字说明溶液中H2CO3浓度几乎不变的原因
(2)图中的线段
 )随pH变化关系
)随pH变化关系(3)从图中可以计算出,H2CO3的Ka2=
(4)计算该条件下,pH=10.3 时溶液中Ca2+的浓度
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】Na2CO3、MaHCO3及xNa2CO3·yH2O(过碳酸的)在工农业生产上用途非常广泛。
(1)0.1mol/LNa2CO3溶液加水稀释时,溶液的pH____ (填“增大”、“减小”或“不变”)。
(2)25℃时,H2CO3的电离常数Ka1=5×10-7,Ka=5×10-11,NH3·H2O的电离常数Kb=1.8×10-5,计算下列平衡常数。
①NaHCO3水解反应HCO3-+H2O H2CO3+OH-的平衡常数为K=
H2CO3+OH-的平衡常数为K= ________ 。(填数值)
②反应HCO3-+NH3·H2O CO32-+NH4++H2O的平衡常数为K=
CO32-+NH4++H2O的平衡常数为K=_________ 。 (填数值)
(3)一种测定xNa2CO3·yH2O2中y/x值的方法如下:

①滴定CO32-时,终点溶液颜色变化是______ 。
②滴定H2O2时,MnO4-被还原为Mn2+,反应的离子方程式为_______ 。
③若消耗盐酸25.00mL,消耗KMnO4溶液19.00mL。y/x的值(列出计算过程)__________ 。
(1)0.1mol/LNa2CO3溶液加水稀释时,溶液的pH
(2)25℃时,H2CO3的电离常数Ka1=5×10-7,Ka=5×10-11,NH3·H2O的电离常数Kb=1.8×10-5,计算下列平衡常数。
①NaHCO3水解反应HCO3-+H2O
 H2CO3+OH-的平衡常数为K=
H2CO3+OH-的平衡常数为K= ②反应HCO3-+NH3·H2O
 CO32-+NH4++H2O的平衡常数为K=
CO32-+NH4++H2O的平衡常数为K=(3)一种测定xNa2CO3·yH2O2中y/x值的方法如下:

①滴定CO32-时,终点溶液颜色变化是
②滴定H2O2时,MnO4-被还原为Mn2+,反应的离子方程式为
③若消耗盐酸25.00mL,消耗KMnO4溶液19.00mL。y/x的值(列出计算过程)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】(1)已知NaHA水溶液呈碱性。
①用离子方程式表示NaHA水溶液呈碱性的原因:______________________________ 。
②在NaHA水溶液中各离子浓度的大小关系是:______________________________ 。
(2)25℃,两种酸的电离平衡常数如表.
①HSO3﹣的电离平衡常数表达式K=______ 。
②H 2SO3溶液和NaHCO3溶液反应的主要离子方程式为______ 。
①用离子方程式表示NaHA水溶液呈碱性的原因:
②在NaHA水溶液中各离子浓度的大小关系是:
(2)25℃,两种酸的电离平衡常数如表.
Ka1 | Ka2 | |
H2SO3 | 1.3×10﹣2 | 6.3×10﹣8 |
H2CO3 | 4.2×10﹣7 | 5.6×10﹣11 |
①HSO3﹣的电离平衡常数表达式K=
②H 2SO3溶液和NaHCO3溶液反应的主要离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】已知Na2SO3溶液显碱性,NaHSO3溶液显酸性,两者均易被氧化。25℃时,甲酸的电离平衡常数Ka=1.8×10-4,H2CO3的电离平衡常数Ka1=4.2×10-7,Ka2=4.8×10-11。
(1)用离子方程式解释Na2SO3溶液显碱性的原因________ 。某次用Na2SO3溶液吸收SO2后,测得溶液pH=7(常温),则该溶液中,[Na+]_______ [SO ]+[HSO
]+[HSO ](选填“>”、“<”或“=”)。
](选填“>”、“<”或“=”)。
(2)Na2SO3溶液在空气中放置一段时间后,溶液的pH的变化趋势及原因是_______ 。
(3)写出甲酸在溶液中的电离方程式:________ 。
(4)结合甲酸与H2CO3的电离平衡常数,下列说法中错误的是________ 。
(1)用离子方程式解释Na2SO3溶液显碱性的原因
 ]+[HSO
]+[HSO ](选填“>”、“<”或“=”)。
](选填“>”、“<”或“=”)。(2)Na2SO3溶液在空气中放置一段时间后,溶液的pH的变化趋势及原因是
(3)写出甲酸在溶液中的电离方程式:
(4)结合甲酸与H2CO3的电离平衡常数,下列说法中错误的是
| A.向Na2CO3溶液中加入过量甲酸溶液无明显现象产生 |
| B.恒温条件下向甲酸溶液中加入NaOH溶液,甲酸的电离程度和电离平衡常数均增大 |
| C.向0.1mol•L-1的甲酸溶液中加入蒸馏水,溶液pH增大 |
| D.向0.1mol•L-1的甲酸溶液中加入NaHCO3固体,溶液pH增大 |
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)__ 。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)_______________ 。
A.氨水与氯化铵发生化学反应 B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①_______________ 和______________ 两种粒子的物质的量之和等于0.1mol。
②_______________ 和______________ 两种粒子的物质的量之和比OH―多0.05mol。
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是_________ ,上述离子浓度大小顺序关系中正确的是(选填序号)________________________ 。
②若上述关系中C是正确的,则溶液中溶质的化学式是__________________________ 。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同)____________ c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)___________ c(Cl-)。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)
A.氨水与氯化铵发生化学反应 B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①
②
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是
②若上述关系中C是正确的,则溶液中溶质的化学式是
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】I.室温下,用滴定管量取一定体积的浓氯水置于锥形瓶中,用NaOH溶液以恒定速率来滴定,根据测定结果绘制出 、
、 的物质的量浓度c与时间t的关系曲线(如图)。回答下列问题:
的物质的量浓度c与时间t的关系曲线(如图)。回答下列问题:

(1) 时发生反应的离子方程式:
时发生反应的离子方程式:___________ 。
(2)写出NaClO水解离子方程式:___________ 。
(3)不考虑水解,则在b点溶液中: 是
是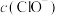 浓度的
浓度的___________ 倍。
II.常温下向一定浓度的 溶液中滴入盐酸,粒子浓度与混合溶液的pH变化的关系如图所示,已知:
溶液中滴入盐酸,粒子浓度与混合溶液的pH变化的关系如图所示,已知: 是二元弱酸,Y表示或
是二元弱酸,Y表示或 ,
, 。回答下列问题:
。回答下列问题:

(4)曲线n表示p___________ (填 或
或 )与pH的变化关系。
)与pH的变化关系。
(5)
___________ 。
(6)NaHX溶液呈___________ 性(填“酸”、“碱”或“中”)。
 、
、 的物质的量浓度c与时间t的关系曲线(如图)。回答下列问题:
的物质的量浓度c与时间t的关系曲线(如图)。回答下列问题:
(1)
 时发生反应的离子方程式:
时发生反应的离子方程式:(2)写出NaClO水解离子方程式:
(3)不考虑水解,则在b点溶液中:
 是
是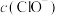 浓度的
浓度的II.常温下向一定浓度的
 溶液中滴入盐酸,粒子浓度与混合溶液的pH变化的关系如图所示,已知:
溶液中滴入盐酸,粒子浓度与混合溶液的pH变化的关系如图所示,已知: 是二元弱酸,Y表示或
是二元弱酸,Y表示或 ,
, 。回答下列问题:
。回答下列问题:
(4)曲线n表示p
 或
或 )与pH的变化关系。
)与pH的变化关系。(5)

(6)NaHX溶液呈
您最近一年使用:0次



