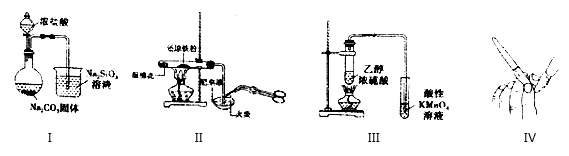
室温下,H2C2O4的电离平衡常数Ka1= 5.9 ×10 -2,Ka2= 6.4 ×10 -5,用0.100 0 mol•L-1 NaOH溶液滴定20.00 mL 0.100 0 mol•L-1H2C2O 4溶液的曲线如图所示(体积变化忽略不计)。下列说法正确的是

A.滴定过程中,当 pH=4 时,存在:c(H+)+c(Na+ )=c(OH- )+c( )+c( )+c( ) ) |
| B.点①、③、④所示溶液中,点③所示溶液水的电离程度最大 |
C.点③所示溶液:3c( )+2c( )+2c( )+c(H2C2O4)=0.l mol•L-1 )+c(H2C2O4)=0.l mol•L-1 |
D.滴定过程中可能出现:c(Na+)>c( )= c( )= c( )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
更新时间:2020-04-06 22:29:30
|
相似题推荐
单选题
|
适中
(0.65)
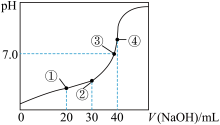
【推荐1】室温时, 和
和 的电离常数分别为
的电离常数分别为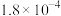 和
和 。将浓度和体积均相同的两种酸溶液混合后加水稀释,随加水量的变化,溶液中
。将浓度和体积均相同的两种酸溶液混合后加水稀释,随加水量的变化,溶液中 浓度(
浓度( 表示混合溶液中的
表示混合溶液中的 或
或 )与溶液
)与溶液 的关系如图所示。下列叙述正确的是
的关系如图所示。下列叙述正确的是
 和
和 的电离常数分别为
的电离常数分别为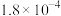 和
和 。将浓度和体积均相同的两种酸溶液混合后加水稀释,随加水量的变化,溶液中
。将浓度和体积均相同的两种酸溶液混合后加水稀释,随加水量的变化,溶液中 浓度(
浓度( 表示混合溶液中的
表示混合溶液中的 或
或 )与溶液
)与溶液 的关系如图所示。下列叙述正确的是
的关系如图所示。下列叙述正确的是
A.曲线Y代表 |
B.稀释过程中,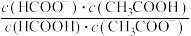 逐渐减小 逐渐减小 |
C.当 时,c点所对应的溶液中 时,c点所对应的溶液中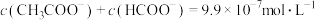 |
D.等浓度的 溶液与 溶液与 溶液等体积混合,所得溶液中: 溶液等体积混合,所得溶液中: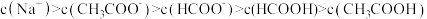 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下:下列说法不正确的是
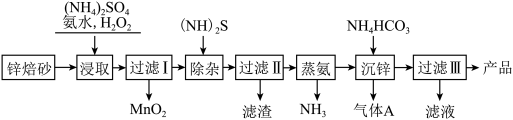

| A.当(NH4)2SO4、NH3·H2O的混合溶液呈中性时,c(NH4+) = 2c(SO42-) |
| B.“浸取”时为了提高锌的浸出率,可采取的措施是搅拌、适当加热 |
| C.“浸取”时加入的NH3·H2O过量,生成MnO2的离子方程式为Mn2++H2O2+2NH3·H2O=MnO2+2NH4++2H2O |
| D.“过滤Ⅲ”所得滤液可循环使用,其主要成分的化学式是NH4HCO3 |
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐3】已知25℃时,有关弱酸的电离平衡常数:
则下列有关说法不正确的是
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7Ka2=5.6×10-11 |
则下列有关说法不正确的是
| A.25℃时,0.1mol·L-1溶液的pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
| B.25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等 |
| C.25℃时,同浓度的醋酸和氢氧化钠等体积混合,所得溶液pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7 |
| D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】室温下,用0.100 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 mol·L-1的盐酸和醋酸,滴定曲线如图所示。下列说法不正确的是( )


| A.I表示的是滴定醋酸的曲线, 用酚酞作指示剂 |
| B.pH=7时,滴定醋酸消耗的V(NaOH)小于20.00 mL |
| C.V(NaOH)=20.00 mL时,两份溶液中c(Cl-)=c(CH3COO-) |
| D.V(NaOH)=10.00 mL时,醋酸溶液中c(CH3COO-)>c(Na+)> c(H+)>c(OH-) |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】常温下,下列溶液中微粒的关系不正确的是
| A.已知HCOOH的Ka=1.77×10-4,HClO的Ka=4.0×10-8,则等体积等浓度的HCOONa溶液和KClO溶液中的阴阳离子总数:前者>后者 |
| B.0.1 mol·L-1CH3COONa溶液中c(CH3COO-)为c1,1 mol·L-1CH3COONa溶液中c(CH3COO-)为c2: 10c1 > c2 |
| C.pH相等CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) |
| D.用等浓度的NaOH溶液分别滴定等体积等浓度的三种一元弱酸(HX、HY和HZ),恰好反应后将三种溶液混合:c(HX)+c(HY)+c(HZ) + c(H+)=c(OH-) |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】现有0.1mol/LNa2CO3溶液,对溶液中离子浓度关系的描述,不正确的是
A.c(Na+)+c(H+)=c(OH-)+2c(CO )+c(HCO )+c(HCO ) ) |
B.c(H+)+c(HCO )+2c(H2CO3)=c(OH-) )+2c(H2CO3)=c(OH-) |
C.c(Na+)=2[c(H2CO3)+c(CO )+c(HCO )+c(HCO )] )] |
D.c(Na+)+c(H+)=c(OH-)+2c(CO )+c(HCO )+c(HCO )+c(H2CO3) )+c(H2CO3) |
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐1】高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广泛的应用前景。实验室测定高铁酸钾样品纯度涉及的主要步骤如下:
①样品溶解后,加入足量NaCr(OH)4:Cr(OH)4-+FeO42-+3H2O=Fe(OH)3·3H2O+CrO42-+OH-;
②调节溶液pH;
③用(NH4)2Fe(SO4)2标准溶液滴定:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
下列说法正确的是( )
①样品溶解后,加入足量NaCr(OH)4:Cr(OH)4-+FeO42-+3H2O=Fe(OH)3·3H2O+CrO42-+OH-;
②调节溶液pH;
③用(NH4)2Fe(SO4)2标准溶液滴定:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
下列说法正确的是( )
| A.①②③均涉及氧化还原反应 |
| B.②应调高溶液的pH |
| C.①③中反应完成后,溶液pH均增大 |
| D.若③中反应消耗0.3mol(NH4)2Fe(SO4)2,则样品中含有0.05molK2FeO4 |
您最近半年使用:0次
【推荐2】下列装置或操作能达到实验目的的是
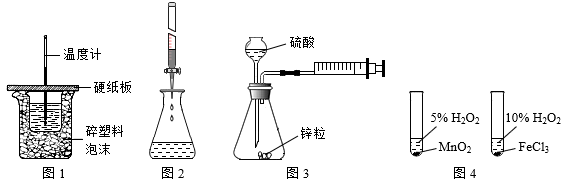

| A.图1装置用于硫酸和Ba(OH)2反应的中和热测定 |
| B.图2装置用于酸性高锰酸钾溶液滴定草酸 |
| C.图3装置用于测定H+表示的反应速率(单位mL/s) |
| D.图4装置用于研究不同催化剂对反应速率的影响 |
您最近半年使用:0次