真题
1 .  为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.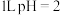 的 的 溶液中含 溶液中含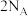 个 个 |
B.反应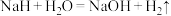 生成 生成 ,转移 ,转移 个电子 个电子 |
C. 号元素的原子一定含有 号元素的原子一定含有 个质子、 个质子、 个中子 个中子 |
D. 组成为 组成为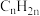 的烃一定含有 的烃一定含有 个双键 个双键 |
您最近半年使用:0次
真题
解题方法
2 . 研究人员用同位素标记法研究了一个反应过程,如下:
①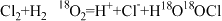
②
关于这个反应,说法正确的是
①
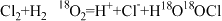
②

关于这个反应,说法正确的是
| A.反应①是置换反应 |
| B.18O的核电荷数是18 |
| C.18O与16O互为同素异性体 |
D.反应历程中 中的O-O键没有发生断裂 中的O-O键没有发生断裂 |
您最近半年使用:0次
真题
解题方法
3 . 下列比较C和 非金属性的方法,错误的是
非金属性的方法,错误的是
 非金属性的方法,错误的是
非金属性的方法,错误的是| A.元素的电负性 |
| B.最高价氧化物的熔点 |
| C.简单氢化物的热稳定性 |
| D.最高价氧化物对应的水化物的酸性 |
您最近半年使用:0次
4 . 工业上将Cl2通入冷的 溶液中制得漂白液,下列说法不正确的是
溶液中制得漂白液,下列说法不正确的是
 溶液中制得漂白液,下列说法不正确的是
溶液中制得漂白液,下列说法不正确的是A.漂白液的有效成分是 | B. ClO-水解生成 使漂白液呈酸性 使漂白液呈酸性 |
| C.通入CO2后的漂白液消毒能力增强 | D. 溶液比 溶液比 溶液稳定 溶液稳定 |
您最近半年使用:0次
真题
解题方法
5 . 下列物质不属于 电解质的是
A. | B. | C. | D.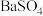 |
您最近半年使用:0次
6 . 固态化合物Y的组成为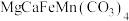 ,以Y为原料实现如下转化。
,以Y为原料实现如下转化。
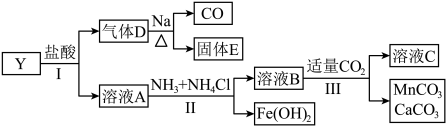
已知: 与溶液A中金属离子均不能形成配合物。
与溶液A中金属离子均不能形成配合物。
请回答:
(1)依据步骤Ⅲ, 、
、 和
和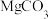 中溶解度最大的是
中溶解度最大的是_______ 。写出溶液C中的所有阴离子_______ 。步骤Ⅱ中,加入 的作用是
的作用是_______ 。
(2)下列说法正确的是_______。
(3)酸性条件下,固体 (微溶于水,其还原产物为无色的
(微溶于水,其还原产物为无色的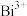 )可氧化
)可氧化 为
为 ,根据该反应原理,设计实验验证Y中含有
,根据该反应原理,设计实验验证Y中含有 元素
元素_______ ;写出 转化为
转化为 的离子方程式
的离子方程式_______ 。
 ,以Y为原料实现如下转化。
,以Y为原料实现如下转化。
已知:
 与溶液A中金属离子均不能形成配合物。
与溶液A中金属离子均不能形成配合物。请回答:
(1)依据步骤Ⅲ,
 、
、 和
和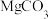 中溶解度最大的是
中溶解度最大的是 的作用是
的作用是(2)下列说法正确的是_______。
| A.气体D是形成酸雨的主要成分 | B.固体E可能含有 |
C.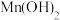 可溶于 可溶于 溶液 溶液 | D.碱性: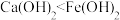 |
(3)酸性条件下,固体
 (微溶于水,其还原产物为无色的
(微溶于水,其还原产物为无色的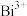 )可氧化
)可氧化 为
为 ,根据该反应原理,设计实验验证Y中含有
,根据该反应原理,设计实验验证Y中含有 元素
元素 转化为
转化为 的离子方程式
的离子方程式
您最近半年使用:0次
2024-02-02更新
|
1223次组卷
|
2卷引用:2024年浙江高考真题化学(1月)
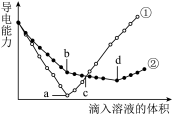
7 . 在两份相同的 溶液中,分别滴入物质的量浓度相等的
溶液中,分别滴入物质的量浓度相等的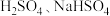 溶液,其导电能力随滴入溶液体积变化的曲线如下图所示.下列分析不正确的是
溶液,其导电能力随滴入溶液体积变化的曲线如下图所示.下列分析不正确的是
 溶液中,分别滴入物质的量浓度相等的
溶液中,分别滴入物质的量浓度相等的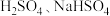 溶液,其导电能力随滴入溶液体积变化的曲线如下图所示.下列分析不正确的是
溶液,其导电能力随滴入溶液体积变化的曲线如下图所示.下列分析不正确的是
A.①代表滴加 溶液的变化曲线 溶液的变化曲线 | B. 点,两溶液中含有相同量的 点,两溶液中含有相同量的 |
C. 点,溶液中大量存在的离子是 点,溶液中大量存在的离子是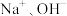 | D.a、d两点对应的溶液均显中性 |
您最近半年使用:0次
2023-12-03更新
|
244次组卷
|
101卷引用:2016年全国普通高等学校招生统一考试化学(北京卷精编版)
2016年全国普通高等学校招生统一考试化学(北京卷精编版)2016年全国普通高等学校招生统一考试化学(北京卷参考版)2015-2016学年浙江省绍兴一中高一下期末化学试卷2017届甘肃省兰州一中高三上学期9月月考化学试卷2017届内蒙古临河区巴彦淖尔一中高三上9月月考化学卷2016-2017学年湖南省长沙一中高二上第一次月考化学卷2017届福建省仙游一中高三上第一次月考化学试卷2017届山东省新泰市高三上学期第一次阶段考化学试卷2017届广西桂林十八中高三上10月月考化学试卷2016-2017学年湖南省长郡中学高二上期中化学卷2016-2017学年辽宁东北育才学校高二上阶段考二化学卷2016-2017学年江西省南昌市八一中学等五校高二上联考二化学试卷四川省成都市第七中学2017届高三周测(4月15日)理科综合化学试题山东省泰安市第一中学2016-2017学年高一下学期学情检测化学试题四川省成都外国语学校2016-2017学年高一下期期末考试(理)化学试题江苏省启东中学2017-2018学年高一(创新班)上学期期初考试化学试题新疆生产建设兵团第二中学2016-2017学年高二下学期第四次月考化学试题陕西省西安市第一中学2018届高三上学期第二次模拟考试化学试题湖北省荆州中学2018届高三上学期第三次双周考(11月)化学试卷新疆生产建设兵团第二中学2017-2018学年高一上学期期中考试化学试题福建省福州市八县(市)协作校2018届高三上学期期中联考化学试题北京四中2018届上学期高三年级期中考试化学试卷江西省抚州市临川区第一中学2017-2018学年高二12月月考化学试题湖南省长沙市第一中学2017-2018学年高一上学期第二次阶段性检测化学试题湖南省长沙市一中2017-2018学年高一上学期第二次模块考试化学试题(已下线)【中等生百日捷进提升系列-基础练测】专题2.3 离子反应广西桂林市第十八中学2017-2018学年高一下学期开学考试化学试题(已下线)《考前20天终极攻略》6月4日 专项四 化学坐标曲线图分析(已下线)解密11 弱电解质的电离和溶液的酸碱性——备战2018年高考化学之高频考点解密(已下线)学科网2019年高考化学一轮复习讲练测 2.2 离子反应 离子共存及检测(已下线)学科网2019年高考化学一轮复习讲练测 2.2 离子反应 离子共存及检验 练安徽省白泽湖中学2017届高三上学期期中考试化学试题高二人教版选修4 第三章 第二节 水的电离和溶液的酸碱性【全国百强校】甘肃省天水市一中2018-2019学年高二(理)上学期第二学段考试化学试题(已下线)2019高考备考二轮复习精品资料-专题4 离子反应(教学案)吉林省白城市第一中学2018-2019学年高二下学期期末考试化学试题第一章 章末检测(2)《高中新教材同步备课》(人教版 必修第一册)云南省双柏县一中2020届高三上学期开学考试化学试题河北安平中学2019-2020学年高二上学期第二次月考化学试题浙江省宁波市北仑中学2019-2020学年高二上学期期中考试化学(2-10班)试题上海市普陀区2020届高三上学期一模化学试题吉林省长春市兴华中学2019-2020学年高一上学期期中考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——酸碱中和滴定(已下线)【新东方】2020--98(已下线)专题十二 水溶液中的离子平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训2020届成都市第七中学高中毕业班四月份教学质量监测卷理科综合化学部分河北省石家庄市第二中学2020届高中毕业班四月份教学质量监测卷理科综合化学部分湖北省武汉市华中师范大学第一附属中学2020届高三下学期四月份网络教学质量监测理科综合化学试题(已下线)第3单元 离子反应(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷(已下线)第01章 物质及其变化(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)(已下线)第一章章末检测(1)——《高中新教材同步备课》(人教版 必修第一册)河南省漯河市临颍县南街高级中学2020届高三阶段性测试化学试题吉林省白山市长白朝鲜族自治县实验中学2020-2021学年高一上学期第一次月考化学试题山西省太原师范学院附属中学师苑中学2020-2021学年高一上学期第一次月考化学试题江西省于都中学2020-2021学年高一上学期第一次月考化学试题内蒙古赤峰二中2020-2021学年高一上学期第一次月考化学试题(已下线)【浙江新东方】33湖南省长沙市南雅中学2020—2021学年高一上学期第一次月考化学试题四川省成都新津为明学校2020-2021学年高二上学期期中测试化学试题海南省华中师范大学琼中附属中学2020-2021学年高一上学期期中考试化学试题内蒙古包头市回民中学2020-2021学年高一上学期期中考试化学试题(已下线)【浙江新东方】【2020】【高一上】【期中】【HD-LP404】【化学】(已下线)【浙江新东方】89.浙江省台州市2019—2020学年高一上学期期末质量评估考试化学试题重庆市凤鸣山中学校2021届高三10月月考化学试题甘肃省白银市第十中学2019-2020学年高一上学期期中考试化学试题专题3 第二单元综合拔高练-高中化学苏教2019版必修第一册陕西省西安市第一中学2020-2021学年高一上学期12月月考化学试题 河南省林州市第一中学2021-2022学年高一上学期开学检测(普通班)化学试题云南景东彝族自治县第一中学2021-2022学年高二上学期开学考试化学试题山东省滨州市惠民县第二中学致远高中部2021-2022学年高三10月月考化学试题山西省大同市平城中学校2021-2022学年高一上学期10月月考化学试题云南景东彝族自治县第一中学2021-2022学年高二上学期开学检测化学试题辽宁省渤海大学附属高级中学2021-2022学年高三上学期第三次考试化学试题云南省玉溪市民族中学2021-2022年高三下学期适应性考试(七)化学试题河南省洛阳市伊川县第一高中2021-2022学年高一上学期第二次月考化学试题湖南省长郡中学2021-2022学年高一下学期期末考试化学试题黑龙江省鹤岗市第一中学2021-2022学年高二下学期期末考试化学试题山西省河津市第二中学2022-2023学年高一上学期9月月考 化学试题北京市丰台区丰台第二中学2022-2023学年上学期高三10月月考化学试题安徽省合肥市第六中学2022-2023学年高一上学期第一次测试化学试题北京市中国人民大学附属中学2022-2023学年高三上学期统练6化学试题新疆阿瓦提县第四中学2022-2023学年高一上学期9月份测试化学B试题(已下线)专题04 电离方程式、电解质溶液的导电性-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型134 导电能力与酸碱中和滴定图像甘肃省张掖市高台县第一中学2022-2023学年高二下学期2月月考化学试题北京市顺义区第一中学2023届高三下学期2月月考化学试题北京市中国人民大学附属中学2018-2019学年高一上学期期中考试化学试题(已下线)第2讲 离子反应 离子方程式(已下线)T10-离子反应山东省聊城市第二中学2023-2024学年高二上学期开学考试化学试题辽宁省朝阳市辽宁名校统考2023-2024学年高一上学期10月月考化学试题甘肃省天水市2023-2024学年高一上学期10月期中检测化学试题云南省昆明市第八中学2023-2024学年高一上学期9月月考化学试卷题浙江省台州市第一中学2022-2023学年高一上学期11月期中考试化学试题北京工业大学附属中学2022-2023学年高三上学期开学测试化学试题北京市第一六一中学2022-2023学年高一上学期12月月考化学试题北京理工大学附属中学2023-2024学年高一上学期期中考试化学试题河南省南阳市第一中学校2023-2024学年高一上学期第二次月考化学试题 吉林省长春市东北师大附中2023-2024学年高一上学期期末考试化学试题吉林省长春市东北师范大学附属中学2023-2024学年高一上学期期末化学试题
2022·北京·高考真题
8 . 某小组同学探究不同条件下氯气与二价锰化合物的反应。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。
ⅱ、浓碱条件下,MnO 可被OH-还原为MnO
可被OH-还原为MnO 。
。
ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
(1)B中试剂是_____ 。
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为_____ 。
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是_____ 。
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO 氧化为MnO
氧化为MnO 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因:_____ ,但通过实验测定溶液的碱性变化很小。
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为_____ ,溶液绿色缓慢加深,原因是MnO2被_____ (填化学式)氧化,可证明实验Ⅲ的悬浊液中氧化剂过量。
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是_____ 。
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:_____ 。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO
 (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。ⅱ、浓碱条件下,MnO
 可被OH-还原为MnO
可被OH-还原为MnO 。
。ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
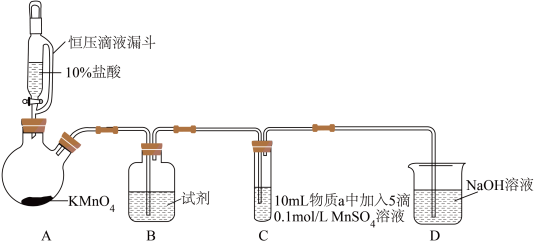
| 实验 | 物质a | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO
 氧化为MnO
氧化为MnO 。
。①用化学方程式表示可能导致溶液碱性减弱的原因:
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近半年使用:0次
2023-11-29更新
|
605次组卷
|
29卷引用:2022年北京市高考真题化学试题(部分试题)
(已下线)2022年北京市高考真题化学试题(部分试题)2022年北京市高考真题化学试题(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)四川省成都市树德中学2022-2023学年高三上学期入学考试理综化学试题(已下线)第28讲 定性、定量实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)2022年北京高考真题变式题1-14(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题(已下线)专题三 离子反应-实战高考·二轮复习核心突破突破超重点 高效突破综合实验 实验4 创新探究实验角度1控制变量法探究(已下线)2022年北京高考真题化学试题变式题(实验探究题)(已下线)题型46 实验原理探究型综合实验(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 氯气和卤族元素(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)新疆乌鲁木齐市第101中学2022-2023学年高一上学期12月月考化学试题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)北京一零一中学2023-2024学年高三上学期11月统练五化学试题(已下线)微专题 物质性质综合实验探究北京市日坛中学2023-2024学年高三上学期10月检测化学试题北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题江苏省苏州市工业园区星海实验高级中学2023-2024学年高一上学期12月调研化学试题山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题
2023·河北·高考真题
9 . 配合物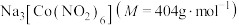 在分析化学中用于
在分析化学中用于 的鉴定,其制备装置示意图(夹持装置等略)及步骤如下:
的鉴定,其制备装置示意图(夹持装置等略)及步骤如下:

①向三颈烧瓶中加入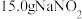 和
和 热蒸馏水,搅拌溶解。
热蒸馏水,搅拌溶解。
②磁力搅拌下加入 ,从仪器a加入50%醋酸
,从仪器a加入50%醋酸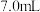 。冷却至室温后,再从仪器b缓慢滴入30%双氧水
。冷却至室温后,再从仪器b缓慢滴入30%双氧水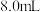 。待反应结束,滤去固体。
。待反应结束,滤去固体。
③在滤液中加入95%乙醇,静置40分钟。固液分离后,依次用乙醇、乙醚洗涤固体产品,称重。
已知:i.乙醇、乙醚的沸点分别是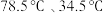 ;
;
ii. 的溶解度数据如下表。
的溶解度数据如下表。
回答下列问题:
(1)仪器a的名称是_______ ,使用前应_______ 。
(2)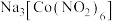 中钴的化合价是
中钴的化合价是_______ ,制备该配合物的化学方程式为_______ 。
(3)步骤①中,用热蒸馏水的目的是_______ 。
(4)步骤③中,用乙醚洗涤固体产品的作用是_______ 。
(5)已知: (亮黄色)足量
(亮黄色)足量 与
与 产品反应生成
产品反应生成 亮黄色沉淀,产品纯度为
亮黄色沉淀,产品纯度为_______ %。
(6)实验室检验样品中钾元素的常用方法是:将铂丝用盐酸洗净后,在外焰上灼烧至与原来的火焰颜色相同时,用铂丝蘸取样品在外焰上灼烧,_______ 。
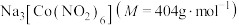 在分析化学中用于
在分析化学中用于 的鉴定,其制备装置示意图(夹持装置等略)及步骤如下:
的鉴定,其制备装置示意图(夹持装置等略)及步骤如下:
①向三颈烧瓶中加入
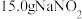 和
和 热蒸馏水,搅拌溶解。
热蒸馏水,搅拌溶解。②磁力搅拌下加入
 ,从仪器a加入50%醋酸
,从仪器a加入50%醋酸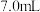 。冷却至室温后,再从仪器b缓慢滴入30%双氧水
。冷却至室温后,再从仪器b缓慢滴入30%双氧水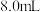 。待反应结束,滤去固体。
。待反应结束,滤去固体。③在滤液中加入95%乙醇,静置40分钟。固液分离后,依次用乙醇、乙醚洗涤固体产品,称重。
已知:i.乙醇、乙醚的沸点分别是
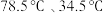 ;
;ii.
 的溶解度数据如下表。
的溶解度数据如下表。| 温度/℃ | 20 | 30 | 40 | 50 |
溶解度/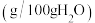 | 84.5 | 91.6 | 98.4 | 104.1 |
(1)仪器a的名称是
(2)
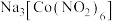 中钴的化合价是
中钴的化合价是(3)步骤①中,用热蒸馏水的目的是
(4)步骤③中,用乙醚洗涤固体产品的作用是
(5)已知:
 (亮黄色)足量
(亮黄色)足量 与
与 产品反应生成
产品反应生成 亮黄色沉淀,产品纯度为
亮黄色沉淀,产品纯度为(6)实验室检验样品中钾元素的常用方法是:将铂丝用盐酸洗净后,在外焰上灼烧至与原来的火焰颜色相同时,用铂丝蘸取样品在外焰上灼烧,
您最近半年使用:0次
2023-11-29更新
|
3096次组卷
|
4卷引用:2023年河北省高考化学试卷
(已下线)2023年河北省高考化学试卷2023年河北省高考化学试卷山东省潍坊市昌乐二中2023-2024学年高三上学期12月月考化学试题(已下线)题型17 化学实验综合-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
10 . 稀有气体氙的氟化物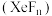 与
与 溶液反应剧烈,与水反应则较为温和,反应式如下:
溶液反应剧烈,与水反应则较为温和,反应式如下:
下列说法错误 的是
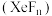 与
与 溶液反应剧烈,与水反应则较为温和,反应式如下:
溶液反应剧烈,与水反应则较为温和,反应式如下:| 与水反应 | 与 溶液反应 溶液反应 |
i.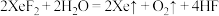 | ii.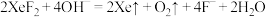 |
iii. | iv. 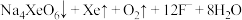 |
A. 具有平面三角形结构 具有平面三角形结构 | B. 的还原性比 的还原性比 强 强 |
| C.反应i~iv中有3个氧化还原反应 | D.反应iv每生成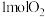 ,转移 ,转移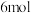 电子 电子 |
您最近半年使用:0次
2023-11-16更新
|
2319次组卷
|
3卷引用:2023年福建省高考化学试卷



