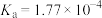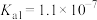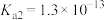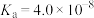名校
解题方法
1 . 科学研究表明: 存储能量的能力是
存储能量的能力是 的12000倍左右,在大气中的寿命可达740年,如表所示是几种化学键的键能(断裂或形成1mol化学键时吸收或释放的热量)
的12000倍左右,在大气中的寿命可达740年,如表所示是几种化学键的键能(断裂或形成1mol化学键时吸收或释放的热量)
回答下列问题:
(1)①过程
___________ (填“吸收”或“放出”)能量。
②反应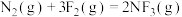
 =
=___________ 。
(2)已知:
①
 ;
;
②
 。
。
现有2mol由炭粉和氢气组成的悬浮气,在足量氧气中完全燃烧生成 (g)和
(g)和 (l),共放出679.0kJ的热量,则2mol悬浮气中C与
(l),共放出679.0kJ的热量,则2mol悬浮气中C与 的物质的量之比为
的物质的量之比为___________ 。
(3)电石( )可通过下列反应制备:
)可通过下列反应制备:
①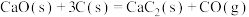
 ;
;
②
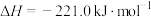 。
。
若不考虑热量损耗,物料转化率均为100%,最终炉中出来的气体只有CO。则为了维持热量平衡,每生产64g ,投料的量为56g CaO及
,投料的量为56g CaO及___________ mol C、___________ mol  。
。
 存储能量的能力是
存储能量的能力是 的12000倍左右,在大气中的寿命可达740年,如表所示是几种化学键的键能(断裂或形成1mol化学键时吸收或释放的热量)
的12000倍左右,在大气中的寿命可达740年,如表所示是几种化学键的键能(断裂或形成1mol化学键时吸收或释放的热量)| 化学键 | N≡N | F—F | N—F |
键能( ) ) | 946 | 154 | 283 |
(1)①过程

②反应
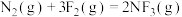
 =
=(2)已知:
①

 ;
;②

 。
。现有2mol由炭粉和氢气组成的悬浮气,在足量氧气中完全燃烧生成
 (g)和
(g)和 (l),共放出679.0kJ的热量,则2mol悬浮气中C与
(l),共放出679.0kJ的热量,则2mol悬浮气中C与 的物质的量之比为
的物质的量之比为(3)电石(
 )可通过下列反应制备:
)可通过下列反应制备:①
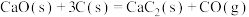
 ;
;②

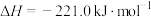 。
。若不考虑热量损耗,物料转化率均为100%,最终炉中出来的气体只有CO。则为了维持热量平衡,每生产64g
 ,投料的量为56g CaO及
,投料的量为56g CaO及 。
。
您最近一年使用:0次
2024-05-07更新
|
170次组卷
|
2卷引用:辽宁省本溪市高级中学2023-2024学年高一下学期4月月考化学试题
解题方法
2 . 回答下列问题。
(1)如图1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图。___________ 。
(2)用如图所示装置进行中和热的测定实验。___________ ,碎泡沫塑料的作用是___________ 。
②理论上强酸强碱的中和热为57.3kJ·mol-1,写出表示稀硫酸和稀NaOH溶液反应的中和热的热化学方程式___________ 。
(3)甲醇是人们开发和利用的一种新能源。已知:


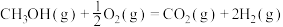

①甲醇蒸气完全燃烧生成二氧化碳气体和液态水的热化学方程式为___________ ;
②H2(g)的燃烧热为___________ 。
(4)某实验小组用0.50mol/LNaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。若实验中大约要使用245mLNaOH溶液,则至少需要称量NaOH固体___________ g。取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。请填写下表中的空白:
(5)近似认为0.50mol/LNaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热
___________ (取小数点后一位)。
(6)上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是___________ (填字母)。
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用铜棒代替玻璃搅拌棒
(1)如图1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图。

(2)用如图所示装置进行中和热的测定实验。

②理论上强酸强碱的中和热为57.3kJ·mol-1,写出表示稀硫酸和稀NaOH溶液反应的中和热的热化学方程式
(3)甲醇是人们开发和利用的一种新能源。已知:


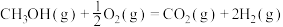

①甲醇蒸气完全燃烧生成二氧化碳气体和液态水的热化学方程式为
②H2(g)的燃烧热为
(4)某实验小组用0.50mol/LNaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。若实验中大约要使用245mLNaOH溶液,则至少需要称量NaOH固体
| 温度实验次数 | 起始温度 /℃ /℃ | 终止温度 /℃ /℃ | 温度差平均值 /℃ /℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
(5)近似认为0.50mol/LNaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热

(6)上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用铜棒代替玻璃搅拌棒
您最近一年使用:0次
名校
解题方法
3 . 回答下列问题
(1)下列变化中属于吸热反应的是___________
①铝片与稀盐酸的反应
②将胆矾加热变为白色粉末
③干冰汽化
④过氧化钠与水的反应
⑤甲烷在氧气中的燃烧反应
⑥NaHCO3与盐酸的反应
(2)硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:
反应Ⅱ: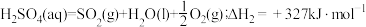
反应Ⅲ: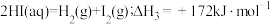
反应: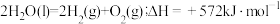
则反应Ⅰ的热化学方程式为___________ 。
(3)断裂 化学键所需要的能量如表所示,肼(H2N-NH2)的有关化学反应的能量变化如图所示。
化学键所需要的能量如表所示,肼(H2N-NH2)的有关化学反应的能量变化如图所示。
①1molN2H4(g)与1molO2(g)断键吸收的能量为___________ kJ。
②a=___________ 。
(1)下列变化中属于吸热反应的是
①铝片与稀盐酸的反应
②将胆矾加热变为白色粉末
③干冰汽化
④过氧化钠与水的反应
⑤甲烷在氧气中的燃烧反应
⑥NaHCO3与盐酸的反应
(2)硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:
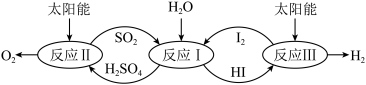
反应Ⅱ:
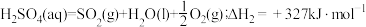
反应Ⅲ:
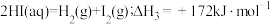
反应:
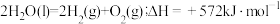
则反应Ⅰ的热化学方程式为
(3)断裂
 化学键所需要的能量如表所示,肼(H2N-NH2)的有关化学反应的能量变化如图所示。
化学键所需要的能量如表所示,肼(H2N-NH2)的有关化学反应的能量变化如图所示。| 化学键 |  |  |  |  |
| 能量/( kJ∙mol-1) | a | 498 | 946 | 391 |
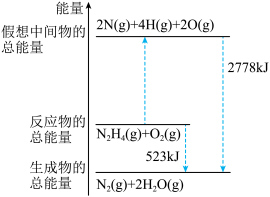
①1molN2H4(g)与1molO2(g)断键吸收的能量为
②a=
您最近一年使用:0次
名校
解题方法
4 . I.化学反应在发生物质变化的同时伴随着能量变化,请回答下列问题:
(1)汽车发动机工作时会引发 和
和 反应,生成
反应,生成 等污染大气,其中生成
等污染大气,其中生成 的能量变化如图所示,则图中三种分子最稳定的是
的能量变化如图所示,则图中三种分子最稳定的是___________ ,图中对应反应的热化学方程式为___________ 。 可转化为
可转化为 ,
, 在空气中加热反应可制得铁系氧化物材料。
在空气中加热反应可制得铁系氧化物材料。
已知25℃,101 时:
时:
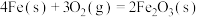
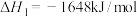


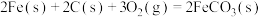
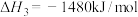
则

___________ 。
Ⅱ.某实验小组设计用0.55 的
的 溶液100
溶液100 与0.50
与0.50 的盐酸100
的盐酸100 置于如图所示的装置中进行测定中和反应反应热的实验。
置于如图所示的装置中进行测定中和反应反应热的实验。___________ ,装置中还存在的错误有___________ ;大烧杯杯口若不盖泡沫塑料板,测得中和反应的反应热 将
将___________ (填“偏大”、“偏小”或“无影响”)。
(4)实验中,所用 稍过量的原因是
稍过量的原因是___________ 。
(5)该实验小组做了三次实验,每次取盐酸和 溶液各100
溶液各100 ,并记录原始数据:
,并记录原始数据:
已知盐酸、 溶液密度均近似为1.00
溶液密度均近似为1.00 ,中和后混合液
,中和后混合液 ,则该中和反应的反应热
,则该中和反应的反应热
___________ 。(保留到小数点后1位)
(1)汽车发动机工作时会引发
 和
和 反应,生成
反应,生成 等污染大气,其中生成
等污染大气,其中生成 的能量变化如图所示,则图中三种分子最稳定的是
的能量变化如图所示,则图中三种分子最稳定的是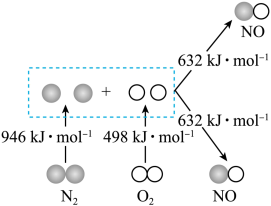
 可转化为
可转化为 ,
, 在空气中加热反应可制得铁系氧化物材料。
在空气中加热反应可制得铁系氧化物材料。已知25℃,101
 时:
时: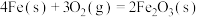
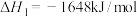


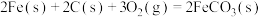
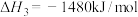
则


Ⅱ.某实验小组设计用0.55
 的
的 溶液100
溶液100 与0.50
与0.50 的盐酸100
的盐酸100 置于如图所示的装置中进行测定中和反应反应热的实验。
置于如图所示的装置中进行测定中和反应反应热的实验。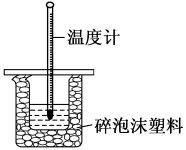
 将
将(4)实验中,所用
 稍过量的原因是
稍过量的原因是(5)该实验小组做了三次实验,每次取盐酸和
 溶液各100
溶液各100 ,并记录原始数据:
,并记录原始数据:| 实验序号 | 起始温度 /℃ /℃ | 终止温度 /℃ /℃ | 温差 /℃ /℃ | ||
| 盐酸 |  溶液 溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.0 | 3.0 |
| 2 | 25.1 | 25.1 | 25.1 | 28.2 | 3.1 |
| 3 | 25.1 | 25.1 | 25.1 | 28.0 | 2.9 |
 溶液密度均近似为1.00
溶液密度均近似为1.00 ,中和后混合液
,中和后混合液 ,则该中和反应的反应热
,则该中和反应的反应热
您最近一年使用:0次
5 . 室温下部分弱酸的电离平衡常数如表所示。
弱酸 | HCOOH |
|
| HClO | HF |
电离平衡常数(25℃) |
|
|
|
|
|
回答下列问题:
(1)
 在水溶液中的第一步电离方程式为
在水溶液中的第一步电离方程式为 的HCOOH、
的HCOOH、 、
、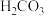 、HClO溶液中
、HClO溶液中 由大到小的顺序为
由大到小的顺序为(2)
 的HClO溶液中
的HClO溶液中 约为
约为 ,少量
,少量 通入NaClO溶液中发生反应的离子方程式为
通入NaClO溶液中发生反应的离子方程式为(3)KHS溶液呈
(4)25℃时,调节
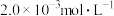 的氢氟酸水溶液的pH(忽略体积变化),得到
的氢氟酸水溶液的pH(忽略体积变化),得到 、
、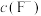 与溶液pH的变化关系如图所示。
与溶液pH的变化关系如图所示。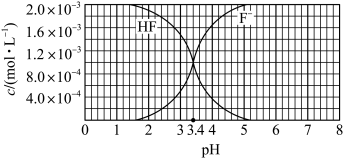
①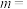
②向HF溶液中加入NaOH固体至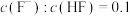 时,
时,
您最近一年使用:0次
6 . 已知:连二次硝酸( )是二元酸,可用于制取
)是二元酸,可用于制取 气体。在常温下,用
气体。在常温下,用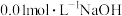 溶液滴定
溶液滴定 溶液,测得溶液的
溶液,测得溶液的 与
与 溶液体积的关系如图所示。
溶液体积的关系如图所示。

回答下列问题。
(1)滴定过程中盛装标准 溶液应选用
溶液应选用________ (填字母)仪器。

(2)常温下, 的
的
________ 。
(3)已知常温下 ,
, 与
与 溶液
溶液________ (填“能”或“不能”)反应。
(4)滴定过程中,由水电离出的 大小关系:
大小关系:
________ (填“>”“<”或“=”) 。
。
(5) 点溶液中
点溶液中
________ (填“>”“<”或“=”) 。
。
(6) 点溶液中含氮粒子浓度由大到小的顺序是
点溶液中含氮粒子浓度由大到小的顺序是________ 。
(7) 点溶液和
点溶液和 溶液混合,可得黄色的
溶液混合,可得黄色的 沉淀,再向该体系中滴加
沉淀,再向该体系中滴加 溶液,此时白色和黄色沉淀共存,该体系中
溶液,此时白色和黄色沉淀共存,该体系中
________ 。[已知 ,
, ]
]
 )是二元酸,可用于制取
)是二元酸,可用于制取 气体。在常温下,用
气体。在常温下,用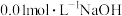 溶液滴定
溶液滴定 溶液,测得溶液的
溶液,测得溶液的 与
与 溶液体积的关系如图所示。
溶液体积的关系如图所示。
回答下列问题。
(1)滴定过程中盛装标准
 溶液应选用
溶液应选用
(2)常温下,
 的
的
(3)已知常温下
 ,
, 与
与 溶液
溶液(4)滴定过程中,由水电离出的
 大小关系:
大小关系:
 。
。(5)
 点溶液中
点溶液中
 。
。(6)
 点溶液中含氮粒子浓度由大到小的顺序是
点溶液中含氮粒子浓度由大到小的顺序是(7)
 点溶液和
点溶液和 溶液混合,可得黄色的
溶液混合,可得黄色的 沉淀,再向该体系中滴加
沉淀,再向该体系中滴加 溶液,此时白色和黄色沉淀共存,该体系中
溶液,此时白色和黄色沉淀共存,该体系中
 ,
, ]
]
您最近一年使用:0次
7 . 回答下列问题
(1)二氧化氯具有杀菌、漂白、除臭、消毒、保鲜的功能。电解法制取 的新工艺如图所示。
的新工艺如图所示。
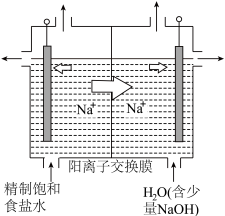
①用石墨作电极,在一定条件下电解饱和食盐水制取 (如图所示),阳极产生
(如图所示),阳极产生 的电极反应式为
的电极反应式为________ 。
②电解一段时间,当阴极产生的气体体积为 (标准状况)时,停止电解,则通过阳离子交换膜的阳离子的物质的量为
(标准状况)时,停止电解,则通过阳离子交换膜的阳离子的物质的量为________  。
。
(2)粗银精炼装置如图所示,电解液为稀硫酸。
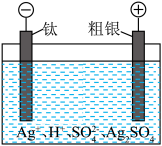
①阳极的电极反应式为________ 。
②下列说法正确的是________ (填字母)。
a.一段时间后,阳极质量减小
b.阴极区可获得银单质的原理:
c.体系中存在沉淀溶解平衡: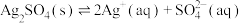
(3)一种用于心脏起搏器的微型电池具有容量大、寿命长和电压稳定等特点。该电池的电极材料是石墨和锂,电解质溶液为等物质的量的 、
、 溶解在
溶解在 中形成的溶液。这种电池的总反应为
中形成的溶液。这种电池的总反应为 。
。
①锂电极的电势比石墨电极的________ (填“低”或“高”)。
②放电时,石墨电极发生________ (填“氧化”或“还原”)反应。
③电池的正极反应为________ 。
(1)二氧化氯具有杀菌、漂白、除臭、消毒、保鲜的功能。电解法制取
 的新工艺如图所示。
的新工艺如图所示。
①用石墨作电极,在一定条件下电解饱和食盐水制取
 (如图所示),阳极产生
(如图所示),阳极产生 的电极反应式为
的电极反应式为②电解一段时间,当阴极产生的气体体积为
 (标准状况)时,停止电解,则通过阳离子交换膜的阳离子的物质的量为
(标准状况)时,停止电解,则通过阳离子交换膜的阳离子的物质的量为 。
。(2)粗银精炼装置如图所示,电解液为稀硫酸。

①阳极的电极反应式为
②下列说法正确的是
a.一段时间后,阳极质量减小
b.阴极区可获得银单质的原理:

c.体系中存在沉淀溶解平衡:
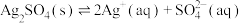
(3)一种用于心脏起搏器的微型电池具有容量大、寿命长和电压稳定等特点。该电池的电极材料是石墨和锂,电解质溶液为等物质的量的
 、
、 溶解在
溶解在 中形成的溶液。这种电池的总反应为
中形成的溶液。这种电池的总反应为 。
。①锂电极的电势比石墨电极的
②放电时,石墨电极发生
③电池的正极反应为
您最近一年使用:0次
名校
8 . Ⅰ.甲醇既是重要的化工原料,又可作为燃料。利用CO与H2反应合成甲醇,反应过程中能量变化如图所示:
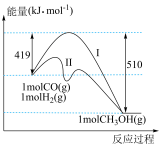
(1)请写出CO与 反应合成甲醇的热化学方程式
反应合成甲醇的热化学方程式________ 。
(2)该反应中相关的化学键键能数据如表所示,则CO中C≡O的键能为________  。
。
(3)图中曲线Ⅰ和Ⅱ所对应的反应路径,比较容易发生的是________ (填“Ⅰ”或“Ⅱ”).
(4)常温常压下,一定质量的液态甲醇完全燃烧生成二氧化碳和液态水,放出QkJ的热量,其燃烧生成的 用过量饱和石灰水吸收可得
用过量饱和石灰水吸收可得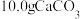 沉淀,则甲醇燃烧热的热化学方程式为
沉淀,则甲醇燃烧热的热化学方程式为________ 。
Ⅱ.实验室常取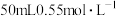 的NaOH溶液与
的NaOH溶液与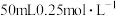 的硫酸溶液置于下图所示的简易装置中进行中和反应反应热的测定。
的硫酸溶液置于下图所示的简易装置中进行中和反应反应热的测定。
(5)从下图实验装置可知,缺少的一种仪器名称是________ 。

(6)上述实验数值结果比 小,原因可能是
小,原因可能是________ 。
a.实验装置保温、隔热效果差
b.用量筒量取硫酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度

(1)请写出CO与
 反应合成甲醇的热化学方程式
反应合成甲醇的热化学方程式(2)该反应中相关的化学键键能数据如表所示,则CO中C≡O的键能为
 。
。化学键 | H-H | C-O | H-O | C-H |
键能 | 436 | 343 | 465 | 413 |
(3)图中曲线Ⅰ和Ⅱ所对应的反应路径,比较容易发生的是
(4)常温常压下,一定质量的液态甲醇完全燃烧生成二氧化碳和液态水,放出QkJ的热量,其燃烧生成的
 用过量饱和石灰水吸收可得
用过量饱和石灰水吸收可得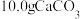 沉淀,则甲醇燃烧热的热化学方程式为
沉淀,则甲醇燃烧热的热化学方程式为Ⅱ.实验室常取
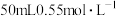 的NaOH溶液与
的NaOH溶液与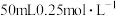 的硫酸溶液置于下图所示的简易装置中进行中和反应反应热的测定。
的硫酸溶液置于下图所示的简易装置中进行中和反应反应热的测定。(5)从下图实验装置可知,缺少的一种仪器名称是

(6)上述实验数值结果比
 小,原因可能是
小,原因可能是a.实验装置保温、隔热效果差
b.用量筒量取硫酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度
您最近一年使用:0次
2024-02-14更新
|
213次组卷
|
2卷引用:辽宁省丹东市2023-2024学年高二上学期期末考试化学试题
9 . 羟胺(NH2OH)在医药、农药等领域应用广泛.回答下列问题:
(1)已知:羟胺在水中主要以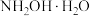 (弱碱)形式存在,电离方式与
(弱碱)形式存在,电离方式与 相似。将羟胺溶液加水稀释,
相似。将羟胺溶液加水稀释, 的值将
的值将________ (填“增大”“减小”或“不变”,下同), 的羟胺溶液中加入少量
的羟胺溶液中加入少量 固体,溶液pH
固体,溶液pH________ 。
(2)常温下,将 盐酸分别滴入
盐酸分别滴入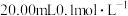 羟胺溶液和
羟胺溶液和 溶液中,测得溶液pOH[
溶液中,测得溶液pOH[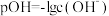 ]随滴入盐酸体积变化如图所示。
]随滴入盐酸体积变化如图所示。

①图中表示盐酸滴定羟胺溶液的曲线是________ (填“M”或“N”), 的点是
的点是________ (用a~f中的点表示).
②常温下, 电离平衡常数的值约为
电离平衡常数的值约为________ 。
③a、b、c、d四点对应的溶液中,水的电离程度由大到小的顺序为________ 。
④若将b、d点对应的溶液混合,则混合液呈________ 性(填“酸”“碱”或“中”),混合液中
________  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
⑤用 盐酸溶液滴定
盐酸溶液滴定 羟胺溶液的过程中,下列四种离子的物质的量浓度排序有可能出现的是
羟胺溶液的过程中,下列四种离子的物质的量浓度排序有可能出现的是________ 。
a.
b.
c.
(1)已知:羟胺在水中主要以
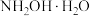 (弱碱)形式存在,电离方式与
(弱碱)形式存在,电离方式与 相似。将羟胺溶液加水稀释,
相似。将羟胺溶液加水稀释, 的值将
的值将 的羟胺溶液中加入少量
的羟胺溶液中加入少量 固体,溶液pH
固体,溶液pH(2)常温下,将
 盐酸分别滴入
盐酸分别滴入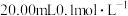 羟胺溶液和
羟胺溶液和 溶液中,测得溶液pOH[
溶液中,测得溶液pOH[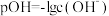 ]随滴入盐酸体积变化如图所示。
]随滴入盐酸体积变化如图所示。
①图中表示盐酸滴定羟胺溶液的曲线是
 的点是
的点是②常温下,
 电离平衡常数的值约为
电离平衡常数的值约为③a、b、c、d四点对应的溶液中,水的电离程度由大到小的顺序为
④若将b、d点对应的溶液混合,则混合液呈

 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。⑤用
 盐酸溶液滴定
盐酸溶液滴定 羟胺溶液的过程中,下列四种离子的物质的量浓度排序有可能出现的是
羟胺溶液的过程中,下列四种离子的物质的量浓度排序有可能出现的是a.

b.

c.

您最近一年使用:0次
10 . 电化学与能源、材料、化工等领域紧密联系,应用广泛.利用N2H4燃料电池电解AgNO3溶液并制备 ,装置如图所示(
,装置如图所示( 均为石墨电极,假设各装置在工作过程中溶液体积不变).
均为石墨电极,假设各装置在工作过程中溶液体积不变).
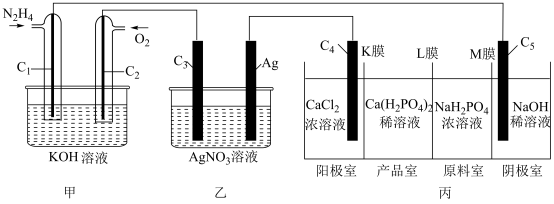
(1)工作时,甲装置 电极为
电极为________ (填“正”“负”“阳”或“阴”)极,电极反应式为________ 。
(2)工作时,乙装置中 向
向________ (填“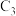 ”或“Ag”)极移动.
”或“Ag”)极移动.
(3)若乙装置中溶液体积为400mL,当电极质量增加4.32g时,溶液pH约为________ 。若将乙装置中两电极调换,一段时间后, 溶液浓度将
溶液浓度将________ (填“增大”“减小”或“不变”).
(4)丙装置中K、M、L为离子交换膜,其中M膜是________ (填“阳离子”“阴离子”或“质子”)交换膜.
(5)若甲装置 电极上消耗标准状况下2.24L的
电极上消耗标准状况下2.24L的 ,理论上丙装置阳极室溶液质量减少
,理论上丙装置阳极室溶液质量减少________ g.
 ,装置如图所示(
,装置如图所示( 均为石墨电极,假设各装置在工作过程中溶液体积不变).
均为石墨电极,假设各装置在工作过程中溶液体积不变).
(1)工作时,甲装置
 电极为
电极为(2)工作时,乙装置中
 向
向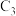 ”或“Ag”)极移动.
”或“Ag”)极移动.(3)若乙装置中溶液体积为400mL,当电极质量增加4.32g时,溶液pH约为
 溶液浓度将
溶液浓度将(4)丙装置中K、M、L为离子交换膜,其中M膜是
(5)若甲装置
 电极上消耗标准状况下2.24L的
电极上消耗标准状况下2.24L的 ,理论上丙装置阳极室溶液质量减少
,理论上丙装置阳极室溶液质量减少
您最近一年使用:0次