1 . 完成下列问题。
(1)一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸中直接加入纯化后的甲醇(CH3OH),同时向一个电极通入空气。
①此电池的正极发生的电极反应为_______ 。
②电解液中H+向_____ 极移动。
(2)如图所示,该装置通电5 min后,电极5的质量增加2.16 g,回答下列问题:____ 极,A池阴极电极反应:______ ,C池阳极电极反应:_______ 。
②如果B槽中共收集到224 mL气体(标准状况)且溶液体积为200 mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为______ 。
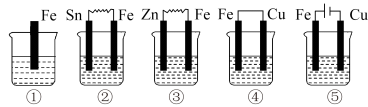
(3)下图各烧杯中盛有海水,铁在其中被腐蚀,腐蚀的速率由大到小的顺序为_____ 。______ 。
(1)一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸中直接加入纯化后的甲醇(CH3OH),同时向一个电极通入空气。
①此电池的正极发生的电极反应为
②电解液中H+向
(2)如图所示,该装置通电5 min后,电极5的质量增加2.16 g,回答下列问题:
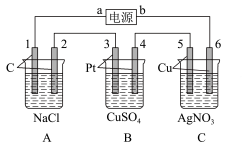
②如果B槽中共收集到224 mL气体(标准状况)且溶液体积为200 mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为
(3)下图各烧杯中盛有海水,铁在其中被腐蚀,腐蚀的速率由大到小的顺序为
您最近一年使用:0次
解题方法
2 . 用惰性电极电解下列电解质溶液:①硫酸;②盐酸;③NaOH溶液;④Na2SO4溶液;⑤CuCl2溶液;⑥NaCl溶液;⑦CuSO4溶液。请依据所学知识回答下列问题(填序号):
(1)写出电解下列溶液的化学方程式:
③_______________ ;
⑥________________ ;
⑦________________ 。
(2)只有水被电解的是______ ,只有电解质本身被电解的是______ ,电解质和水都被电解的是______ 。
(3)电解后溶液的pH显著增大的是______ ,减小的是______ 。
(4)欲使溶液⑥电解后复原需______ ,欲使电解后的⑦复原需加入______ 。
(1)写出电解下列溶液的化学方程式:
③
⑥
⑦
(2)只有水被电解的是
(3)电解后溶液的pH显著增大的是
(4)欲使溶液⑥电解后复原需
您最近一年使用:0次
解题方法
3 . 回答下列问题:
(1)将除去氧化膜的镁条插入到稀盐酸溶液中,发现生成氢气的速度变化情况如下图所示: 速度变化的主要原因
速度变化的主要原因______________ 。
② 速度变化的主要原因是
速度变化的主要原因是_____________ 。
(2)实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,其原因是____________ ;配制完毕后要加入少量铁屑,其目的是______________ 。
(1)将除去氧化膜的镁条插入到稀盐酸溶液中,发现生成氢气的速度变化情况如下图所示:
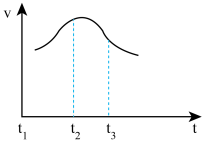
 速度变化的主要原因
速度变化的主要原因②
 速度变化的主要原因是
速度变化的主要原因是(2)实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,其原因是
您最近一年使用:0次
4 . 完成下列问题。
(1)某温度下,纯水中的c(OH-)=1×10-6 mol/L,则此时c(H+)为_____ mol/L。若在温度不变时,往其中滴加盐酸使 c(H+)=1×10-4mol/L,则溶液中c(OH-)为_____ mol/L。若将此盐酸稀释 1 000 倍,则溶液的c(H+)约为______ mol/L。
(2)已知:Cu(OH)2(s) Cu2+(aq)+2OH-(aq),Ksp=2×10-20。
Cu2+(aq)+2OH-(aq),Ksp=2×10-20。
①某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要使其生成 Cu(OH)2沉淀,应调整溶液的pH,使之大于_____ 。
②要使0.2 mol·L-1CuSO4溶液中的Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为_____ 。
(3)重金属离子会对河流和海洋造成严重污染。某化工厂废水(pH=2.0)中含有Ag+、Pb2+等重金属离子,其浓度约为0.01 mol/L,排放前拟用沉淀法除去这两种离子,查找有关数据如下:
①你认为往废水中加入_____ (填字母),沉淀效果最好。
A.NaOH B.Na2S C.KI D.Ca(OH)2
②如果用生石灰处理上述废水,使溶液的pH=8,处理后废水中c(Pb2+)=_____ 。
(1)某温度下,纯水中的c(OH-)=1×10-6 mol/L,则此时c(H+)为
(2)已知:Cu(OH)2(s)
 Cu2+(aq)+2OH-(aq),Ksp=2×10-20。
Cu2+(aq)+2OH-(aq),Ksp=2×10-20。①某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要使其生成 Cu(OH)2沉淀,应调整溶液的pH,使之大于
②要使0.2 mol·L-1CuSO4溶液中的Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为
(3)重金属离子会对河流和海洋造成严重污染。某化工厂废水(pH=2.0)中含有Ag+、Pb2+等重金属离子,其浓度约为0.01 mol/L,排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S |
| Ksp | 8.3×10-12 | 5.6×10-8 | 6.3×10-50 |
| 难溶电解质 | PbI2 | Pb(OH)2 | PbS |
| Ksp | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
A.NaOH B.Na2S C.KI D.Ca(OH)2
②如果用生石灰处理上述废水,使溶液的pH=8,处理后废水中c(Pb2+)=
您最近一年使用:0次
5 . 完成下列问题。
(1)已知在25 ℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示。
①亚硫酸发生电离的方程式为______ 。
②碳酸和亚硫酸的第一步电离程度大于第二步电离程度的原因:______ 。
③在相同条件下,试比较H2CO3、 和
和 的酸性强弱:
的酸性强弱:____ >____ >____ 。
(2)在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力变化如图所示,请回答:____ 。
②a、b、c三点溶液的pH由大到小的顺序为____ ,电离程度最大的是____ 。
③若使c点溶液中c(CH3COO-)增大,在如下措施中可选择____ (填字母)。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH
D.加水 E.加CH3COONa(s) F.加锌粉
(3)向氨水中加入醋酸溶液,其导电能力(I)与加入醋酸溶液的体积(V)关系正确的是______。
(1)已知在25 ℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示。
| 酸 | 电离平衡常数 |
| 醋酸 | Ka=1.75×10-5 |
| 碳酸 | Ka1=4.30×10-7 Ka2=5.61×10-11 |
| 亚硫酸 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
②碳酸和亚硫酸的第一步电离程度大于第二步电离程度的原因:
③在相同条件下,试比较H2CO3、
 和
和 的酸性强弱:
的酸性强弱:(2)在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力变化如图所示,请回答:
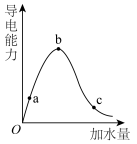
②a、b、c三点溶液的pH由大到小的顺序为
③若使c点溶液中c(CH3COO-)增大,在如下措施中可选择
A.加热 B.加很稀的NaOH溶液 C.加固体KOH
D.加水 E.加CH3COONa(s) F.加锌粉
(3)向氨水中加入醋酸溶液,其导电能力(I)与加入醋酸溶液的体积(V)关系正确的是______。
A.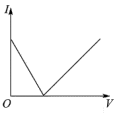 | B.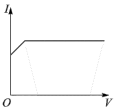 | C.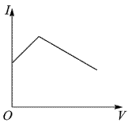 | D.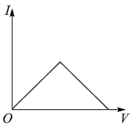 |
您最近一年使用:0次
名校
解题方法
6 . 根据化学反应速率和化学反应限度的知识回答下列问题:
Ⅰ.某温度时,在2 L容器中发生A、B两种物质间的转化反应,AB物质的量随时间变化的曲线如图所示:___________ 。
(2)反应开始至4 min时,A的平均反应速率为___________ 。
(3)4 min时,反应是否达平衡状态?___________ (填“是”或“否”),8 min时,v正___________ v逆。(填“>”“<”或“=”)
Ⅱ.氢气是合成氨的重要原料,合成氨反应的化学方程式为N2(g)+3H2(g) ⇌2NH3(g),该反应为放热反应,且每生成2 mol NH3,放出92.4 kJ的热量。当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。___________ 。
(5)在一定温度下,向一个容积为1 L的容器中通入2 mol氮气和
8 mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%。
①N2的转化率为___________ 。
②反应达到平衡时,放出的热量___________ (填字母,下同)。
A.小于92.4 kJ B.等于92.4 kJ
C.大于92.4 kJ D.可能大于、小于或等于92.4 kJ
(6)若该反应在绝热条件下进行,下列能证明反应已达化学平衡的为___________ 。
A.混合气体的平均相对分子质量
B.体系的温度不变
C.N2、H2、NH3的分子数之比为1:3:2
D.混合气体的密度不变
E.断开3 mol H-H键的同时断开2 mol N-H键
(7)反应达到平衡后,保持其他条件不变,t0时刻升高温度,请在图中画出 改变条件后至达到新平衡时v正、v逆的变化曲线并注明v正、v逆(在答题卡做答)__________
Ⅰ.某温度时,在2 L容器中发生A、B两种物质间的转化反应,AB物质的量随时间变化的曲线如图所示:
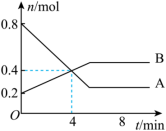
(2)反应开始至4 min时,A的平均反应速率为
(3)4 min时,反应是否达平衡状态?
Ⅱ.氢气是合成氨的重要原料,合成氨反应的化学方程式为N2(g)+3H2(g) ⇌2NH3(g),该反应为放热反应,且每生成2 mol NH3,放出92.4 kJ的热量。当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。

(5)在一定温度下,向一个容积为1 L的容器中通入2 mol氮气和
8 mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%。
①N2的转化率为
②反应达到平衡时,放出的热量
A.小于92.4 kJ B.等于92.4 kJ
C.大于92.4 kJ D.可能大于、小于或等于92.4 kJ
(6)若该反应在绝热条件下进行,下列能证明反应已达化学平衡的为
A.混合气体的平均相对分子质量
B.体系的温度不变
C.N2、H2、NH3的分子数之比为1:3:2
D.混合气体的密度不变
E.断开3 mol H-H键的同时断开2 mol N-H键
(7)反应达到平衡后,保持其他条件不变,t0时刻升高温度,请在图中画出 改变条件后至达到新平衡时v正、v逆的变化曲线并注明v正、v逆(在答题卡做答)

您最近一年使用:0次
2024-04-30更新
|
344次组卷
|
2卷引用:宁夏石嘴山市第三中学2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
7 . 运用化学反应原理研究化学反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3: ,混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
,混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。 ___________ (填“向左”“向右”或“不”)移动。
②若反应进行到状态D时,
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)课本里介绍的合成氨技术叫哈伯法: ,应用此法反应达到平衡时反应物的转化率不高。
,应用此法反应达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是___________ (填编号)。
A.使用更高效的催化剂 B.升高温度
C.减小体积 D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2 L的密闭容器中发生合成氨的反应,图2表示N2 的物质的量随时间的变化曲线。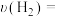
___________ 。从第11min起,扩大容器的体积为4 L,则n(N2) 的变化曲线为___________ (填编号)。
(3)实验室模拟用浓硫酸脱除氮氧化物,装置如图所示,实验开始后装置C中发生反应:NO+NO2+2H2SO4(浓)=2NOHSO4+H2O。___________ ,装置B的作用是___________ 。
②理论上应控制相同时间内a、b处通入气体的物质的量之比为___________ 。
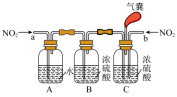
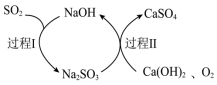
(4)可用双碱法(氢氧化钙为悬浊液)脱硫处理工业废气中的SO2,原理如图所示,双碱法脱硫的总反应方程式为___________ 。
(1)硫酸生产中,SO2催化氧化生成SO3:
 ,混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
,混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。 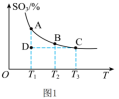
②若反应进行到状态D时,

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(2)课本里介绍的合成氨技术叫哈伯法:
 ,应用此法反应达到平衡时反应物的转化率不高。
,应用此法反应达到平衡时反应物的转化率不高。①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是
A.使用更高效的催化剂 B.升高温度
C.减小体积 D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2 L的密闭容器中发生合成氨的反应,图2表示N2 的物质的量随时间的变化曲线。
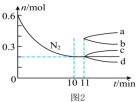
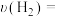
(3)实验室模拟用浓硫酸脱除氮氧化物,装置如图所示,实验开始后装置C中发生反应:NO+NO2+2H2SO4(浓)=2NOHSO4+H2O。
②理论上应控制相同时间内a、b处通入气体的物质的量之比为
(4)可用双碱法(氢氧化钙为悬浊液)脱硫处理工业废气中的SO2,原理如图所示,双碱法脱硫的总反应方程式为
您最近一年使用:0次
解题方法
8 . 依据氧化还原反应 设计的原电池如图所示。
设计的原电池如图所示。
(1)电极X的材料是___________ ,电解质溶液Y是___________ 。
(2)银电极的电极反应式是___________ ;X电极的电极反应式是___________ 。
(3)外电路中的电子是从___________ 极流向___________ 极。
 设计的原电池如图所示。
设计的原电池如图所示。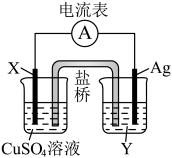
(1)电极X的材料是
(2)银电极的电极反应式是
(3)外电路中的电子是从
您最近一年使用:0次
9 . 下表是几种弱酸常温下的电离常数:
(1)写出 的电离方程式
的电离方程式___________ 。
(2) 四种酸的酸性由强到弱的顺序为
四种酸的酸性由强到弱的顺序为___________ 。
(3)写出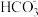 的水解方程式
的水解方程式___________ 。
(4)同浓度的 结合
结合 的能力由强到弱的顺序为
的能力由强到弱的顺序为___________ 。
 |  |  |  |
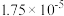 | 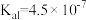 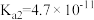 | 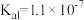 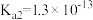 |  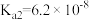 |
(1)写出
 的电离方程式
的电离方程式(2)
 四种酸的酸性由强到弱的顺序为
四种酸的酸性由强到弱的顺序为(3)写出
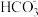 的水解方程式
的水解方程式(4)同浓度的
 结合
结合 的能力由强到弱的顺序为
的能力由强到弱的顺序为
您最近一年使用:0次
名校
解题方法
10 . 甲醇作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。
(1)甲醇可以替代汽油和柴油作为内燃机燃料。汽油的主要成分之一是辛烷[C8H18(l)]。已知:25°C、101 kPa 时,1 molC8H18(l)完全燃烧生成气态二氧化碳和液态水,放出5518kJ热量。该反应燃烧热的热化学方程式为_______ 。
(2)甲醇的合成以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。_________ 。
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的ΔH______ 。(填“变大”“变小”或“不变”)
(3)已知下列反应的焓变
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1= -870.3kJ/mol
②C(s)+O2(g) =CO2(g) ΔH2= -393.5kJ/mol
③2H2(g)+O2(g) =2H2O(l) ΔH3= -285.8kJ/mol
试计算反应2C(s)+2H2(g)+O2(g) =CH3COOH(l)的焓变ΔH=__________ 。
(1)甲醇可以替代汽油和柴油作为内燃机燃料。汽油的主要成分之一是辛烷[C8H18(l)]。已知:25°C、101 kPa 时,1 molC8H18(l)完全燃烧生成气态二氧化碳和液态水,放出5518kJ热量。该反应燃烧热的热化学方程式为
(2)甲醇的合成以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。
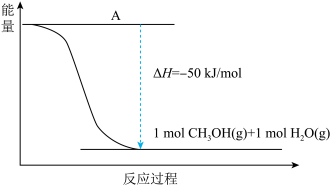
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的ΔH
(3)已知下列反应的焓变
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1= -870.3kJ/mol
②C(s)+O2(g) =CO2(g) ΔH2= -393.5kJ/mol
③2H2(g)+O2(g) =2H2O(l) ΔH3= -285.8kJ/mol
试计算反应2C(s)+2H2(g)+O2(g) =CH3COOH(l)的焓变ΔH=
您最近一年使用:0次



