1 . 丙烯(分子式为C3H6)是重要的有机化工原料,丙烷(分子式为C3H8)脱氢制丙烯具有显著的经济价值和社会意义。
(1)已知:Ⅰ.2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) △H=-238kJ·mol-1
Ⅱ.2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
则丙烷脱氢制丙烯反应C3H8(g) C3H6(g)+H2(g)的正反应的活化能为akJ·mol-1,则该反应的逆反应的活化能为
C3H6(g)+H2(g)的正反应的活化能为akJ·mol-1,则该反应的逆反应的活化能为_______ kJ·mol-1(用带有a的代数式表示)。
(2)一定温度下,向恒容密闭容器中充入2molC3H8,发生丙烷脱氢制丙烯反应,容器内起始压强为2×10-5Pa。
①欲提高丙烷转化率,采取的措施是_______ (填标号)。
A.升高温度 B.再充入1molC3H8 C.加催化剂 D.及时分离出H2
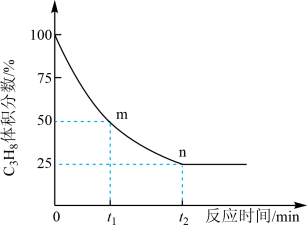
②丙烷脱氢制丙烯反应过程中,C3H8的气体体积分数与反应时间的关系如图所示_______ Pa(Kp是用反应体系中气体物质的分压表示的平衡常数,平衡分压=总压×物质的量分数)。
(3)若在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氢反应,起始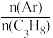 越大,丙烷的平衡转化率越大,其原因是
越大,丙烷的平衡转化率越大,其原因是_______ 。
(4)以丙烷(C3H8)为燃料制作新型燃料电池,电解质是熔融碳酸盐。则电池负极的电极反应式为_______ 。
(1)已知:Ⅰ.2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) △H=-238kJ·mol-1
Ⅱ.2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
则丙烷脱氢制丙烯反应C3H8(g)
 C3H6(g)+H2(g)的正反应的活化能为akJ·mol-1,则该反应的逆反应的活化能为
C3H6(g)+H2(g)的正反应的活化能为akJ·mol-1,则该反应的逆反应的活化能为(2)一定温度下,向恒容密闭容器中充入2molC3H8,发生丙烷脱氢制丙烯反应,容器内起始压强为2×10-5Pa。
①欲提高丙烷转化率,采取的措施是
A.升高温度 B.再充入1molC3H8 C.加催化剂 D.及时分离出H2
②丙烷脱氢制丙烯反应过程中,C3H8的气体体积分数与反应时间的关系如图所示
(3)若在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氢反应,起始
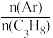 越大,丙烷的平衡转化率越大,其原因是
越大,丙烷的平衡转化率越大,其原因是(4)以丙烷(C3H8)为燃料制作新型燃料电池,电解质是熔融碳酸盐。则电池负极的电极反应式为
您最近一年使用:0次
2 . 2024年河南某地中考理化生实验操作考试的化学题目之一是配制50g溶质质量分数为2%的氯化钠溶液,配制该溶液需要1g氯化钠固体和_______ mL水;电解饱和食盐水生成一种碱、氯气( )和一种可燃性气体,请写出该反应的化学方程式:
)和一种可燃性气体,请写出该反应的化学方程式:______ 。
 )和一种可燃性气体,请写出该反应的化学方程式:
)和一种可燃性气体,请写出该反应的化学方程式:
您最近一年使用:0次
解题方法
3 . 硫酸是一种重要的化工产品。回答下列问题:
Ⅰ.实验室利用硫酸可以制备一系列气体。
(1)常温下,实验室制备下列气体选择的药品正确的是______(填标号)。
(2)实验室常用食盐和浓硫酸共热500℃制备HCl,另一种产物为正盐,该反应的化学方程式为________ 。不能用浓硫酸制备HBr、HI,其原因是__________________ 。
Ⅱ.硫酸是一种常用的酸性电解质。
(3)在Cu-Zn-H2SO4溶液构成的原电池中,物理量Y与转移电子的关系如图所示。
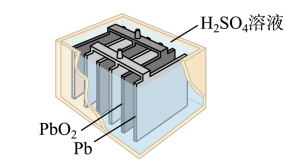
(4)铅蓄电池的装置如图所示。放电过程的电池反应:PbO2+Pb+2H2SO4=2PbSO4(难溶)+2H2O。________ (填化学式),该极发生_______ (填“氧化”或“还原”)反应。
②正极的电极反应式为______________ 。
③放电时,电解质溶液的pH________ (填“升高”“降低”或“不变”)。
Ⅰ.实验室利用硫酸可以制备一系列气体。
(1)常温下,实验室制备下列气体选择的药品正确的是______(填标号)。
| 选项 | 药品 | 气体 |
| A | FeS、稀硫酸 | H2S |
| B | Na2SO3、10%硫酸 | SO2 |
| C | 粗锌、浓硫酸 | H2 |
| D | 大理石、硫酸 | CO2 |
| A.A | B.B | C.C | D.D |
(2)实验室常用食盐和浓硫酸共热500℃制备HCl,另一种产物为正盐,该反应的化学方程式为
Ⅱ.硫酸是一种常用的酸性电解质。
(3)在Cu-Zn-H2SO4溶液构成的原电池中,物理量Y与转移电子的关系如图所示。
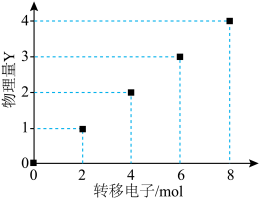
| A.n(Zn) | B.n(H2) | C.n( ) ) | D.n(Zn2+) |
(4)铅蓄电池的装置如图所示。放电过程的电池反应:PbO2+Pb+2H2SO4=2PbSO4(难溶)+2H2O。
②正极的电极反应式为
③放电时,电解质溶液的pH
您最近一年使用:0次
名校
解题方法
4 . 工业上,常用水蒸气通过炽热的焦炭制得水煤气(主要成分为CO和 ),其反应的化学方程式为
),其反应的化学方程式为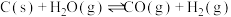 ,请回答下列问题:
,请回答下列问题:
(1)上述反应的能量变化图像如图所示。下列反应的能量变化与上述反应相同的是_______。
(2)一定条件下,焦炭和水蒸气在体积一定的密闭容器中进行反应,下列有关说法正确的是_______。
(3)在体积均为2L的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量炭粉和2.8mol水蒸气,在不同温度下反应的过程如图所示:
_______ 。
②甲容器中,
_______ 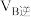 (填“<”“>”或“=”下同)。
(填“<”“>”或“=”下同)。
③反应过程中,两个容器温度:甲_______ 乙。
(4)乙容器中C点时,CO的物质的量百分数为_______ 。
 ),其反应的化学方程式为
),其反应的化学方程式为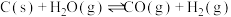 ,请回答下列问题:
,请回答下列问题:(1)上述反应的能量变化图像如图所示。下列反应的能量变化与上述反应相同的是_______。

| A.铝粉与氧化铁的反应 | B.氯化铵与 的反应 的反应 |
| C.锌片与稀硫酸的反应 | D.钠与冷水的反应 |
(2)一定条件下,焦炭和水蒸气在体积一定的密闭容器中进行反应,下列有关说法正确的是_______。
| A.充入He使容器压强增大,提高反应速率 |
B.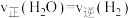 ,说明反应达到平衡状态 ,说明反应达到平衡状态 |
| C.容器中焦炭的质量不再变化,说明反应达到平衡状态 |
D.容器中水蒸气与氢气的体积比为 时,说明反应达到平衡状态 时,说明反应达到平衡状态 |
(3)在体积均为2L的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量炭粉和2.8mol水蒸气,在不同温度下反应的过程如图所示:
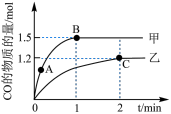
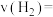
②甲容器中,
 (填“<”“>”或“=”下同)。
(填“<”“>”或“=”下同)。③反应过程中,两个容器温度:甲
(4)乙容器中C点时,CO的物质的量百分数为
您最近一年使用:0次
2024-05-03更新
|
290次组卷
|
2卷引用:河南省焦作市博爱县第一中学2023-2024学年高一下学期4月期中考试化学试题
5 . 根据下列装置图,回答有关问题:___________ ,该反应为可逆反应,其离子方程式为___________ 。
(2)装置乙中,直流电源a为___________ 极(填“正”或“负”),阳极反应式为___________ 。
(3)装置丙中,d试管内铁钉除发生化学腐蚀外,还发生了___________ (填“析氢腐蚀”或“吸氧腐蚀”),其腐蚀速率比c试管中铁钉的腐蚀速率___________ (“快”“慢”或“相等”),c试管内正极的电极反应式为___________ 。
(4)装置丁中,从交换膜右侧向左侧迁移的离子是___________ ,负极的电极反应式为___________ 。
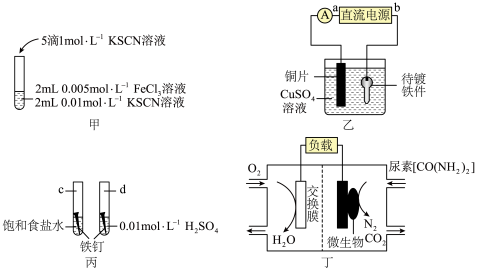
(2)装置乙中,直流电源a为
(3)装置丙中,d试管内铁钉除发生化学腐蚀外,还发生了
(4)装置丁中,从交换膜右侧向左侧迁移的离子是
您最近一年使用:0次
6 . 用相关化学反应原理解释下列问题:
(1)已知 的键能分别为
的键能分别为 ,写出工业合成氨的热化学方程式
,写出工业合成氨的热化学方程式___________ 。
(2)硫化铝(Al2S3)不能通过水溶液中的离子反应制取,其原因是___________ (用离子方程式表示)。
(3) 可用来净水的原因是
可用来净水的原因是___________ (用离子方程式表示)。
(4)氯碱工业中电解饱和食盐水的化学方程式为___________ 。
(5)已知 溶液显酸性,则该溶液中各离子浓度从大到小的顺序为
溶液显酸性,则该溶液中各离子浓度从大到小的顺序为___________ 。
(1)已知
 的键能分别为
的键能分别为 ,写出工业合成氨的热化学方程式
,写出工业合成氨的热化学方程式(2)硫化铝(Al2S3)不能通过水溶液中的离子反应制取,其原因是
(3)
 可用来净水的原因是
可用来净水的原因是(4)氯碱工业中电解饱和食盐水的化学方程式为
(5)已知
 溶液显酸性,则该溶液中各离子浓度从大到小的顺序为
溶液显酸性,则该溶液中各离子浓度从大到小的顺序为
您最近一年使用:0次
名校
解题方法
7 . 光催化是新发展的一个催化技术,TiO2是目前研究成功的应用广泛的光催化剂,它是由金红石矿(主要成分为TiO2)先制备为TiCl4,再转化为纯TiO2。
请根据表中数据作答:
(1)计算反应:TiO2(s) + 2Cl2(g)= TiCl4(g) + O2(g) 298K的ΔrΗΘm和ΔrSΘm,该反应能否正向进行___________ ?
(2)计算反应2C(s) + O2(g) = 2CO(g) 298K的ΔrΗΘm和ΔrSΘm,并判据反应在298K进行的方向___________ 。
(3)为得到纯的TiCl4,有人设计如下方案:TiO2(s) + 2Cl2(g) + 2C(s) = TiCl4(g ) + 2CO(g)。计算该反应298K的ΔrΗΘm和ΔrSΘm,并判据反应进行的方向___________ 。
| 物种 | TiO2(s) | TiCl4(g) | Cl2(g) | O2(g) | C(s) | CO(g) |
| ΔrΗΘm /kJ∙molˉ1 | –944.7 | –763.2 | 0 | 0 | 0 | –110.5 |
| SΘm/J∙molˉ1∙Kˉ1 | 55.02 | 354.9 | 223.1 | 205.1 | 5.74 | 197.7 |
(1)计算反应:TiO2(s) + 2Cl2(g)= TiCl4(g) + O2(g) 298K的ΔrΗΘm和ΔrSΘm,该反应能否正向进行
(2)计算反应2C(s) + O2(g) = 2CO(g) 298K的ΔrΗΘm和ΔrSΘm,并判据反应在298K进行的方向
(3)为得到纯的TiCl4,有人设计如下方案:TiO2(s) + 2Cl2(g) + 2C(s) = TiCl4(g ) + 2CO(g)。计算该反应298K的ΔrΗΘm和ΔrSΘm,并判据反应进行的方向
您最近一年使用:0次
8 . 电化学给人类的生活和工业生产带来极大的方便。回答下列问题:
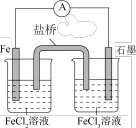
(1)如图所示的电池, 作
作___________ 极(填“正”或“负”)。盐桥由琼脂和饱和 溶液构成,盐桥中的
溶液构成,盐桥中的 往
往___________ (填“ ”或“石墨”电极移动。
”或“石墨”电极移动。
(2)高铁电池是一种新型可充电电池,总反应为: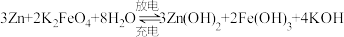 。
。
①放电时,负极电极反应为___________ 。
②充电时,阴极附近溶液的碱性___________ (填“增强”、“减弱”或“不变”)。
(3)用如图所示的装置研究电化学的相关问题(乙装置中X为阳离子交换膜)。

①甲装置中负极反应式为___________ 。
②乙装置中石墨电极上生成的气体为___________ (填化学式)。
③丙装置中 足量,工作一段时间后,溶液的
足量,工作一段时间后,溶液的
___________ (填“变大”、“变小”或“不变”)。
(1)如图所示的电池,
 作
作 溶液构成,盐桥中的
溶液构成,盐桥中的 往
往 ”或“石墨”电极移动。
”或“石墨”电极移动。
(2)高铁电池是一种新型可充电电池,总反应为:
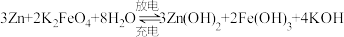 。
。①放电时,负极电极反应为
②充电时,阴极附近溶液的碱性
(3)用如图所示的装置研究电化学的相关问题(乙装置中X为阳离子交换膜)。

①甲装置中负极反应式为
②乙装置中石墨电极上生成的气体为
③丙装置中
 足量,工作一段时间后,溶液的
足量,工作一段时间后,溶液的
您最近一年使用:0次
9 .  常作食品加工中的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
常作食品加工中的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1) 可作净水剂,其原理是
可作净水剂,其原理是___________ (用离子方程式说明)。
(2)相同条件下, 溶液中的
溶液中的
___________ (填“等于”“大于”或“小于”) 溶液中的
溶液中的 。
。
(3)几种均为0.1mol⋅L-1的电解质溶液的pH随温度变化的曲线如图所示。

①其中符合 溶液的pH随温度变化的曲线是
溶液的pH随温度变化的曲线是___________ (填罗马数字)。
②20℃时, 溶液中
溶液中
___________  。(列计算式不必化简)
。(列计算式不必化简)
(4)室温时,向 溶液中滴加0.1mol·L-1NaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图所示。
溶液中滴加0.1mol·L-1NaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图所示。

①试分析图中a、b、c、d四个点,水的电离程度最大的是___________ 点。
②在b点,溶液中各离子浓度由大到小的排列顺序是___________ 。
③由b到c发生反应的离子方程式为___________ 。
 常作食品加工中的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
常作食品加工中的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:(1)
 可作净水剂,其原理是
可作净水剂,其原理是(2)相同条件下,
 溶液中的
溶液中的
 溶液中的
溶液中的 。
。(3)几种均为0.1mol⋅L-1的电解质溶液的pH随温度变化的曲线如图所示。

①其中符合
 溶液的pH随温度变化的曲线是
溶液的pH随温度变化的曲线是②20℃时,
 溶液中
溶液中
 。(列计算式不必化简)
。(列计算式不必化简)(4)室温时,向
 溶液中滴加0.1mol·L-1NaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图所示。
溶液中滴加0.1mol·L-1NaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图所示。
①试分析图中a、b、c、d四个点,水的电离程度最大的是
②在b点,溶液中各离子浓度由大到小的排列顺序是
③由b到c发生反应的离子方程式为
您最近一年使用:0次
10 . 常温下,浓度均为0.1mol/L的六种溶液:
① 溶液②
溶液② 溶液③盐酸④氨水⑤
溶液③盐酸④氨水⑤ ⑥
⑥
试回答下列问题:
(1)上述溶液中有水解反应发生的是___ (填编号,下同),溶液中溶质存在电离平衡的是_____ 。
(2)比较①、②溶液,pH值较大的是______ 。
(3)加热、蒸干、灼烧⑤后所得的产物是______ 。
(4)常温时,分别向20mL0.11mol/L⑥溶液和20mL0.1mol/L③中逐滴加入0.1mol/LNaOH溶液,其pH变化曲线如图所示(忽略温度变化)。
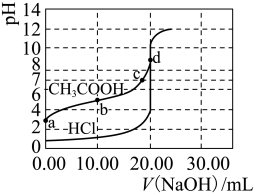
①a、b、c、d四点对应的溶液中,水的电离程度由大到小的顺序为:______ 。
②a点对应的溶液中存在关系式:
______ 0.1mol/L(填“>”、“<”或“=”下同),b点对应的溶液中:
______  。
。
(5)相同条件下,下列五种溶液中 由大到小的顺序是
由大到小的顺序是______ 。
①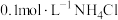 溶液②
溶液② 溶液③
溶液③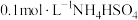 溶液④
溶液④ 氨水⑤
氨水⑤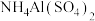 溶液
溶液
①
 溶液②
溶液② 溶液③盐酸④氨水⑤
溶液③盐酸④氨水⑤ ⑥
⑥
试回答下列问题:
(1)上述溶液中有水解反应发生的是
(2)比较①、②溶液,pH值较大的是
(3)加热、蒸干、灼烧⑤后所得的产物是
(4)常温时,分别向20mL0.11mol/L⑥溶液和20mL0.1mol/L③中逐滴加入0.1mol/LNaOH溶液,其pH变化曲线如图所示(忽略温度变化)。

①a、b、c、d四点对应的溶液中,水的电离程度由大到小的顺序为:
②a点对应的溶液中存在关系式:


 。
。(5)相同条件下,下列五种溶液中
 由大到小的顺序是
由大到小的顺序是①
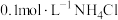 溶液②
溶液② 溶液③
溶液③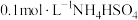 溶液④
溶液④ 氨水⑤
氨水⑤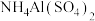 溶液
溶液
您最近一年使用:0次



