解题方法
1 . I.某温度下,在2 L的密闭容器中,X、Y、Z三种气体随时间变化的曲线如图所示。
(1)由图中数据分析:该反应的化学方程式为______________ 。
(2)反应开始至2 min,Z的平均反应速率为_____________ 。
(3)5 min时Z的生成速率与6 min时Z的生成速率相比较,前者________ 后者(填“大于”、“小于”或“等于”)。
(4)上述反应过程中,如果降低温度,则其反应速率________ (填“增大”、“减小”或“不变)。如果使用合适的催化剂,则其反应速率________ (填“增大”、“减小”或“不变)。
II.在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)⇌3C(g)+nD(g),开始时A为4mol,B为6mol,5min末时测得C的物质的量为3mol,D的化学反应速率v(D)=0.2mol/(L·min)。请回答:
(5)5min末A的物质的量浓度为______________ ;
(6)前5min内用B表示的化学反应速率v(B)为_____________ ;
(7)前5min内A的转化率为____________ ;(转化率是指某一反应物的转化百分率)
(8)化学方程式中n的值为_________ 。
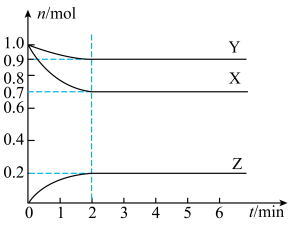
(1)由图中数据分析:该反应的化学方程式为
(2)反应开始至2 min,Z的平均反应速率为
(3)5 min时Z的生成速率与6 min时Z的生成速率相比较,前者
(4)上述反应过程中,如果降低温度,则其反应速率
II.在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)⇌3C(g)+nD(g),开始时A为4mol,B为6mol,5min末时测得C的物质的量为3mol,D的化学反应速率v(D)=0.2mol/(L·min)。请回答:
(5)5min末A的物质的量浓度为
(6)前5min内用B表示的化学反应速率v(B)为
(7)前5min内A的转化率为
(8)化学方程式中n的值为
您最近一年使用:0次
名校
2 . 按要求填空
(1)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡_______ (填“向左”“向右”或“不”)移动。试计算溶液中 =
=_______ (常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
(2)已知常温下,HCN的电离平衡常数Ka=6.2×10-10
①常温下,含等物质的量浓度的HCN与NaCN的混合溶液显_______ (填“酸”“碱”或“中”)性,c(CN-)_______ (填“>”“<”或“=”)c(HCN)。该溶液中各离子浓度由大到小的顺序为_______ 。
②常温下,若将c mol·L-1盐酸与0.62 mol·L-1 KCN溶液等体积混合后恰好得到中性溶液,则c=_______ (保留小数点后4位)。
(1)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡
 =
=(2)已知常温下,HCN的电离平衡常数Ka=6.2×10-10
①常温下,含等物质的量浓度的HCN与NaCN的混合溶液显
②常温下,若将c mol·L-1盐酸与0.62 mol·L-1 KCN溶液等体积混合后恰好得到中性溶液,则c=
您最近一年使用:0次
3 . 已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如表所示:
(1)醋酸在水溶液中的电离方程式为:_______ ,根据上表可知,酸性H2CO3_______ H2SO3(填“>”“<”或“=”,下同),在相同条件下,试比较同浓度Na2CO3、Na2SO3溶液的pH:Na2CO3_______ Na2SO3。
(2)向0.1mol/L的CH3COONa溶液中加入少量下列物质,其水解程度增大的是_______(填字母)。
(3)NaHSO3是中学化学常见的物质。HSO 在水溶液中存在两个平衡:
在水溶液中存在两个平衡:
HSO
 H+SO
H+SO Ka2
Ka2
HSO +H2O
+H2O H2SO3+OH- Kh2
H2SO3+OH- Kh2
已知25℃时,Ka2>Kh2,则0.1mol/L NaHSO3溶液:
①溶液呈_______ (填“酸性”“碱性”或“中性”)。
②溶液中 c(Na+)_______ c(HSO )。(填“>”“<”或“=”)
)。(填“>”“<”或“=”)
| 酸 | 电离平衡常数 |
| 醋酸 | K=1.75× 10-5 |
| 碳酸 | K1=4.5×10-7 K2=4.7×10-11 |
| 亚硫酸 | K1=1.4×10-2 K2=6.0×10-8 |
(2)向0.1mol/L的CH3COONa溶液中加入少量下列物质,其水解程度增大的是_______(填字母)。
| A.NaCl溶液 | B.Na2CO3固体 |
| C.NH4Cl溶液 | D.CH3COONa固体 |
 在水溶液中存在两个平衡:
在水溶液中存在两个平衡:HSO

 H+SO
H+SO Ka2
Ka2HSO
 +H2O
+H2O H2SO3+OH- Kh2
H2SO3+OH- Kh2已知25℃时,Ka2>Kh2,则0.1mol/L NaHSO3溶液:
①溶液呈
②溶液中 c(Na+)
 )。(填“>”“<”或“=”)
)。(填“>”“<”或“=”)
您最近一年使用:0次
解题方法
4 . 根据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s),设计的原电池如图所示,其中盐桥内装琼脂-饱和KNO3溶液。请回答下列问题:
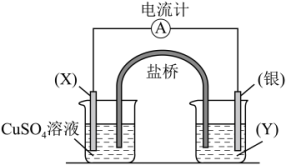
(1)电极X的材料是_______ ;(填化学式,下同)电解质溶液Y是 _______ 。
(2)Ag是_______ 极。填(“正”或“负”)
(3)写出两电极的电极反应式:银电极:_______ ;X电极:_______ 。
(4)外电路中的电子是从_______ 电极流向_______ 电极。(填电极材料名称)
(5)盐桥中向CuSO4溶液中迁移的离子是_______(填字母)。
(6)1 mol Ag生成时,转移电子的物质的量为_______ mol。

(1)电极X的材料是
(2)Ag是
(3)写出两电极的电极反应式:银电极:
(4)外电路中的电子是从
(5)盐桥中向CuSO4溶液中迁移的离子是_______(填字母)。
| A.K+ | B. | C.Ag+ | D. |
(6)1 mol Ag生成时,转移电子的物质的量为
您最近一年使用:0次
解题方法
5 . 根据原电池的工作原理分析判断(填写“正极”或“负极”)。
(1)由组成原电池的电极材料判断。一般是活动性较强的金属为_______ 极,活动性较弱的金属或能导电的非金属为_______ 极。
(2)根据电流方向或电子流动方向判断。电流由_______ 极流向_______ 极;电子由_______ 极流向_______ 极。
(3)根据原电池中电解质溶液内离子的移动方向判断。在原电池的电解质溶液内,阳离子移向_______ 极,阴离子移向_______ 极。
(1)由组成原电池的电极材料判断。一般是活动性较强的金属为
(2)根据电流方向或电子流动方向判断。电流由
(3)根据原电池中电解质溶液内离子的移动方向判断。在原电池的电解质溶液内,阳离子移向
您最近一年使用:0次
名校
解题方法
6 . 电化学在实际生活生产中十分常见,如环境保护,利用电化学进行物质制备等。回答下列问题:

(1)氯碱工业能耗大,通过如图改进的设计可大幅度降低能耗。
①离子交换膜应选择________ 离子交换膜(填“阴或“阳”)。
②反应的总化学方程式为________ ,电解一段时间后,右侧溶液质量_______ (填“增加”或“减少)。
(2)目前科学人员研究发现,用甲、乙电化学装置联合能够捕捉CO2。
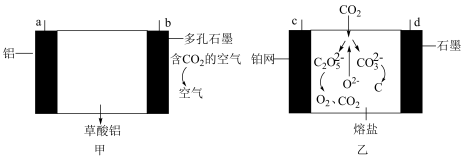
①装置甲的能量转化方式主要为________ 。
②装置甲的b电极采用多孔石墨的目的是_______ ;b电极的电极反应式为________ 。
③装置乙中的c电极与装置甲的_______ (填字母)电极相连接,c电极的电极反应式为_______ 。
④当生成1mol草酸铝时,甲、乙装置联合能够捕捉_______ molCO2。

(1)氯碱工业能耗大,通过如图改进的设计可大幅度降低能耗。
①离子交换膜应选择
②反应的总化学方程式为
(2)目前科学人员研究发现,用甲、乙电化学装置联合能够捕捉CO2。

①装置甲的能量转化方式主要为
②装置甲的b电极采用多孔石墨的目的是
③装置乙中的c电极与装置甲的
④当生成1mol草酸铝时,甲、乙装置联合能够捕捉
您最近一年使用:0次
2024-02-29更新
|
123次组卷
|
2卷引用:吉林省梅河口市第五中学2023-2024学年高二下学期开学化学试题
名校
7 . 三氯化氮是一种黄色油状液体,可用于漂白和杀菌。已知: 熔点为-40℃,沸点为70℃,95℃以上易爆炸,遇碱则迅速反应。在实验室可用
熔点为-40℃,沸点为70℃,95℃以上易爆炸,遇碱则迅速反应。在实验室可用 和
和 溶液反应制取
溶液反应制取 ,所用仪器如图所示(忽略部分夹持装置):
,所用仪器如图所示(忽略部分夹持装置):

回答下列问题:
(1)图D中仪器名称为_______ ;药品X为_______ ;A中反应的离子方程式为_______ ;根据气流方向,各仪器的连接顺序为_______ (用各接口字母表示,各接口所需橡胶塞已省略)。
(2)待观察到_______ 的现象,用止水夹夹住 间的橡胶管,控制水浴加热的温度范围为
间的橡胶管,控制水浴加热的温度范围为_______ ,将产品 蒸出。
蒸出。
(3)纯度测定: 的制取是可逆反应,根据反应
的制取是可逆反应,根据反应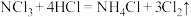 ,利用间接碘量法测定氯气的量即可测定
,利用间接碘量法测定氯气的量即可测定 的纯度。
的纯度。
实验步骤:
ⅰ.准确称量C中的产物0.5g置于三颈烧瓶中,加入10 足量浓盐酸,使用磁力搅拌器搅拌,并鼓入氮气;
足量浓盐酸,使用磁力搅拌器搅拌,并鼓入氮气;
ⅱ.将混合气通入200 0.1
0.1
 溶液中,待试管中无色液体变成黄色且颜色不再变化,关闭氮气(溶液体积变化忽略不计);
溶液中,待试管中无色液体变成黄色且颜色不再变化,关闭氮气(溶液体积变化忽略不计);
ⅲ.量取25.00 吸收液,加入淀粉指示剂,用0.1
吸收液,加入淀粉指示剂,用0.1
 标准液进行滴定,滴定至终点时消耗
标准液进行滴定,滴定至终点时消耗 溶液18.00
溶液18.00 。(已知:反应原理为
。(已知:反应原理为 )
)
①确定滴定终点的现象为_______ 。
② 的纯度为
的纯度为_______ 。(保留三位有效数字)
 熔点为-40℃,沸点为70℃,95℃以上易爆炸,遇碱则迅速反应。在实验室可用
熔点为-40℃,沸点为70℃,95℃以上易爆炸,遇碱则迅速反应。在实验室可用 和
和 溶液反应制取
溶液反应制取 ,所用仪器如图所示(忽略部分夹持装置):
,所用仪器如图所示(忽略部分夹持装置):
回答下列问题:
(1)图D中仪器名称为
(2)待观察到
 间的橡胶管,控制水浴加热的温度范围为
间的橡胶管,控制水浴加热的温度范围为 蒸出。
蒸出。(3)纯度测定:
 的制取是可逆反应,根据反应
的制取是可逆反应,根据反应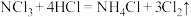 ,利用间接碘量法测定氯气的量即可测定
,利用间接碘量法测定氯气的量即可测定 的纯度。
的纯度。实验步骤:
ⅰ.准确称量C中的产物0.5g置于三颈烧瓶中,加入10
 足量浓盐酸,使用磁力搅拌器搅拌,并鼓入氮气;
足量浓盐酸,使用磁力搅拌器搅拌,并鼓入氮气;ⅱ.将混合气通入200
 0.1
0.1
 溶液中,待试管中无色液体变成黄色且颜色不再变化,关闭氮气(溶液体积变化忽略不计);
溶液中,待试管中无色液体变成黄色且颜色不再变化,关闭氮气(溶液体积变化忽略不计);ⅲ.量取25.00
 吸收液,加入淀粉指示剂,用0.1
吸收液,加入淀粉指示剂,用0.1
 标准液进行滴定,滴定至终点时消耗
标准液进行滴定,滴定至终点时消耗 溶液18.00
溶液18.00 。(已知:反应原理为
。(已知:反应原理为 )
)①确定滴定终点的现象为
②
 的纯度为
的纯度为
您最近一年使用:0次
名校
8 . Ⅰ.甲醇既是重要的化工原料,又可作为燃料。利用CO与H2反应合成甲醇,反应过程中能量变化如图所示:
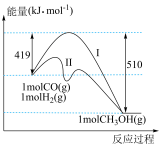
(1)请写出CO与 反应合成甲醇的热化学方程式
反应合成甲醇的热化学方程式________ 。
(2)该反应中相关的化学键键能数据如表所示,则CO中C≡O的键能为________  。
。
(3)图中曲线Ⅰ和Ⅱ所对应的反应路径,比较容易发生的是________ (填“Ⅰ”或“Ⅱ”).
(4)常温常压下,一定质量的液态甲醇完全燃烧生成二氧化碳和液态水,放出QkJ的热量,其燃烧生成的 用过量饱和石灰水吸收可得
用过量饱和石灰水吸收可得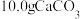 沉淀,则甲醇燃烧热的热化学方程式为
沉淀,则甲醇燃烧热的热化学方程式为________ 。
Ⅱ.实验室常取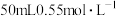 的NaOH溶液与
的NaOH溶液与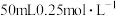 的硫酸溶液置于下图所示的简易装置中进行中和反应反应热的测定。
的硫酸溶液置于下图所示的简易装置中进行中和反应反应热的测定。
(5)从下图实验装置可知,缺少的一种仪器名称是________ 。

(6)上述实验数值结果比 小,原因可能是
小,原因可能是________ 。
a.实验装置保温、隔热效果差
b.用量筒量取硫酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度

(1)请写出CO与
 反应合成甲醇的热化学方程式
反应合成甲醇的热化学方程式(2)该反应中相关的化学键键能数据如表所示,则CO中C≡O的键能为
 。
。化学键 | H-H | C-O | H-O | C-H |
键能 | 436 | 343 | 465 | 413 |
(3)图中曲线Ⅰ和Ⅱ所对应的反应路径,比较容易发生的是
(4)常温常压下,一定质量的液态甲醇完全燃烧生成二氧化碳和液态水,放出QkJ的热量,其燃烧生成的
 用过量饱和石灰水吸收可得
用过量饱和石灰水吸收可得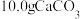 沉淀,则甲醇燃烧热的热化学方程式为
沉淀,则甲醇燃烧热的热化学方程式为Ⅱ.实验室常取
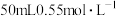 的NaOH溶液与
的NaOH溶液与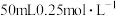 的硫酸溶液置于下图所示的简易装置中进行中和反应反应热的测定。
的硫酸溶液置于下图所示的简易装置中进行中和反应反应热的测定。(5)从下图实验装置可知,缺少的一种仪器名称是

(6)上述实验数值结果比
 小,原因可能是
小,原因可能是a.实验装置保温、隔热效果差
b.用量筒量取硫酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度
您最近一年使用:0次
2024-02-14更新
|
213次组卷
|
2卷引用:吉林省通化市梅河口市第五中学2023-2024学年高二上学期1月期末化学试题
名校
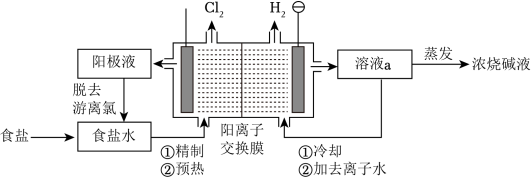
9 . 阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。生产流程如图所示:________ ,开始时_________ 极(阴、阳)碱性增强。
(2)实际生产中,阳离子交换膜的损伤会造成OH-迁移至阳极区,从而在电解池阳极能检测到O2,产生O2的电极反应式为___________ 。
(3)降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2,避免水电离的H+直接得电子生成H2,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为___________ 。
(4)电解结束后,能够脱去阳极液中游离氯的试剂或方法是___________ (填字母序号)。
a.Na2SO4 b.Na2SO3 c.热空气吹出 d.降低阳极区液面上方的气压
(5)食盐水中的I若进入电解槽,可被电解产生的Cl2氧化为ICl。ICl中碘元素的化合价为___________ ,根据原子的性质分析上述判断的理由:___________ 。
(2)实际生产中,阳离子交换膜的损伤会造成OH-迁移至阳极区,从而在电解池阳极能检测到O2,产生O2的电极反应式为
(3)降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2,避免水电离的H+直接得电子生成H2,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为
(4)电解结束后,能够脱去阳极液中游离氯的试剂或方法是
a.Na2SO4 b.Na2SO3 c.热空气吹出 d.降低阳极区液面上方的气压
(5)食盐水中的I若进入电解槽,可被电解产生的Cl2氧化为ICl。ICl中碘元素的化合价为
您最近一年使用:0次
2024-02-10更新
|
162次组卷
|
3卷引用:吉林省长春市东北师大附属中学2023-2024学年高二上学期 期末化学试卷
解题方法
10 . 在不同温度下的水溶液中离子浓度曲线如图所示。

(1)图中
_______  (填写“>”,“<”或“=”)
(填写“>”,“<”或“=”)
(2)C点溶液的性质_______ 。(填写“酸性”、“碱性”或“中性”)
(3)将D点变为E点,采取的措施是_______ 。
(4)在48 mL 0.1 mol/L 液中加入12 mL 0.4 mol/L KOH溶液,所得溶液呈_______。
液中加入12 mL 0.4 mol/L KOH溶液,所得溶液呈_______。
(5)用已知浓度HCl溶液滴定未知浓度NaOH溶液,选用酚酞做指示剂。

①滴定时,将酸性HCl标准液装在图中的_______ (填“甲”或“乙”)滴定管中。
②判断滴定终点到达时的现象为_______ 。
③若出现下列情况,测定结果偏高的是_______ (选填字母序号)
a.滴定前用蒸馏水冲洗锥形瓶
b.滴定过程中振荡锥形瓶时不慎将瓶内溶液溅出
c.滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管在滴定前有气泡,滴定后气泡消失

(1)图中

 (填写“>”,“<”或“=”)
(填写“>”,“<”或“=”)(2)C点溶液的性质
(3)将D点变为E点,采取的措施是
(4)在48 mL 0.1 mol/L
 液中加入12 mL 0.4 mol/L KOH溶液,所得溶液呈_______。
液中加入12 mL 0.4 mol/L KOH溶液,所得溶液呈_______。| A.弱酸性 | B.强酸性 | C.碱性 | D.中性 |
(5)用已知浓度HCl溶液滴定未知浓度NaOH溶液,选用酚酞做指示剂。

①滴定时,将酸性HCl标准液装在图中的
②判断滴定终点到达时的现象为
③若出现下列情况,测定结果偏高的是
a.滴定前用蒸馏水冲洗锥形瓶
b.滴定过程中振荡锥形瓶时不慎将瓶内溶液溅出
c.滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管在滴定前有气泡,滴定后气泡消失
您最近一年使用:0次



