1 . 乙烯和丙烯都是重要的化工原料,甲醇和丙烷共反应制备乙烯和丙烯可大幅度降低能耗,该反应体系中存在如下反应:
I.C3H8(g) C3H6(g)+H2(g) ΔH1=+124.20kJ/mol
C3H6(g)+H2(g) ΔH1=+124.20kJ/mol
Ⅱ.C3H8(g) CH4(g)+C2H4(g) ΔH2=+81.25 kJ/mol
CH4(g)+C2H4(g) ΔH2=+81.25 kJ/mol
Ⅲ.CH4(g)+C2H4(g) C3H6(g)+H2(g) ΔH3
C3H6(g)+H2(g) ΔH3
Ⅳ.CH3OH(g)+H2(g) CH4(g)+H2O(g) ΔH4=-115.93 kJ/mol
CH4(g)+H2O(g) ΔH4=-115.93 kJ/mol
(1)ΔH3=___________ 。
(2)630℃时,向盛有催化剂的真空容器中充入1molC3H8(g),保持容器压强为0.1MPa,进行反应,当反应达到平衡时,C3H8(g)的转化率为60%,C2H4(g)的平衡分压为0.0125MPa。
①此时p(C3H6)=___________ ,反应Ⅱ的分压平衡常数为Kp=___________ MPa。
②若向上述平衡体系中充入N2(g),再次达到平衡时C3H8(g)的转化率___________ (填“>”“<”或“=”)60%,其原因为___________ 。此时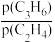 将会
将会___________ (填“变大”“变小”或“不变”)。
(3)若向盛有催化剂的真空容器中按物质的量之比4:1:1充入C3H8(g)、CH3OH(g)和H2O(g),仍在容器压强为0.1MPa下进行反应,平衡体系中C2H4(g)和C3H6(g)的体积分数随温度(T)的变化如图所示。解释300℃后,C3H6(g)的体积分数随温度(T)的变化的原因为___________ ;甲醇的作用为___________ 。
I.C3H8(g)
 C3H6(g)+H2(g) ΔH1=+124.20kJ/mol
C3H6(g)+H2(g) ΔH1=+124.20kJ/molⅡ.C3H8(g)
 CH4(g)+C2H4(g) ΔH2=+81.25 kJ/mol
CH4(g)+C2H4(g) ΔH2=+81.25 kJ/molⅢ.CH4(g)+C2H4(g)
 C3H6(g)+H2(g) ΔH3
C3H6(g)+H2(g) ΔH3Ⅳ.CH3OH(g)+H2(g)
 CH4(g)+H2O(g) ΔH4=-115.93 kJ/mol
CH4(g)+H2O(g) ΔH4=-115.93 kJ/mol(1)ΔH3=
(2)630℃时,向盛有催化剂的真空容器中充入1molC3H8(g),保持容器压强为0.1MPa,进行反应,当反应达到平衡时,C3H8(g)的转化率为60%,C2H4(g)的平衡分压为0.0125MPa。
①此时p(C3H6)=
②若向上述平衡体系中充入N2(g),再次达到平衡时C3H8(g)的转化率
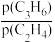 将会
将会(3)若向盛有催化剂的真空容器中按物质的量之比4:1:1充入C3H8(g)、CH3OH(g)和H2O(g),仍在容器压强为0.1MPa下进行反应,平衡体系中C2H4(g)和C3H6(g)的体积分数随温度(T)的变化如图所示。解释300℃后,C3H6(g)的体积分数随温度(T)的变化的原因为
您最近一年使用:0次
解题方法
2 . 依据叙述,按要求填空
(1)在25℃、101kPa下,1g甲醇(CH3OH液态)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________ 。
(2)11.2L(标准状况)H2在足量Cl2中燃烧生成HCl气体,放出91.5kJ热量,其热化学方程式:___________ 。
(3)已知1molC(石墨,s)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3kJ热量,请写出该反应的热化学方程式:___________ 。
(4)甲醛(HCHO)俗称蚁醛,是一种重要的化工原料。可通过以下方法将甲醇转化为甲醛。
脱氢法:CH3OH(g)=HCHO(g)+H2(g) △H1=+92.09kJ/mol
氧化法:CH3OH(g)+ O2(g)=HCHOg+H2O(g) △H2
O2(g)=HCHOg+H2O(g) △H2
已知:2H2(g)+O2(g)=2H2O(g) △H3=-483.64kJ/mol,则△H2=___________ 。
(1)在25℃、101kPa下,1g甲醇(CH3OH液态)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为
(2)11.2L(标准状况)H2在足量Cl2中燃烧生成HCl气体,放出91.5kJ热量,其热化学方程式:
(3)已知1molC(石墨,s)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3kJ热量,请写出该反应的热化学方程式:
(4)甲醛(HCHO)俗称蚁醛,是一种重要的化工原料。可通过以下方法将甲醇转化为甲醛。
脱氢法:CH3OH(g)=HCHO(g)+H2(g) △H1=+92.09kJ/mol
氧化法:CH3OH(g)+
 O2(g)=HCHOg+H2O(g) △H2
O2(g)=HCHOg+H2O(g) △H2已知:2H2(g)+O2(g)=2H2O(g) △H3=-483.64kJ/mol,则△H2=
您最近一年使用:0次
3 . 河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和农田灌溉间接危及人体健康。请回答下列问题。
已知在25℃和T℃时,水的电离平衡曲线如图所示:___________ (填“>”“<”“=”)25℃。
(2)图中四点 间的大小关系:
间的大小关系:___________ (用A、B、C、D表示)。
(3)在新制氯水中加入少量 固体,水的电离平衡移动
固体,水的电离平衡移动___________ (填“向左”“向右”或“不”)。
(4)25℃时,0.1 浓度的
浓度的 溶液与a
溶液与a 醋酸溶液等体积混合后
醋酸溶液等体积混合后 ,醋酸的电离常数为
,醋酸的电离常数为___________ (用含a的式子表示)。
(5)T℃时,将 的
的 溶液与
溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 (忽略溶液混合时的体积变化),则
(忽略溶液混合时的体积变化),则 溶液与
溶液与 溶液的体积比为
溶液的体积比为___________ 。
(6) ,25℃时,1.0
,25℃时,1.0
 溶液的
溶液的 约等于
约等于___________ (已知 )。将浓度相等的
)。将浓度相等的 与
与 溶液等体积混合,判断溶液呈
溶液等体积混合,判断溶液呈___________ (填“酸”、“碱”或“中”性,并结合有关数据解释原因:___________ 。
已知在25℃和T℃时,水的电离平衡曲线如图所示:

(2)图中四点
 间的大小关系:
间的大小关系:(3)在新制氯水中加入少量
 固体,水的电离平衡移动
固体,水的电离平衡移动(4)25℃时,0.1
 浓度的
浓度的 溶液与a
溶液与a 醋酸溶液等体积混合后
醋酸溶液等体积混合后 ,醋酸的电离常数为
,醋酸的电离常数为(5)T℃时,将
 的
的 溶液与
溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 (忽略溶液混合时的体积变化),则
(忽略溶液混合时的体积变化),则 溶液与
溶液与 溶液的体积比为
溶液的体积比为(6)
 ,25℃时,1.0
,25℃时,1.0
 溶液的
溶液的 约等于
约等于 )。将浓度相等的
)。将浓度相等的 与
与 溶液等体积混合,判断溶液呈
溶液等体积混合,判断溶液呈
您最近一年使用:0次
名校
4 . 回答下列问题。
(1)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是 KOH。通甲烷一极是电池的___________ 极发生___________ 反应。___________ ,工作时电池电解质溶液的碱性___________ (填“增强”、“减弱”或“不变”)。
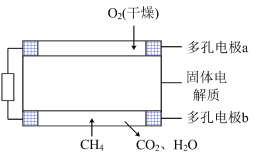
(3)固体氧化物甲烷燃料电池以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。___________ 极移动。
②b电极的电极反应式为:___________ 。
③电池的总反应方程式为:___________ 。当电路中有2mol电子转移时,理论上负极消耗的气体在标况下的体积是___________ L。
(1)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是 KOH。通甲烷一极是电池的
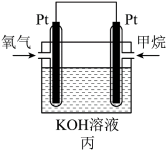
(3)固体氧化物甲烷燃料电池以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。
②b电极的电极反应式为:
③电池的总反应方程式为:
您最近一年使用:0次
5 . 为了有效减少碳排放,我们可利用 制备“合成气”(CO、
制备“合成气”(CO、 )、甲醇、二甲醚等产品,进行资源化应用。
)、甲醇、二甲醚等产品,进行资源化应用。
利用 合成二甲醚有两种工艺。
合成二甲醚有两种工艺。
工艺1:涉及以下主要反应:
Ⅰ.甲醇的合成:
 ;
;
Ⅱ.逆水汽变换:
 ;
;
Ⅲ.甲醇脱水:
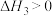 。
。
工艺2:利用 直接加氢合成
直接加氢合成 (反应Ⅳ)。
(反应Ⅳ)。
(1)①写出反应Ⅳ的热化学方程式:________ 。(反应热用上述反应的 表示)。
表示)。
②恒温恒容情况下,下列说法能判断反应Ⅳ达到平衡的是________ (填字母)。
A.气体物质中碳元素与氧元素的质量比不变
B.容器内压强不变
C.容器内气体密度不变
D.容器内 浓度保持不变
浓度保持不变
(2)工艺1需先合成甲醇。在不同压强下,按照 投料合成甲醇,实验测定
投料合成甲醇,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系分别如下图所示。
的平衡产率随温度的变化关系分别如下图所示。________ 。
A.图甲纵坐标表示 的平衡产率
的平衡产率
B.
C.为了同时提高 的平衡转化率和
的平衡转化率和 的平衡产率,应选择低温、高压条件
的平衡产率,应选择低温、高压条件
D.一定温度、压强下,提高 的平衡转化率的主要方向是寻找活性更高的催化剂
的平衡转化率的主要方向是寻找活性更高的催化剂
②图乙中,某温度时,三条曲线几乎交于一点的原因是________ 。
(3)对于反应
 ,反应速率
,反应速率 ,其中
,其中 、
、 分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。
分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。
①降低温度,
________ (填“增大”“减小”或“不变”)。
②在TK、101kPa下,按照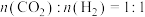 投料,
投料, 转化率为50%时,
转化率为50%时, ,用气体分压表示的平衡常数
,用气体分压表示的平衡常数
________ (保留小数点后一位)。
(4)将 通入一定浓度的
通入一定浓度的 溶液至饱和,通电后在电极上反应生成
溶液至饱和,通电后在电极上反应生成 ,原理如图所示(阴、阳极区溶液均为
,原理如图所示(阴、阳极区溶液均为 溶液)。生成尿素的电极反应式为
溶液)。生成尿素的电极反应式为________ 。
 制备“合成气”(CO、
制备“合成气”(CO、 )、甲醇、二甲醚等产品,进行资源化应用。
)、甲醇、二甲醚等产品,进行资源化应用。利用
 合成二甲醚有两种工艺。
合成二甲醚有两种工艺。工艺1:涉及以下主要反应:
Ⅰ.甲醇的合成:

 ;
;Ⅱ.逆水汽变换:

 ;
;Ⅲ.甲醇脱水:

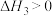 。
。工艺2:利用
 直接加氢合成
直接加氢合成 (反应Ⅳ)。
(反应Ⅳ)。(1)①写出反应Ⅳ的热化学方程式:
 表示)。
表示)。②恒温恒容情况下,下列说法能判断反应Ⅳ达到平衡的是
A.气体物质中碳元素与氧元素的质量比不变
B.容器内压强不变
C.容器内气体密度不变
D.容器内
 浓度保持不变
浓度保持不变(2)工艺1需先合成甲醇。在不同压强下,按照
 投料合成甲醇,实验测定
投料合成甲醇,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系分别如下图所示。
的平衡产率随温度的变化关系分别如下图所示。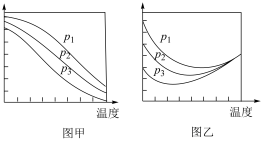
A.图甲纵坐标表示
 的平衡产率
的平衡产率B.
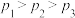
C.为了同时提高
 的平衡转化率和
的平衡转化率和 的平衡产率,应选择低温、高压条件
的平衡产率,应选择低温、高压条件D.一定温度、压强下,提高
 的平衡转化率的主要方向是寻找活性更高的催化剂
的平衡转化率的主要方向是寻找活性更高的催化剂②图乙中,某温度时,三条曲线几乎交于一点的原因是
(3)对于反应

 ,反应速率
,反应速率 ,其中
,其中 、
、 分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。
分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。①降低温度,

②在TK、101kPa下,按照
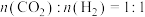 投料,
投料, 转化率为50%时,
转化率为50%时, ,用气体分压表示的平衡常数
,用气体分压表示的平衡常数
(4)将
 通入一定浓度的
通入一定浓度的 溶液至饱和,通电后在电极上反应生成
溶液至饱和,通电后在电极上反应生成 ,原理如图所示(阴、阳极区溶液均为
,原理如图所示(阴、阳极区溶液均为 溶液)。生成尿素的电极反应式为
溶液)。生成尿素的电极反应式为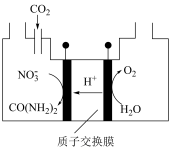
您最近一年使用:0次
名校
解题方法
6 . 断开气态物质中1mol某种共价键生成气态原子需要吸收的能量,就是该共价键的键能。共价键的键能越大,该共价键越牢固。部分共价键的键能如下表所示,请回答下列问题:
(1) 的电子式为
的电子式为__________ ,其含有的共价键类型为__________ 共价键。
(2)实验室用 与盐酸制
与盐酸制 时,反应的离子方程式为
时,反应的离子方程式为__________ ;(填“>”“<”或“=”)热稳定性:
__________  。
。
(3) 与
与 生成
生成 的热化学方程式为
的热化学方程式为__________ ;该反应若生成 ,共
,共__________ (填“吸收”或“放出”)kJ能量; 与
与 在一定条件下可以生成两种无害的物质,该反应的化学方程式为
在一定条件下可以生成两种无害的物质,该反应的化学方程式为__________ 。
共价键 | 键能/( | 共价键 | 键能/( |
| 436 |
| 391 |
| 242.7 |
| 497 |
| 193.7 |
| 942 |
| 463 |
| 347.7 |
 的电子式为
的电子式为(2)实验室用
 与盐酸制
与盐酸制 时,反应的离子方程式为
时,反应的离子方程式为
 。
。(3)
 与
与 生成
生成 的热化学方程式为
的热化学方程式为 ,共
,共 与
与 在一定条件下可以生成两种无害的物质,该反应的化学方程式为
在一定条件下可以生成两种无害的物质,该反应的化学方程式为
您最近一年使用:0次
7 . 恒温下在2L密闭容器中,X、Y、Z三种气态物质的量随时间变化曲线如图。

(1)该反应的化学方程式为________ 。
(2)从开始至5min,Y的平均反应速率为________ ;平衡时,Z的物质的量浓度为________ ,X的转化率为________ 。
(3)反应达平衡时体系的压强是开始时的________ 倍。
(4)下列描述中能表明反应已达到平衡状态的是________ (填序号)。
①容器内温度不变 ②混合气体的密度不变 ③混合气体的压强不变
④混合气体的平均相对分子质量不变 ⑤Z 的物质的量浓度不变
的物质的量浓度不变
⑥容器内X、Y、Z三种气体的浓度之比为3:1:2
⑦某时刻 且不等于零 ⑧单位时间内生成2nmolZ,同时生成3nmolX
且不等于零 ⑧单位时间内生成2nmolZ,同时生成3nmolX
(5)在某一时刻采取下列措施能加快反应速率的是________。

(1)该反应的化学方程式为
(2)从开始至5min,Y的平均反应速率为
(3)反应达平衡时体系的压强是开始时的
(4)下列描述中能表明反应已达到平衡状态的是
①容器内温度不变 ②混合气体的密度不变 ③混合气体的压强不变
④混合气体的平均相对分子质量不变 ⑤Z
 的物质的量浓度不变
的物质的量浓度不变⑥容器内X、Y、Z三种气体的浓度之比为3:1:2
⑦某时刻
 且不等于零 ⑧单位时间内生成2nmolZ,同时生成3nmolX
且不等于零 ⑧单位时间内生成2nmolZ,同时生成3nmolX(5)在某一时刻采取下列措施能加快反应速率的是________。
| A.加催化剂 | B.降低温度 |
| C.体积不变,充入X | D.体积不变,从容器中分离出Y |
您最近一年使用:0次
8 . 按要求回答下列问题:
(1)配制FeCl3溶液时,需将固体溶于较浓的盐酸后按需要进行稀释,用离子方程式解释其原因_______ 。
(2)已知 浓度相同的溶液中,其pH如下:
浓度相同的溶液中,其pH如下:
①若向该溶液中滴加NaOH溶液,则先沉淀的是_______ (填氢氧化物化学式)。
②如何除去氯化铜溶液中混有少量的氯化铁_______ 。
③若使氢氧化铁完全沉淀,氢氧化铜不产生沉淀,溶液的pH至少为多少_______ 。
(1)配制FeCl3溶液时,需将固体溶于较浓的盐酸后按需要进行稀释,用离子方程式解释其原因
(2)已知
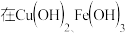 浓度相同的溶液中,其pH如下:
浓度相同的溶液中,其pH如下:| 氢氧化物 | 开始沉淀时的pH值 | 沉淀完全时的pH值 |
 | 4.67 | 6.67 |
 | 1.48 | 2.81 |
②如何除去氯化铜溶液中混有少量的氯化铁
③若使氢氧化铁完全沉淀,氢氧化铜不产生沉淀,溶液的pH至少为多少
您最近一年使用:0次
解题方法
9 . 写出下列热化学方程式
(1)25℃、101kPa下,强酸、强碱的稀溶液发生中和反应生成1molH2O(l)时,放出57.3kJ的热量,其热化学方程式可表示为:_______ 。
(2)已知:N2(g)+3H2(g)⇌2NH3(g) ΔH=-92kJ·mol-1,请写出2molNH3分解对应的热化学方程式:_______ 。
(1)25℃、101kPa下,强酸、强碱的稀溶液发生中和反应生成1molH2O(l)时,放出57.3kJ的热量,其热化学方程式可表示为:
(2)已知:N2(g)+3H2(g)⇌2NH3(g) ΔH=-92kJ·mol-1,请写出2molNH3分解对应的热化学方程式:
您最近一年使用:0次
解题方法
10 . 按要求写出下列离子方程式
(1)(NH4)2SO4水解:_______ 。
(2)NaHCO3水解:_______ 。
(3)Ag2CrO4沉淀溶解平衡:_______ 。
(4)氢氧燃料电池(酸性):已知总电极反应式为H2+ O2=H2O。则负极反应式:
O2=H2O。则负极反应式:_______ 、正极反应式_______ 。
(5)已知AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。向AgCl和水形成的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:
①写出白色固体转化为黑色固体的化学方程式:_______ 。
②简要说明白色固体转化为黑色固体的原因:_______ 。
(1)(NH4)2SO4水解:
(2)NaHCO3水解:
(3)Ag2CrO4沉淀溶解平衡:
(4)氢氧燃料电池(酸性):已知总电极反应式为H2+
 O2=H2O。则负极反应式:
O2=H2O。则负极反应式:(5)已知AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。向AgCl和水形成的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:
①写出白色固体转化为黑色固体的化学方程式:
②简要说明白色固体转化为黑色固体的原因:
您最近一年使用:0次

 )
)









