名校
解题方法
1 . 零价铁活化过硫酸盐耦合类芬顿体系可以产生强氧化性的羟基自由基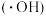 和硫酸根自由基(
和硫酸根自由基( ),被用于氧化降解废水中的抗生素。
),被用于氧化降解废水中的抗生素。
(1)该体系中产生自由基的机理如图所示。 在碱性溶液中可转化为
在碱性溶液中可转化为 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(2)为探究体系中 和
和 降解抗生素的能力,设计了自由基猝灭实验。
降解抗生素的能力,设计了自由基猝灭实验。 是
是 和
和 的猝灭剂,能与
的猝灭剂,能与 、
、 快速反应;
快速反应;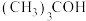 是
是 的猝灭剂,难和
的猝灭剂,难和 反应。零价铁活化过硫酸盐耦合类芬顿体系处理废水时分别加入上述猝灭剂,抗生素残留率与时间的关系如图所示。
反应。零价铁活化过硫酸盐耦合类芬顿体系处理废水时分别加入上述猝灭剂,抗生素残留率与时间的关系如图所示。 反应的原理是
反应的原理是 拔走了甲醇中的一个H原子,生成一个新的自由基,可能产物的相对能量如图所示,该反应最有可能的方程式为
拔走了甲醇中的一个H原子,生成一个新的自由基,可能产物的相对能量如图所示,该反应最有可能的方程式为___________ 。___________ 。
③降解抗生素的自由基主要是哪个,简述理由___________ 。
(3)探究 (PDS)的物质的量分数对抗生素去除率的影响。在
(PDS)的物质的量分数对抗生素去除率的影响。在 的废水中,PDS和H2O2总浓度为
的废水中,PDS和H2O2总浓度为 ,相同时间内,PDS的物质的量分数与抗生素残留率的关系如图所示。
,相同时间内,PDS的物质的量分数与抗生素残留率的关系如图所示。___________ 。
②PDS的物质的量分数降到0%时,抗生素残留率升高的原因是___________ 。
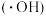 和硫酸根自由基(
和硫酸根自由基( ),被用于氧化降解废水中的抗生素。
),被用于氧化降解废水中的抗生素。(1)该体系中产生自由基的机理如图所示。

① 的结构为
的结构为 ,
, 的结构式为
的结构式为
 在碱性溶液中可转化为
在碱性溶液中可转化为 ,该反应的离子方程式为
,该反应的离子方程式为(2)为探究体系中
 和
和 降解抗生素的能力,设计了自由基猝灭实验。
降解抗生素的能力,设计了自由基猝灭实验。 是
是 和
和 的猝灭剂,能与
的猝灭剂,能与 、
、 快速反应;
快速反应;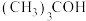 是
是 的猝灭剂,难和
的猝灭剂,难和 反应。零价铁活化过硫酸盐耦合类芬顿体系处理废水时分别加入上述猝灭剂,抗生素残留率与时间的关系如图所示。
反应。零价铁活化过硫酸盐耦合类芬顿体系处理废水时分别加入上述猝灭剂,抗生素残留率与时间的关系如图所示。
 反应的原理是
反应的原理是 拔走了甲醇中的一个H原子,生成一个新的自由基,可能产物的相对能量如图所示,该反应最有可能的方程式为
拔走了甲醇中的一个H原子,生成一个新的自由基,可能产物的相对能量如图所示,该反应最有可能的方程式为
③降解抗生素的自由基主要是哪个,简述理由
(3)探究
 (PDS)的物质的量分数对抗生素去除率的影响。在
(PDS)的物质的量分数对抗生素去除率的影响。在 的废水中,PDS和H2O2总浓度为
的废水中,PDS和H2O2总浓度为 ,相同时间内,PDS的物质的量分数与抗生素残留率的关系如图所示。
,相同时间内,PDS的物质的量分数与抗生素残留率的关系如图所示。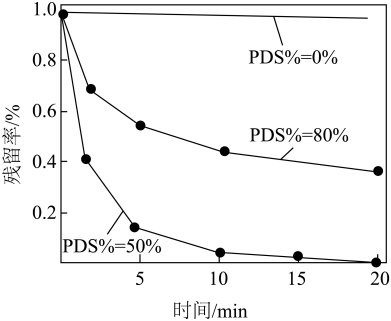
②PDS的物质的量分数降到0%时,抗生素残留率升高的原因是
您最近一年使用:0次
名校
解题方法
2 . 研发二氧化碳的利用技术具有重要意义。
(1)利用CO2加氢制备CH3OH是人工固碳的途径之一。已知:
反应I:CO2(g)+3H2(g) CH3OH(g)+ H2O(g) ΔH1
CH3OH(g)+ H2O(g) ΔH1
反应Ⅱ:CO2(g)+H2(g) CO(g)+ H2O(g) ΔH2=41 kJ·mol-1
CO(g)+ H2O(g) ΔH2=41 kJ·mol-1
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) ΔH3= -90 kJ·mol-1
CH3OH(g) ΔH3= -90 kJ·mol-1
ΔH1=_______ kJ·mol-1;
(2)CO2浓度小于20%时适宜用化学吸附,下列为室温下化学吸附方法之一,化学方程式为Ca(OH)2+H2CO3=CaCO3+2H2O,反应的平衡常数为_______ 。(已知Ka1(H2CO3)=4×10-7,Ka2(H2CO3)=5×10-11,Ksp[Ca(OH)2]=5×10-6,Ksp(CaCO3)=2×10-9)
(3)利用电解法在碱性条件下将CO2还原为CH4和C2H4的原理如下图所示:
S(X)= ×100% FE(X)=
×100% FE(X)= ×100%
×100%
① 写出碱性条件下CO2生成CH4的电极反应式:_______ 。
②碱性条件下反应一段时间,实验测得CH4、C2H4的选择性及CH4的法拉第效率如下表所示。则C2H4的法拉第效率FE(C2H4)为_______ 。
(4) 和
和 在镍基催化作用下重整模型如图所示(已知:*表示催化剂活性位点,
在镍基催化作用下重整模型如图所示(已知:*表示催化剂活性位点,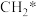 表示活性亚甲基)。
表示活性亚甲基)。 和
和 在镍基催化作用下发生重整反应的化学方程式为
在镍基催化作用下发生重整反应的化学方程式为_______ 。该反应在高温下才能自发进行,判断反应焓变
_______ (填“大于”“小于”或“等于”)0,判断理由是_______ 。
(1)利用CO2加氢制备CH3OH是人工固碳的途径之一。已知:
反应I:CO2(g)+3H2(g)
 CH3OH(g)+ H2O(g) ΔH1
CH3OH(g)+ H2O(g) ΔH1 反应Ⅱ:CO2(g)+H2(g)
 CO(g)+ H2O(g) ΔH2=41 kJ·mol-1
CO(g)+ H2O(g) ΔH2=41 kJ·mol-1反应Ⅲ:CO(g)+2H2(g)
 CH3OH(g) ΔH3= -90 kJ·mol-1
CH3OH(g) ΔH3= -90 kJ·mol-1 ΔH1=
(2)CO2浓度小于20%时适宜用化学吸附,下列为室温下化学吸附方法之一,化学方程式为Ca(OH)2+H2CO3=CaCO3+2H2O,反应的平衡常数为
(3)利用电解法在碱性条件下将CO2还原为CH4和C2H4的原理如下图所示:

S(X)=
 ×100% FE(X)=
×100% FE(X)= ×100%
×100%① 写出碱性条件下CO2生成CH4的电极反应式:
②碱性条件下反应一段时间,实验测得CH4、C2H4的选择性及CH4的法拉第效率如下表所示。则C2H4的法拉第效率FE(C2H4)为
| CH4 | C2H4 | |
| S(X) | 2% | 8% |
| FE(X) | 12.5% |
(4)
 和
和 在镍基催化作用下重整模型如图所示(已知:*表示催化剂活性位点,
在镍基催化作用下重整模型如图所示(已知:*表示催化剂活性位点,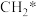 表示活性亚甲基)。
表示活性亚甲基)。
 和
和 在镍基催化作用下发生重整反应的化学方程式为
在镍基催化作用下发生重整反应的化学方程式为
您最近一年使用:0次
3 . 2024年河南某地中考理化生实验操作考试的化学题目之一是配制50g溶质质量分数为2%的氯化钠溶液,配制该溶液需要1g氯化钠固体和_______ mL水;电解饱和食盐水生成一种碱、氯气( )和一种可燃性气体,请写出该反应的化学方程式:
)和一种可燃性气体,请写出该反应的化学方程式:______ 。
 )和一种可燃性气体,请写出该反应的化学方程式:
)和一种可燃性气体,请写出该反应的化学方程式:
您最近一年使用:0次
解题方法
4 . NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
(1)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:___________ 。
(2)用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:___________ 。
(3)用NaOH溶液吸收,主要反应为NO+NO2+2OH−=2NO +H2O 、2NO2+2OH−=NO
+H2O 、2NO2+2OH−=NO +NO
+NO +H2O。吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是
+H2O。吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是___________ (填化学式);吸收后排放的尾气中含量较高的氮氧化物是___________ (填化学式)。
(4)用NaClO溶液吸收。其他条件同,NO转化为NO 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图-1所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图-1所示。 ,其离子方程式为
,其离子方程式为___________ 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是___________ 。
(5)在有氧条件下,新型催化剂M能催化NH3与NOx生成N2。将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图-2)。反应相同时间,NOx的去除率随反应温度的变化曲线如图-3所示,在50~250 ℃内随温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是___________ ;当反应温度高于380 ℃时,NOx转化率下降,除因为催化剂活性下降、进入反应器的NOx被还原的量减少外,还有___________ (用化学方程式表示)。
(1)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:
(2)用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:
(3)用NaOH溶液吸收,主要反应为NO+NO2+2OH−=2NO
 +H2O 、2NO2+2OH−=NO
+H2O 、2NO2+2OH−=NO +NO
+NO +H2O。吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是
+H2O。吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是(4)用NaClO溶液吸收。其他条件同,NO转化为NO
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图-1所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图-1所示。
 ,其离子方程式为
,其离子方程式为②NaClO溶液的初始pH越小,NO转化率越高。其原因是
(5)在有氧条件下,新型催化剂M能催化NH3与NOx生成N2。将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图-2)。反应相同时间,NOx的去除率随反应温度的变化曲线如图-3所示,在50~250 ℃内随温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是

您最近一年使用:0次
5 . 硫脲 在药物制备、金属矿物浮选等方面有广泛应用。实验室中可先制备
在药物制备、金属矿物浮选等方面有广泛应用。实验室中可先制备 ,然后
,然后 再与
再与 合成
合成 ,实验装置(夹持及加热装置略)如图所示。回答下列问题:
,实验装置(夹持及加热装置略)如图所示。回答下列问题: 易溶于水,易被氧化,受热时部分发生异构化生成
易溶于水,易被氧化,受热时部分发生异构化生成 。
。
实验(一):制备硫脲。
(1)装置B中饱和NaHS溶液的作用是_______ 。
(2)检查装置气密性后加入药品,打开 ,通入一段时间
,通入一段时间 ,再打开
,再打开 ,当观察到
,当观察到_______ 时,再打开 。
。
(3)完成(2)中操作后,水浴加热装置D,在80℃条件下合成硫脲,控制温度在880℃的原因是_______ ;装置D中除生成硫脲外,还生成一种碱,写出该过程D中发生反应的化学方程式:_______ 。
实验(二):探究硫脲的性质。
(4)①取少量 溶于水,加热至150℃,一段时间后再冷却至室温,滴加
溶于水,加热至150℃,一段时间后再冷却至室温,滴加_______ ,可检验是否有 生成。
生成。
②取少量 溶于NaOH溶液,加入
溶于NaOH溶液,加入 溶液,过滤,洗涤,得到黑色固体,由此推知,
溶液,过滤,洗涤,得到黑色固体,由此推知, 在碱性条件下会生成
在碱性条件下会生成_______ (填离子符号)。
③取少量 溶液通过如图实验验证
溶液通过如图实验验证 被酸性
被酸性 溶液氧化的产物。关闭K,发现电流计指针偏转;一段时间后,左烧杯中酸性
溶液氧化的产物。关闭K,发现电流计指针偏转;一段时间后,左烧杯中酸性 溶液褪色,右烧杯中产生两种无毒气体,其溶液经检验有
溶液褪色,右烧杯中产生两种无毒气体,其溶液经检验有 生成,则石墨电极上的反应式为
生成,则石墨电极上的反应式为_______ 。
(5)装置D反应后的液体经分离、提纯、烘干可得产品。测定产品的纯度:称取mg产品,加水溶解配成250mL溶液,取25mL于锥形瓶中,加入稀硫酸酸化,用cmol/L酸性 标准溶液滴定,滴定至终点时消耗标准溶液VmL。则样品中硫脲的质量分数为
标准溶液滴定,滴定至终点时消耗标准溶液VmL。则样品中硫脲的质量分数为_______ (用含m、c、V的代数式表示)。
 在药物制备、金属矿物浮选等方面有广泛应用。实验室中可先制备
在药物制备、金属矿物浮选等方面有广泛应用。实验室中可先制备 ,然后
,然后 再与
再与 合成
合成 ,实验装置(夹持及加热装置略)如图所示。回答下列问题:
,实验装置(夹持及加热装置略)如图所示。回答下列问题: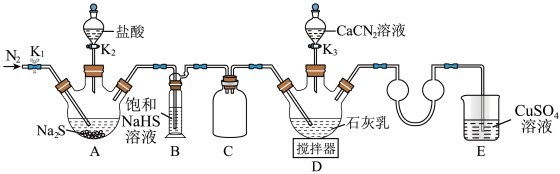
 易溶于水,易被氧化,受热时部分发生异构化生成
易溶于水,易被氧化,受热时部分发生异构化生成 。
。实验(一):制备硫脲。
(1)装置B中饱和NaHS溶液的作用是
(2)检查装置气密性后加入药品,打开
 ,通入一段时间
,通入一段时间 ,再打开
,再打开 ,当观察到
,当观察到 。
。(3)完成(2)中操作后,水浴加热装置D,在80℃条件下合成硫脲,控制温度在880℃的原因是
实验(二):探究硫脲的性质。
(4)①取少量
 溶于水,加热至150℃,一段时间后再冷却至室温,滴加
溶于水,加热至150℃,一段时间后再冷却至室温,滴加 生成。
生成。②取少量
 溶于NaOH溶液,加入
溶于NaOH溶液,加入 溶液,过滤,洗涤,得到黑色固体,由此推知,
溶液,过滤,洗涤,得到黑色固体,由此推知, 在碱性条件下会生成
在碱性条件下会生成③取少量
 溶液通过如图实验验证
溶液通过如图实验验证 被酸性
被酸性 溶液氧化的产物。关闭K,发现电流计指针偏转;一段时间后,左烧杯中酸性
溶液氧化的产物。关闭K,发现电流计指针偏转;一段时间后,左烧杯中酸性 溶液褪色,右烧杯中产生两种无毒气体,其溶液经检验有
溶液褪色,右烧杯中产生两种无毒气体,其溶液经检验有 生成,则石墨电极上的反应式为
生成,则石墨电极上的反应式为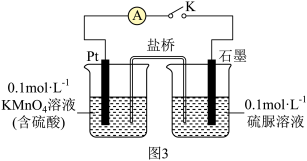
(5)装置D反应后的液体经分离、提纯、烘干可得产品。测定产品的纯度:称取mg产品,加水溶解配成250mL溶液,取25mL于锥形瓶中,加入稀硫酸酸化,用cmol/L酸性
 标准溶液滴定,滴定至终点时消耗标准溶液VmL。则样品中硫脲的质量分数为
标准溶液滴定,滴定至终点时消耗标准溶液VmL。则样品中硫脲的质量分数为
您最近一年使用:0次
2024-06-02更新
|
171次组卷
|
2卷引用:湖南省长沙市雅礼中学2024届高三下学期模拟考卷(二)化学试题
6 . 乙二胺四乙酸铁钠(化学式 )是一种重要补铁剂,某小组以铁屑为原料制备
)是一种重要补铁剂,某小组以铁屑为原料制备 并测定其含量。
并测定其含量。
已知:① 是一种配合物,微溶于乙醇,
是一种配合物,微溶于乙醇, 时水中的溶解度为
时水中的溶解度为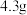 。
。
②乙二胺四乙酸( ,用
,用 表示)是一种弱酸。
表示)是一种弱酸。
Ⅰ.制备
实验室用铁屑制备 的主要流程如下:
的主要流程如下:___________
A.升高温度 B.加快搅拌速率 C.缩短浸取时间
(2)向酸浸所得滤液中通入足量 ,过程中浓度减少的离子有
,过程中浓度减少的离子有___________ (填离子符号)。
(3)“制备”步骤,向氧化所得的 溶液中加入一定量
溶液中加入一定量
 ,控制反应温度为
,控制反应温度为 ,加入
,加入 溶液调节
溶液调节 为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为
为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为 。
。
①从反应后的混合物中获得较高产率的 粗品的实验操作是,
粗品的实验操作是,___________ ,过滤,水洗,干燥。检验 是否洗净的试剂是
是否洗净的试剂是___________
②保持其他条件不变,乙二胺四乙酸铁钠的产率随反应液 的变化如图1所示。
的变化如图1所示。 过低或过高产品产率均减小的主要原因是
过低或过高产品产率均减小的主要原因是___________ 。
样品中乙二胺四乙酸铁钠纯度可用 标准溶液滴定。原理是在
标准溶液滴定。原理是在 为
为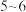 发生反应:
发生反应: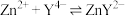 ,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。
,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。
(4)补充完整实验方案:准确称取 样品,溶于一定量的蒸馏水,加入掩蔽剂排除
样品,溶于一定量的蒸馏水,加入掩蔽剂排除 干扰,得到待测溶液
干扰,得到待测溶液 ,将溶液
,将溶液 完全转移到
完全转移到 容量瓶中定容;按规定操作分别将
容量瓶中定容;按规定操作分别将 标准溶液和待测溶液
标准溶液和待测溶液 装入如图2所示的滴定管中:
装入如图2所示的滴定管中:___________ 。
 )是一种重要补铁剂,某小组以铁屑为原料制备
)是一种重要补铁剂,某小组以铁屑为原料制备 并测定其含量。
并测定其含量。已知:①
 是一种配合物,微溶于乙醇,
是一种配合物,微溶于乙醇, 时水中的溶解度为
时水中的溶解度为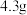 。
。②乙二胺四乙酸(
 ,用
,用 表示)是一种弱酸。
表示)是一种弱酸。Ⅰ.制备

实验室用铁屑制备
 的主要流程如下:
的主要流程如下:
A.升高温度 B.加快搅拌速率 C.缩短浸取时间
(2)向酸浸所得滤液中通入足量
 ,过程中浓度减少的离子有
,过程中浓度减少的离子有(3)“制备”步骤,向氧化所得的
 溶液中加入一定量
溶液中加入一定量
 ,控制反应温度为
,控制反应温度为 ,加入
,加入 溶液调节
溶液调节 为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为
为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为 。
。①从反应后的混合物中获得较高产率的
 粗品的实验操作是,
粗品的实验操作是, 是否洗净的试剂是
是否洗净的试剂是②保持其他条件不变,乙二胺四乙酸铁钠的产率随反应液
 的变化如图1所示。
的变化如图1所示。 过低或过高产品产率均减小的主要原因是
过低或过高产品产率均减小的主要原因是
样品中乙二胺四乙酸铁钠纯度可用
 标准溶液滴定。原理是在
标准溶液滴定。原理是在 为
为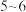 发生反应:
发生反应: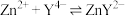 ,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。
,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。(4)补充完整实验方案:准确称取
 样品,溶于一定量的蒸馏水,加入掩蔽剂排除
样品,溶于一定量的蒸馏水,加入掩蔽剂排除 干扰,得到待测溶液
干扰,得到待测溶液 ,将溶液
,将溶液 完全转移到
完全转移到 容量瓶中定容;按规定操作分别将
容量瓶中定容;按规定操作分别将 标准溶液和待测溶液
标准溶液和待测溶液 装入如图2所示的滴定管中:
装入如图2所示的滴定管中:
您最近一年使用:0次
7 . 为解决二氧化碳的过量排放带来的气候变暖、海洋酸化的负面效应,二氧化碳的捕集及转化成为高价值的低碳烯烃已成为热门的科研项目。回答下列问题:
I.高温条件下二氧化碳可以氢化制备乙烯。
(1)已知下列反应的热化学方程式:
i. ;
;
ii.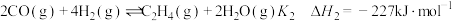 ;
;
反应iii: 的
的
_______  ,平衡常数
,平衡常数
_______ (用 、
、 表示)。
表示)。
(2)研究表明,合成气体在 、起始
、起始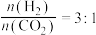 时,
时, 平衡转化率随温度的变化如图1所示,乙烯选择性随温度的变化如图2所示[乙烯选择性
平衡转化率随温度的变化如图1所示,乙烯选择性随温度的变化如图2所示[乙烯选择性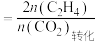 ]:
]: 平衡转化率随温度升高出现先下降后升高可能的原因是
平衡转化率随温度升高出现先下降后升高可能的原因是_______ 。
②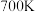 时,反应i的
时,反应i的
_______ (列出计算式即可)。
(3)关于上述反应,下列说法正确的是_______(填选项字母)。
II.二氧化碳电催化还原制乙烯。
(4)科学家研究利用电催化还原 制乙烯,其工作原理如图所示,涂有
制乙烯,其工作原理如图所示,涂有 催化剂的铜电极作阴极,阴极的电极反应式为
催化剂的铜电极作阴极,阴极的电极反应式为_______ ;当阴极生成 气体时,理论上阳极生成气体的物质的量为
气体时,理论上阳极生成气体的物质的量为_______ 。
I.高温条件下二氧化碳可以氢化制备乙烯。
(1)已知下列反应的热化学方程式:
i.
 ;
;ii.
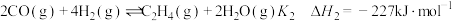 ;
;反应iii:
 的
的
 ,平衡常数
,平衡常数
 、
、 表示)。
表示)。(2)研究表明,合成气体在
 、起始
、起始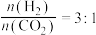 时,
时, 平衡转化率随温度的变化如图1所示,乙烯选择性随温度的变化如图2所示[乙烯选择性
平衡转化率随温度的变化如图1所示,乙烯选择性随温度的变化如图2所示[乙烯选择性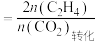 ]:
]: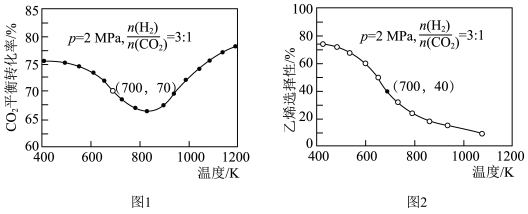
 平衡转化率随温度升高出现先下降后升高可能的原因是
平衡转化率随温度升高出现先下降后升高可能的原因是②
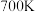 时,反应i的
时,反应i的
(3)关于上述反应,下列说法正确的是_______(填选项字母)。
A.提高投料比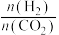 , , 的平衡转化率减小 的平衡转化率减小 |
| B.使用高效催化剂可提高平衡时乙烯的体积分数 |
| C.若在恒容、绝热容器中进行,温度不变则反应达到平衡 |
D.体系内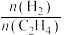 比值不变反应达到平衡状态 比值不变反应达到平衡状态 |
II.二氧化碳电催化还原制乙烯。
(4)科学家研究利用电催化还原
 制乙烯,其工作原理如图所示,涂有
制乙烯,其工作原理如图所示,涂有 催化剂的铜电极作阴极,阴极的电极反应式为
催化剂的铜电极作阴极,阴极的电极反应式为 气体时,理论上阳极生成气体的物质的量为
气体时,理论上阳极生成气体的物质的量为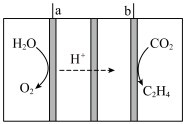
您最近一年使用:0次
2024·上海·模拟预测
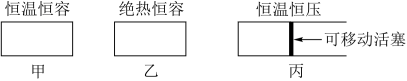
8 . 某研究组模拟三种已装固体V2O5催化剂的密闭容器装置,发生的反应为:2SO2(g)+O2(g) 2SO3(g) ΔH1=-197.7kJ·mol-1
2SO3(g) ΔH1=-197.7kJ·mol-1
(1)在初始体积与温度相同的条件下,甲、乙、丙中均按2molSO2、1molO2投料,达平衡时;三个容器中SO2的转化率从大到小的顺序为___________ (用“甲、乙、丙”表示)。
(3)400℃,在容器丙中投入4molSO2、2molO2进行反应时,放出akJ热量;若在500℃,投入2molSO2、1molO2进行反应,放出bkJ热量,则a___________ 2b(填“﹥”、“﹤”或“=”)。
 2SO3(g) ΔH1=-197.7kJ·mol-1
2SO3(g) ΔH1=-197.7kJ·mol-1(1)在初始体积与温度相同的条件下,甲、乙、丙中均按2molSO2、1molO2投料,达平衡时;三个容器中SO2的转化率从大到小的顺序为
| A.温度不变 | B.密度保持不变 | C.压强保持不变 | D.O2浓度保持不变 |
(3)400℃,在容器丙中投入4molSO2、2molO2进行反应时,放出akJ热量;若在500℃,投入2molSO2、1molO2进行反应,放出bkJ热量,则a
您最近一年使用:0次
9 . 锑白 是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为
是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为 ,含少量的
,含少量的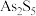 、
、 、
、 和
和 等)提取锑白的工艺流程如图所示:
等)提取锑白的工艺流程如图所示: 、
、 、
、 、
、 、
、 、
、 、
、 ;
;
② ,
, 。
。
回答下列问题:
(1)粉碎辉锑矿的目的是_______ 。
(2)滤渣I的成分除不溶性杂质外还有PbS、S、_______ (填化学式)。 在“浸取”时发生反应的离子方程式为
在“浸取”时发生反应的离子方程式为_______ 。
(3)“除砷”时氧化剂与还原剂的物质的量之比为_______ (P转化为最高价态)。
(4)若浸取液 、
、 浓度均为
浓度均为 ,
,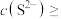
_______  才能使二者完全沉淀(当离子浓度
才能使二者完全沉淀(当离子浓度 时认为沉淀完全),此时
时认为沉淀完全),此时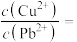
_______ 。
(5)“中和脱氯”时脱氯率与反应温度的关系如图所示:_______ ;随温度升高,脱氯率降低可能的原因为_______ 。
 是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为
是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为 ,含少量的
,含少量的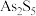 、
、 、
、 和
和 等)提取锑白的工艺流程如图所示:
等)提取锑白的工艺流程如图所示: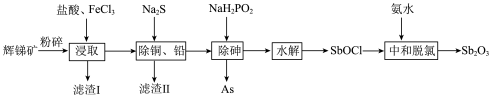
 、
、 、
、 、
、 、
、 、
、 、
、 ;
;②
 ,
, 。
。回答下列问题:
(1)粉碎辉锑矿的目的是
(2)滤渣I的成分除不溶性杂质外还有PbS、S、
 在“浸取”时发生反应的离子方程式为
在“浸取”时发生反应的离子方程式为(3)“除砷”时氧化剂与还原剂的物质的量之比为
(4)若浸取液
 、
、 浓度均为
浓度均为 ,
,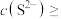
 才能使二者完全沉淀(当离子浓度
才能使二者完全沉淀(当离子浓度 时认为沉淀完全),此时
时认为沉淀完全),此时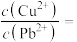
(5)“中和脱氯”时脱氯率与反应温度的关系如图所示:

您最近一年使用:0次
10 . 以软锰矿浆(含 及少量
及少量 等)吸收烟气中
等)吸收烟气中 并制备高纯
并制备高纯 。
。
(1)吸收 。
。
①将烟气与软锰矿浆在吸收塔中逆流接触,烟气中的 被充分吸收,矿浆中的
被充分吸收,矿浆中的 转化为
转化为 。写出
。写出 与
与 发生反应的化学方程式:
发生反应的化学方程式:_______ 。
②脱硫过程中软锰矿浆的 和
和 吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆
吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆 下降,但15小时前
下降,但15小时前 下降缓慢,其主要原因是
下降缓慢,其主要原因是_______ 。 吸收率急剧下降。此时加入菱锰矿
吸收率急剧下降。此时加入菱锰矿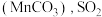 吸收率又可恢复至
吸收率又可恢复至 以上,其原因是
以上,其原因是_______ 。
(2)净化 。
。
①过滤脱硫后的软锰矿浆液,用 沉淀除去所得滤液中的
沉淀除去所得滤液中的 、Mg2+(浓度小于
、Mg2+(浓度小于 )。此时应控制溶液中
)。此时应控制溶液中 略大于
略大于_______  。(已知:
。(已知: 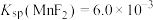 、
、 ,
, 、)
、)
②净化时生成的 沉淀晶胞结构如图所示。在
沉淀晶胞结构如图所示。在 晶胞中
晶胞中 周围距离最近的
周围距离最近的 形成的空隙构型为
形成的空隙构型为_______ 。 。
。
①向反应器中加入 溶液,控制80℃恒温,搅拌下鼓入空气可制得
溶液,控制80℃恒温,搅拌下鼓入空气可制得 。写出生成
。写出生成 的离子方程式:
的离子方程式:_______ 。
②实际生产中,常将 溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入
溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入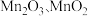 等,其原因是
等,其原因是_______ 。
 及少量
及少量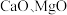 等)吸收烟气中
等)吸收烟气中 并制备高纯
并制备高纯 。
。(1)吸收
 。
。①将烟气与软锰矿浆在吸收塔中逆流接触,烟气中的
 被充分吸收,矿浆中的
被充分吸收,矿浆中的 转化为
转化为 。写出
。写出 与
与 发生反应的化学方程式:
发生反应的化学方程式:②脱硫过程中软锰矿浆的
 和
和 吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆
吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆 下降,但15小时前
下降,但15小时前 下降缓慢,其主要原因是
下降缓慢,其主要原因是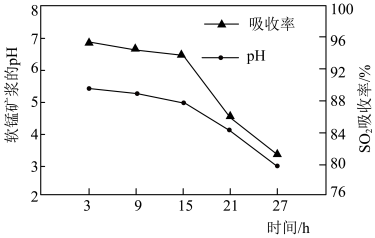
 吸收率急剧下降。此时加入菱锰矿
吸收率急剧下降。此时加入菱锰矿 吸收率又可恢复至
吸收率又可恢复至 以上,其原因是
以上,其原因是(2)净化
 。
。①过滤脱硫后的软锰矿浆液,用
 沉淀除去所得滤液中的
沉淀除去所得滤液中的 、Mg2+(浓度小于
、Mg2+(浓度小于 )。此时应控制溶液中
)。此时应控制溶液中 略大于
略大于 。(已知:
。(已知: 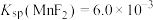 、
、 ,
, 、)
、)②净化时生成的
 沉淀晶胞结构如图所示。在
沉淀晶胞结构如图所示。在 晶胞中
晶胞中 周围距离最近的
周围距离最近的 形成的空隙构型为
形成的空隙构型为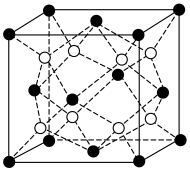
 。
。①向反应器中加入
 溶液,控制80℃恒温,搅拌下鼓入空气可制得
溶液,控制80℃恒温,搅拌下鼓入空气可制得 。写出生成
。写出生成 的离子方程式:
的离子方程式:②实际生产中,常将
 溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入
溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入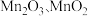 等,其原因是
等,其原因是
您最近一年使用:0次
2024-05-25更新
|
278次组卷
|
2卷引用:江苏省苏锡常镇四市2024届高三下学期教学情况调研(二)(二模)化学试题



