23-24高二·全国·假期作业
解题方法
1 . 回答下列问题。
(1)在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,常用SO2将CO氧化,SO2被还原为S。已知:
①C(s)+ O2(g)=CO(g) ΔH1=-126.4 kJ·mol-1
O2(g)=CO(g) ΔH1=-126.4 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1
③S(s)+O2(g)=SO2(g) ΔH3=-296.8 kJ·mol-1
则SO2氧化CO的热化学方程式为___________ 。
(2)用O2将HCl转化为Cl2,可提高效率,减少污染。传统上该转化通过如下图所示的催化循环实现。

其中,反应①为2HCl(g)+CuO(s)=H2O(g)+CuCl2(s) ΔH1
反应②生成1 mol Cl2的反应热为ΔH2,则总反应的热化学方程式为_________________ (反应热用ΔH1和ΔH2表示)。
(3)工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)=CO(g)+H2(g);
②用天然气跟水蒸气反应:CH4(g)+H2O(g)=CO(g)+3H2(g)
已知有关反应的能量变化如下图所示,则方法②中反应的ΔH=___________ 。

(1)在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,常用SO2将CO氧化,SO2被还原为S。已知:
①C(s)+
 O2(g)=CO(g) ΔH1=-126.4 kJ·mol-1
O2(g)=CO(g) ΔH1=-126.4 kJ·mol-1②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1
③S(s)+O2(g)=SO2(g) ΔH3=-296.8 kJ·mol-1
则SO2氧化CO的热化学方程式为
(2)用O2将HCl转化为Cl2,可提高效率,减少污染。传统上该转化通过如下图所示的催化循环实现。

其中,反应①为2HCl(g)+CuO(s)=H2O(g)+CuCl2(s) ΔH1
反应②生成1 mol Cl2的反应热为ΔH2,则总反应的热化学方程式为
(3)工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)=CO(g)+H2(g);
②用天然气跟水蒸气反应:CH4(g)+H2O(g)=CO(g)+3H2(g)
已知有关反应的能量变化如下图所示,则方法②中反应的ΔH=

您最近一年使用:0次
名校
解题方法
2 . 完成下列问题。
(1)电解精制饱和食盐水制取氯气、氢气、烧碱和氯的含氧酸盐等一系列化工产品。如图是离子交换膜法电解食盐水的示意图。电解精制饱和食盐水的离子方程式为___________ 。

(2)氨电解法制氢气
利用电解原理,将氨转化为高纯氮气,其装置如图所示。

电解过程中,阳极的电极方程式为___________ 。
(3)图甲是一种将废水中的氯乙烯(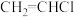 )转换成对环境无害的微生物电池装置,同时利用此装置在铁上镀铜。
)转换成对环境无害的微生物电池装置,同时利用此装置在铁上镀铜。

①M为_______ (填写“正极、负极、阴极、阳极”),镀铜时,______ (填写X或Y)与铁电极相连,工作过程中,N极电极反应式___________ ,当N极有3.2g O2完全反应时,通过质子交换膜的H+的数目为___________ 。
②若M极消耗0.1mol氯乙烯,则铁电极增重___________ g,硫酸铜溶液的浓度将___________ (填写“增大、减小、不变”)
(1)电解精制饱和食盐水制取氯气、氢气、烧碱和氯的含氧酸盐等一系列化工产品。如图是离子交换膜法电解食盐水的示意图。电解精制饱和食盐水的离子方程式为

(2)氨电解法制氢气
利用电解原理,将氨转化为高纯氮气,其装置如图所示。

电解过程中,阳极的电极方程式为
(3)图甲是一种将废水中的氯乙烯(
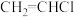 )转换成对环境无害的微生物电池装置,同时利用此装置在铁上镀铜。
)转换成对环境无害的微生物电池装置,同时利用此装置在铁上镀铜。
①M为
②若M极消耗0.1mol氯乙烯,则铁电极增重
您最近一年使用:0次
名校
3 . 研究化学反应意义重大,请就下列现象和实质回答问题。
(1) 可用作白色颜料和阻燃剂等。在实验室中可利用
可用作白色颜料和阻燃剂等。在实验室中可利用 的水解反应制取
的水解反应制取 (
( 的水解分三步进行,中间产物有
的水解分三步进行,中间产物有 等),写出
等),写出 水解生成
水解生成 的水解反应方程式
的水解反应方程式_________ ; 水解的总反应可表示为:
水解的总反应可表示为: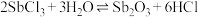 为了得到较多的
为了得到较多的 ,操作时要将
,操作时要将 缓慢加入大量水中的原因是
缓慢加入大量水中的原因是___________ 。
(2)次磷酸 是一种弱酸,
是一种弱酸, 溶液和足量
溶液和足量 溶液混合,所得溶液中阴离子只有
溶液混合,所得溶液中阴离子只有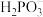 、
、 、
、 三种。写出
三种。写出 溶液与
溶液与 溶液恰好完全中和的溶液中各离子浓度由大到小的顺序为
溶液恰好完全中和的溶液中各离子浓度由大到小的顺序为___________ 。
(3)已知 与
与 溶液反应生成
溶液反应生成 ,与稀硫酸反应生成
,与稀硫酸反应生成 ,写出
,写出 在水中的电离方程式
在水中的电离方程式___________ 、___________ 。
(4)一定温度下,用水吸收 气体时,溶液中水的电离平衡
气体时,溶液中水的电离平衡___________ 移动(填“向左”“向右”或“不”);若得到 的
的 溶液,试计算溶液中
溶液,试计算溶液中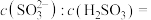
___________ (已知该温度下, 的电离常数:
的电离常数: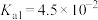 ,
, )。
)。
(5)某温度下, 的盐酸中
的盐酸中 ;该温度下
;该温度下 的
的 溶液与
溶液与 的
的 溶液混合后溶液的
溶液混合后溶液的 ,则
,则 与
与 溶液的体积比为
溶液的体积比为___________ 。
(6)25℃时,若向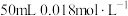 的
的 溶液中加入
溶液中加入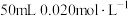 的盐酸,混合后溶液中的
的盐酸,混合后溶液中的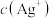 为
为___________  (25℃时,
(25℃时, )。
)。
(1)
 可用作白色颜料和阻燃剂等。在实验室中可利用
可用作白色颜料和阻燃剂等。在实验室中可利用 的水解反应制取
的水解反应制取 (
( 的水解分三步进行,中间产物有
的水解分三步进行,中间产物有 等),写出
等),写出 水解生成
水解生成 的水解反应方程式
的水解反应方程式 水解的总反应可表示为:
水解的总反应可表示为: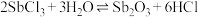 为了得到较多的
为了得到较多的 ,操作时要将
,操作时要将 缓慢加入大量水中的原因是
缓慢加入大量水中的原因是(2)次磷酸
 是一种弱酸,
是一种弱酸, 溶液和足量
溶液和足量 溶液混合,所得溶液中阴离子只有
溶液混合,所得溶液中阴离子只有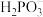 、
、 、
、 三种。写出
三种。写出 溶液与
溶液与 溶液恰好完全中和的溶液中各离子浓度由大到小的顺序为
溶液恰好完全中和的溶液中各离子浓度由大到小的顺序为(3)已知
 与
与 溶液反应生成
溶液反应生成 ,与稀硫酸反应生成
,与稀硫酸反应生成 ,写出
,写出 在水中的电离方程式
在水中的电离方程式(4)一定温度下,用水吸收
 气体时,溶液中水的电离平衡
气体时,溶液中水的电离平衡 的
的 溶液,试计算溶液中
溶液,试计算溶液中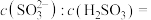
 的电离常数:
的电离常数: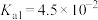 ,
, )。
)。(5)某温度下,
 的盐酸中
的盐酸中 ;该温度下
;该温度下 的
的 溶液与
溶液与 的
的 溶液混合后溶液的
溶液混合后溶液的 ,则
,则 与
与 溶液的体积比为
溶液的体积比为(6)25℃时,若向
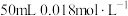 的
的 溶液中加入
溶液中加入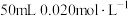 的盐酸,混合后溶液中的
的盐酸,混合后溶液中的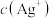 为
为 (25℃时,
(25℃时, )。
)。
您最近一年使用:0次
23-24高二·全国·假期作业
4 . 在常温25℃下,回答下列问题:
(1) 的水解常数
的水解常数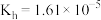 。含等物质的量浓度的
。含等物质的量浓度的 与
与 的混合溶液显
的混合溶液显___________ (填“酸”“碱”或“中”)性,该溶液中各离子浓度由大到小的顺序为___________ 。
(2) 可用氨水吸收生成
可用氨水吸收生成 ,将
,将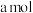
 溶于水,溶液显酸性,原因是
溶于水,溶液显酸性,原因是___________ (用离子方程式表示)。向该溶液滴加b L氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将___________ (填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为___________  (
( 的电离平衡常数取
的电离平衡常数取 )。
)。
(3)向氨水中加入 稀硫酸至溶液正好呈中性,则
稀硫酸至溶液正好呈中性,则
___________ (填“>”“<”或“=”)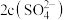 ,此时混合溶液中
,此时混合溶液中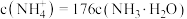 ,则
,则 的电离常数
的电离常数 为
为___________ 。
(1)
 的水解常数
的水解常数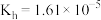 。含等物质的量浓度的
。含等物质的量浓度的 与
与 的混合溶液显
的混合溶液显(2)
 可用氨水吸收生成
可用氨水吸收生成 ,将
,将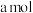
 溶于水,溶液显酸性,原因是
溶于水,溶液显酸性,原因是 (
( 的电离平衡常数取
的电离平衡常数取 )。
)。(3)向氨水中加入
 稀硫酸至溶液正好呈中性,则
稀硫酸至溶液正好呈中性,则
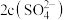 ,此时混合溶液中
,此时混合溶液中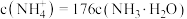 ,则
,则 的电离常数
的电离常数 为
为
您最近一年使用:0次
名校
解题方法
5 . 用铅蓄电池电解 溶液,a、b电极均为石墨。已知铅蓄电池的总反应为
溶液,a、b电极均为石墨。已知铅蓄电池的总反应为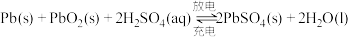 ,通电时a电极质量增加,回答下列问题:
,通电时a电极质量增加,回答下列问题:

(1)①乙中a极是该电池的___________ (填“阳极”或“阴极”)。
②甲中Y电极的电极反应式为___________ 。
(2)乙中装有 溶液,工作一段时间后,停止通电,若甲中放电时共转移
溶液,工作一段时间后,停止通电,若甲中放电时共转移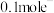 ,通电后乙中发生反应的总反应方程式为
,通电后乙中发生反应的总反应方程式为___________ ,欲使溶液恢复到起始状态,可向溶液中加入___________ (填字母),质量为___________ 。
A.Ag B. C.
C.
(3)①欲用丙装置防止金属铁被腐蚀,则金属铁应为___________ (填“c”或“d”)极。
②欲用丙装置精炼铜,则粗铜应为___________ (填“c”或“d”)极。
 溶液,a、b电极均为石墨。已知铅蓄电池的总反应为
溶液,a、b电极均为石墨。已知铅蓄电池的总反应为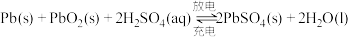 ,通电时a电极质量增加,回答下列问题:
,通电时a电极质量增加,回答下列问题:
(1)①乙中a极是该电池的
②甲中Y电极的电极反应式为
(2)乙中装有
 溶液,工作一段时间后,停止通电,若甲中放电时共转移
溶液,工作一段时间后,停止通电,若甲中放电时共转移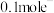 ,通电后乙中发生反应的总反应方程式为
,通电后乙中发生反应的总反应方程式为A.Ag B.
 C.
C.
(3)①欲用丙装置防止金属铁被腐蚀,则金属铁应为
②欲用丙装置精炼铜,则粗铜应为
您最近一年使用:0次
23-24高二·全国·假期作业
6 . 在一定条件下,容积为2L的密闭容器中,将2molL气体和3molM气体混合,发生如下反应:2L(g)+3M(g) xQ(g)+3R(g),10s末,生成2.4molR,并测得Q的浓度为0.4mol•L-1.计算:
xQ(g)+3R(g),10s末,生成2.4molR,并测得Q的浓度为0.4mol•L-1.计算:
(1)10s末L的物质的量浓度为___________ 。
(2)前10s内用M表示的化学反应速率为___________ 。
(3)化学方程式中x值为___________ 。
(4)L(g)的转化率为___________ 。
(5)在恒温恒容条件下,往容器中加入1mol氦气,反应速率___________ 。(填“增大”、“减小”或“不变”,下同)。
 xQ(g)+3R(g),10s末,生成2.4molR,并测得Q的浓度为0.4mol•L-1.计算:
xQ(g)+3R(g),10s末,生成2.4molR,并测得Q的浓度为0.4mol•L-1.计算:(1)10s末L的物质的量浓度为
(2)前10s内用M表示的化学反应速率为
(3)化学方程式中x值为
(4)L(g)的转化率为
(5)在恒温恒容条件下,往容器中加入1mol氦气,反应速率
您最近一年使用:0次
7 . 金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/mol·L-1)如图所示。

(1)pH=3时溶液中铜元素的主要存在形式是___________ 。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液pH范围在___________ 。
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,___________ (填“能”或“不能”)通过调节溶液pH的方法来除去,理由是___________ 。
(4)已知一些难溶物的溶度积常数如表。
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的___________ (填选项)。
A.NaOH B.FeS C.Na2S
(5)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20。在25℃时,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成___________ (填化学式)沉淀。
(6)已知25℃时,Ksp[Fe(OH)3]=2.6×10-39,该温度下反应Fe(OH)3+3H+⇌Fe3++3H2O的平衡常数K=___________ 。

(1)pH=3时溶液中铜元素的主要存在形式是
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液pH范围在
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,
(4)已知一些难溶物的溶度积常数如表。
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-35 | 3.4×10-28 | 6.4×10-33 | 1.6×10-24 |
A.NaOH B.FeS C.Na2S
(5)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20。在25℃时,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
(6)已知25℃时,Ksp[Fe(OH)3]=2.6×10-39,该温度下反应Fe(OH)3+3H+⇌Fe3++3H2O的平衡常数K=
您最近一年使用:0次
8 . CO对人类生存环境的影响很大,CO治理问题属于当今社会的热点问题。镍与CO反应的化学方程式为Ni(s)+4CO(g)=Ni(CO)4(g),镍与CO反应会造成镍催化剂中毒,为防止镍催化剂中毒,工业上常用SO2除去CO,生成物为S和CO2.已知相关反应过程的能量变化如图所示,则用SO2除去CO的热化学方程式为___________ 。
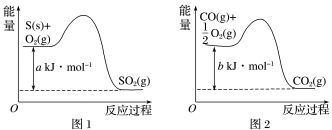

您最近一年使用:0次
22-23高二·全国·假期作业
解题方法
9 . 一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向另一个电极通入空气。回答下列问题:
(1)此电池放电时发生的化学反应是___________ 。
(2)此电池的正极发生的电极反应是___________ ;负极发生的电极反应是___________ 。
(3)电解液中的 向
向___________ 极移动;向外电路释放电子的电极是___________ 。
(4)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池能量转化效率高,其次是___________ 。
(1)此电池放电时发生的化学反应是
(2)此电池的正极发生的电极反应是
(3)电解液中的
 向
向(4)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池能量转化效率高,其次是
您最近一年使用:0次
23-24高二·全国·假期作业
解题方法
10 . 在0.5 mol/L的NaHSO3溶液中滴入石蕊,溶液变红。试回答有关问题:
(1)该溶液中 的电离程度
的电离程度___________ (填“大于”“小于”或“等于”)  的水解程度。
的水解程度。
(2)溶液中Na+、 、
、 、H+、OH-、H2SO3、H2O等粒子的浓度由大到小的顺序为
、H+、OH-、H2SO3、H2O等粒子的浓度由大到小的顺序为___________ 。
(3)在Na2SO3溶液中滴入酚酞,溶液变红。若在该溶液中再滴入过量的BaCl2溶液,所观察到的现象是___________ ,其原因是(以离子方程式和简要文字说明)___________ 。
(1)该溶液中
 的电离程度
的电离程度 的水解程度。
的水解程度。(2)溶液中Na+、
 、
、 、H+、OH-、H2SO3、H2O等粒子的浓度由大到小的顺序为
、H+、OH-、H2SO3、H2O等粒子的浓度由大到小的顺序为(3)在Na2SO3溶液中滴入酚酞,溶液变红。若在该溶液中再滴入过量的BaCl2溶液,所观察到的现象是
您最近一年使用:0次



