名校
解题方法
1 . 在处理NO废气的过程中,催化剂[Co(NH3)6]2+会逐渐失活变为[Co(NH3)6]3+。某小组为解决这一问题,实验研究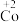 和
和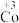 之间的相互转化。
之间的相互转化。
资料:i.Ksp[Co(OH)2]=5.9×10-15,Ksp[Co(OH)3]=1.6×10-44
ii.Co2++6NH3 [Co(NH3)6]2+K1=1.3×105
[Co(NH3)6]2+K1=1.3×105
Co3++6NH3 [Co(NH3)6]3+K2=2×1035
[Co(NH3)6]3+K2=2×1035
iii.[Co(NH3)6]2+和[Co(NH3)6]3+在酸性条件下均能生成NH
(1)探究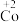 的还原性
的还原性
实验I.粉红色的CoCl2溶液或CoSO4溶液在空气中久置,无明显变化。
实验II.向0.1mol/LCoCl2溶液中滴入2滴酸性KMnO4溶液,无明显变化。
实验III.按如图装置进行实验,观察到电压表指针偏转。
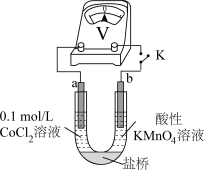
①甲同学根据实验III得出结论:Co2+可以被酸性KMnO4溶液氧化。
乙同学补充实验IV,____ (补全实验操作及现象),否定了该观点。
②探究碱性条件下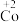 的还原性,进行实验。
的还原性,进行实验。
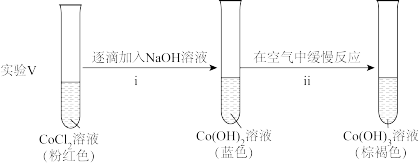
ii中反应的化学方程式是____ 。
③根据氧化还原反应规律解释:还原性Co(OH)2>Co2+:Co2+-e-=Co3+在碱性条件下,OH-与Co2+、Co3+反应,使c(Co2+)和c(Co3+)均降低,但____ 降低的程度更大,还原剂的还原性增强。
(2)探究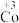 的氧化性
的氧化性
①根据实验III和IV推测氧化性:Co3+>Cl2,设计实验证明:向V中得到的棕褐色沉淀中,____ (补全实验操作及现象),反应的离子方程式是____ 。
②向V中得到的棕褐色沉淀中滴加H2SO4溶液,加入催化剂,产生无色气泡,该气体是____ 。
(3)催化剂[Co(NH3)6]2+的失活与再生
①结合数据解释[Co(NH3)6]2+能被氧化为[Co(NH3)6]3+而失活的原因:____ 。
②根据以上实验,设计物质转化流程图实现[Co(NH3)6]2+的再生:____ 。
示例:Co CoCl2
CoCl2 Co(OH)2
Co(OH)2
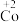 和
和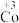 之间的相互转化。
之间的相互转化。资料:i.Ksp[Co(OH)2]=5.9×10-15,Ksp[Co(OH)3]=1.6×10-44
ii.Co2++6NH3
 [Co(NH3)6]2+K1=1.3×105
[Co(NH3)6]2+K1=1.3×105Co3++6NH3
 [Co(NH3)6]3+K2=2×1035
[Co(NH3)6]3+K2=2×1035iii.[Co(NH3)6]2+和[Co(NH3)6]3+在酸性条件下均能生成NH

(1)探究
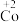 的还原性
的还原性实验I.粉红色的CoCl2溶液或CoSO4溶液在空气中久置,无明显变化。
实验II.向0.1mol/LCoCl2溶液中滴入2滴酸性KMnO4溶液,无明显变化。
实验III.按如图装置进行实验,观察到电压表指针偏转。

①甲同学根据实验III得出结论:Co2+可以被酸性KMnO4溶液氧化。
乙同学补充实验IV,
②探究碱性条件下
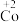 的还原性,进行实验。
的还原性,进行实验。
ii中反应的化学方程式是
③根据氧化还原反应规律解释:还原性Co(OH)2>Co2+:Co2+-e-=Co3+在碱性条件下,OH-与Co2+、Co3+反应,使c(Co2+)和c(Co3+)均降低,但
(2)探究
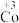 的氧化性
的氧化性①根据实验III和IV推测氧化性:Co3+>Cl2,设计实验证明:向V中得到的棕褐色沉淀中,
②向V中得到的棕褐色沉淀中滴加H2SO4溶液,加入催化剂,产生无色气泡,该气体是
(3)催化剂[Co(NH3)6]2+的失活与再生
①结合数据解释[Co(NH3)6]2+能被氧化为[Co(NH3)6]3+而失活的原因:
②根据以上实验,设计物质转化流程图实现[Co(NH3)6]2+的再生:
示例:Co
 CoCl2
CoCl2 Co(OH)2
Co(OH)2
您最近一年使用:0次
2022-05-08更新
|
1351次组卷
|
9卷引用:北京市东城区一六六中学2022-2023学年高三上学期期中考试化学试题
名校
2 . 探究溶液酸碱性对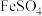 溶液的配制和保存的影响。10mL
溶液的配制和保存的影响。10mL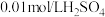 或10mL
或10mL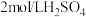 溶液中。
溶液中。
I.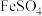 溶液的配制
溶液的配制
将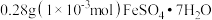 分别溶于10mL蒸馏水或10mL
分别溶于10mL蒸馏水或10mL
(1)用平衡移动原理解释①显酸性的主要原因是________________
(2)②、③变红时发生反应的离子方程式是_______________________
(3)甲同学认为①中一定有+3价铁。他用激光笔照射“溶液”,观察到光路:又向含有KSCN的①中滴入试剂a,溶液变红,说明其推断正确,试剂a是____________
II 溶液的保存
溶液的保存
将实验I中配制的三份溶液分别在空气中放置24小时后,记录如下。
【分析讨论】①②说明酸性减弱时, 溶液更易变质;②③说明……
溶液更易变质;②③说明……
【查阅资料】在一定pH范围内,+2价铁的还原性随酸性减弱而增强,氧气的氧化性随酸性的增强而增强。
【进行实验】用右图所示装置完成实验(滴加试剂时溶液体积和溶液导电性变化可忽略)。向右池持续稳定通入氧气,待电流表示数稳定后:
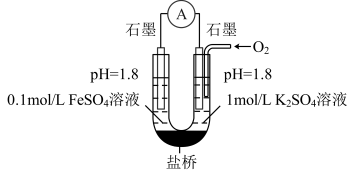
I向左池滴加浓硫酸至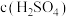 接近
接近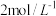 ,电流没有明显变化
,电流没有明显变化
II向右池滴加等量浓硫酸,电流明显增大。
(4)补全【分析讨论】:②③说明_______________
(5)ii中右池的电极反应方程式是____________________
(6)依据实验推断:③比②中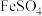 更易变质的原因是
更易变质的原因是___________________
(7)按上述原理及装置重新进行实验证实①中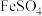 更易变质的原因。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,
更易变质的原因。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,____________
(8)依据实验,配制并保存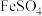 溶液的最佳方法是
溶液的最佳方法是_________________ 。
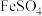 溶液的配制和保存的影响。10mL
溶液的配制和保存的影响。10mL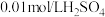 或10mL
或10mL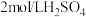 溶液中。
溶液中。I.
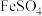 溶液的配制
溶液的配制将
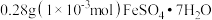 分别溶于10mL蒸馏水或10mL
分别溶于10mL蒸馏水或10mL| 溶液编号 | 溶剂 | 溶液性状 | |
| ① | 蒸馏水 | 浅黄色澄清溶液: | 遇  溶液无明显变化 溶液无明显变化 |
| ② |  | 无色澄清溶液: | 遇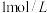  溶液微微变红 溶液微微变红 |
| ③ | 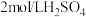 | 无色澄清溶液 | 遇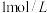  溶液微微变红 溶液微微变红 |
(1)用平衡移动原理解释①显酸性的主要原因是
(2)②、③变红时发生反应的离子方程式是
(3)甲同学认为①中一定有+3价铁。他用激光笔照射“溶液”,观察到光路:又向含有KSCN的①中滴入试剂a,溶液变红,说明其推断正确,试剂a是
II
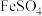 溶液的保存
溶液的保存将实验I中配制的三份溶液分别在空气中放置24小时后,记录如下。
| 溶液编号 | 溶液性状 | |
| ① | 橙色浑浊 | 用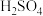 酸化后,浊液变澄清,再滴加5滴 酸化后,浊液变澄清,再滴加5滴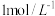 KSCN溶液后变深红 KSCN溶液后变深红 |
| ② | 无色溶液 | 滴加5滴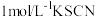 溶液后显浅红色 溶液后显浅红色 |
| ③ | 无色溶液 | 滴加5滴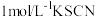 溶液后显红色,颜色比②略深 溶液后显红色,颜色比②略深 |
【分析讨论】①②说明酸性减弱时,
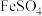 溶液更易变质;②③说明……
溶液更易变质;②③说明……【查阅资料】在一定pH范围内,+2价铁的还原性随酸性减弱而增强,氧气的氧化性随酸性的增强而增强。
【进行实验】用右图所示装置完成实验(滴加试剂时溶液体积和溶液导电性变化可忽略)。向右池持续稳定通入氧气,待电流表示数稳定后:

I向左池滴加浓硫酸至
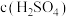 接近
接近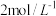 ,电流没有明显变化
,电流没有明显变化II向右池滴加等量浓硫酸,电流明显增大。
(4)补全【分析讨论】:②③说明
(5)ii中右池的电极反应方程式是
(6)依据实验推断:③比②中
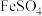 更易变质的原因是
更易变质的原因是(7)按上述原理及装置重新进行实验证实①中
 更易变质的原因。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,
更易变质的原因。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,(8)依据实验,配制并保存
 溶液的最佳方法是
溶液的最佳方法是
您最近一年使用:0次
名校
解题方法
3 . 探究亚硝酸钠( NaNO2 )的化学性质,实验如下:
资料: AgNO2是淡黄色难溶于水的固体;由上述实验所得结论不正确的是
| 实验 | 装置 | 试剂a | 现象 |
| ① | 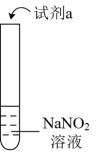 | 酚酞溶液 | 无色溶液变红 |
| ② | AgNO3溶液 | 产生淡黄色沉淀 | |
| ③ | 淀粉KI溶液+稀硫酸 | 无 色溶液立即变蓝 | |
| ④ | 酸性K2Cr2O7溶液 | 无色溶液变为绿色 |
| A.NaNO2溶液显碱性 |
B.NaNO2可与某些盐发生复分解反应: +Ag+= AgNO2↓ +Ag+= AgNO2↓ |
C.NaNO2有氧化性: 2I- +2H++2 =I2+2NO2 ↑+H2O =I2+2NO2 ↑+H2O |
D.NaNO2有还原性: +3 +3 +8H+=3 +8H+=3 +2Cr3++4H2O +2Cr3++4H2O |
您最近一年使用:0次
2022-05-25更新
|
329次组卷
|
6卷引用:北京市第二中学2022届高三下学期五月模拟考试化学试题
名校
解题方法
4 . 实验表明,当乙醛加入到溴水中,溴水会褪色。针对此现象,某小组同学依据乙醛结构进行探究。
【实验假设】
(1)假设Ⅰ:醛基含有不饱和键,可与 发生
发生_________ 反应(填反应类型)。
假设Ⅱ:乙醛具有α-H,可与溴水发生取代反应。一元取代反应如下:

无论是几元取代,参加反应的 与生成的HBr物质的量之比为
与生成的HBr物质的量之比为_________ 。
假设Ⅲ:乙醛具有较强的还原性,可被溴水氧化为乙酸,补全下面反应方程式。
方案Ⅰ:通过对比反应现象判断反应类型。
结论:假设Ⅰ不成立。
(2)试管2中的实验现象为__________ 。
方案Ⅱ:通过测定反应后混合液的pH判断反应类型。
注:苯酚和乙酸的电离及温度变化对混合液pH的影响可忽略。
(3)写出苯酚与溴水反应的化学方程式:____________________________________ 。
(4)若试管2中反应后混合液的pH=1.85,则证明乙醛与溴水的反应类型为______ 反应;若pH接近______ ,则证明为氧化反应(lg2≈0.3);若pH介于两者之间,则证明两种反应类型皆有。
【实验结论与反思】
(5)根据实验数据得出结论:乙醛与溴水发生氧化反应。查阅资料,乙醛并非直接与 发生反应,而是与次溴酸(HBrO)反应,从平衡移动的角度解释乙醛使溴水褪色的原因:
发生反应,而是与次溴酸(HBrO)反应,从平衡移动的角度解释乙醛使溴水褪色的原因:______________ 。
(6)已知柠檬醛的结构如图,结合上述实验,检验柠檬醛分子中存在碳碳双键的合理方法为 (填字母序号)。
【实验假设】
(1)假设Ⅰ:醛基含有不饱和键,可与
 发生
发生假设Ⅱ:乙醛具有α-H,可与溴水发生取代反应。一元取代反应如下:

无论是几元取代,参加反应的
 与生成的HBr物质的量之比为
与生成的HBr物质的量之比为假设Ⅲ:乙醛具有较强的还原性,可被溴水氧化为乙酸,补全下面反应方程式。







方案Ⅰ:通过对比反应现象判断反应类型。
序号 | 操作 | 现象 |
试管1 | 1mL溴水+1mL乙醛,充分振荡后静置 | 褪色 |
试管2 | 1mL溴的 溶液+1mL乙醛,充分振荡后静置 溶液+1mL乙醛,充分振荡后静置 | ____ |
(2)试管2中的实验现象为
方案Ⅱ:通过测定反应后混合液的pH判断反应类型。
序号 | 操作 | pH |
试管1 | 加入20mL溴水,再加入10mL苯酚溶液,待完全反应后(苯酚过量),测定混合液pH | 1.85 [ |
试管2 | 加入20mL相同浓度的溴水,再加入10mL 20%的乙醛溶液(乙醛过量),3min后完全褪色,测定混合液pH | ____________ |
(3)写出苯酚与溴水反应的化学方程式:
(4)若试管2中反应后混合液的pH=1.85,则证明乙醛与溴水的反应类型为
【实验结论与反思】
(5)根据实验数据得出结论:乙醛与溴水发生氧化反应。查阅资料,乙醛并非直接与
 发生反应,而是与次溴酸(HBrO)反应,从平衡移动的角度解释乙醛使溴水褪色的原因:
发生反应,而是与次溴酸(HBrO)反应,从平衡移动的角度解释乙醛使溴水褪色的原因:(6)已知柠檬醛的结构如图,结合上述实验,检验柠檬醛分子中存在碳碳双键的合理方法为 (填字母序号)。
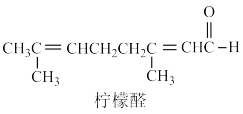
| A.向酸性高锰酸钾溶液中加适量柠檬醛,观察其是否褪色 |
| B.向溴水中加适量柠檬醛,观察其是否褪色 |
C.向溴的 溶液中加适量柠檬醛,观察其是否褪色 溶液中加适量柠檬醛,观察其是否褪色 |
| D.向新制氢氧化铜悬浊液中加适量柠檬醛,加热,冷却后取上层清液再加溴水,观察其是否褪色 |
您最近一年使用:0次
2022-11-02更新
|
574次组卷
|
7卷引用:北京市第二中学2022-2023学年高三上学期12月考化学试题
北京市第二中学2022-2023学年高三上学期12月考化学试题北京市海淀区2022-2023学年高三上学期期中考试化学试题(已下线)北京市海淀区2022届高三一模(实验探究题)(已下线)T28-实验探究题北京市第八中学2022-2023学年高二下学期期末考试化学试题北京理工大学附属中学2023-2024学年高二下学期期中考试化学试题 (已下线)题型突破02 有机实验(综合题)-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(北京专用)
名校
解题方法
5 . 84消毒液是一种常见的含氯消毒剂。如图为某品牌84消毒液的说明书中的部分内容。

(1)84消毒液的主要成分为_______ (用化学式表示)。
(2)常温,将氯气通入NaOH溶液中可制得84消毒液的主要成分。写出离子方程式:_______ 。
(3)某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO-、Cl-、HClO;相同浓度时,HClO的氧化性强于ClO-;ORP是反映水溶液中所有物质表现出来的氧化—还原性,ORP值越大,氧化性越强。
Ⅰ.向2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.向2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
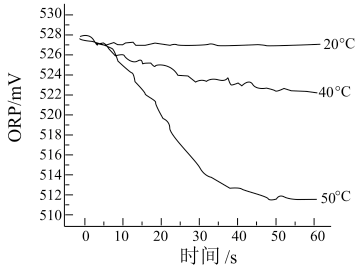
Ⅲ.测得84消毒液在不同温度时ORP随时间的变化曲线如下。
①已知白醋显酸性,不具有漂白性。实验Ⅰ、Ⅱ现象不同的原因是_______ 。
②实验表明,向84消毒液中加入较多稀硫酸时会产生氯气,生成氯气的离子方程式是_______ 。
③由实验Ⅲ可得出的结论是_______ 。ORP值不同的原因可能是_______ 。
(4)针对不同物品的消毒,84消毒液需要稀释到不同的浓度来使用。取含次氯酸钠14.9g/L的84消毒液1mL,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为_______ mol∙L−1。

| 产品特点 本品是以次氯酸钠为主要成分的液体消毒剂。可杀灭肠道致病菌、化脓性球菌、致病性酵母菌,并能灭活病毒。 注意事项 1.本品易使有色衣脱色,禁止用于丝、毛、麻织物的消毒。 2.不得将本品与酸性产品(如洁厕类清洁产品)同时使用。 3.置于避光、阴凉处保存。 4.需稀释后使用,勿口服。 |
(2)常温,将氯气通入NaOH溶液中可制得84消毒液的主要成分。写出离子方程式:
(3)某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO-、Cl-、HClO;相同浓度时,HClO的氧化性强于ClO-;ORP是反映水溶液中所有物质表现出来的氧化—还原性,ORP值越大,氧化性越强。
Ⅰ.向2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.向2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.测得84消毒液在不同温度时ORP随时间的变化曲线如下。

①已知白醋显酸性,不具有漂白性。实验Ⅰ、Ⅱ现象不同的原因是
②实验表明,向84消毒液中加入较多稀硫酸时会产生氯气,生成氯气的离子方程式是
③由实验Ⅲ可得出的结论是
(4)针对不同物品的消毒,84消毒液需要稀释到不同的浓度来使用。取含次氯酸钠14.9g/L的84消毒液1mL,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为
您最近一年使用:0次
2021-01-24更新
|
574次组卷
|
4卷引用:北京市东城区2020-2021学年高一上学期期末考试化学试题
名校
解题方法
6 . 某小组同学利用原电池装置探究物质的性质。
(1)同学们利用下表中装置进行实验并记录。
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是______________ 。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是______________ ;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是___________________ 。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素。
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是__________ 。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究________ 对O2氧化性的影响。
③实验Ⅳ中加入Na2SO4溶液的目的是_____________ 。
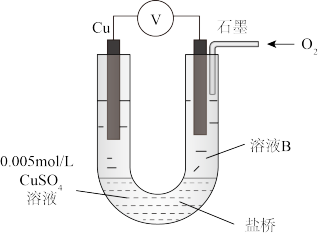
④为达到丁同学的目的,经讨论,同学们认为应改用下图装置对Ⅳ、Ⅴ重复进行实验,其设计意图是________ ;重复实验时,记录电压表读数依次为c′、d′,且c′>d′,由此得出的结论是______________________________ 。
| 资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。 |
| 装置 | 编号 | 电极A | 溶液B | 操作及现象 |
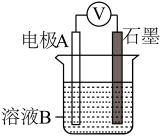 | Ⅰ | Fe | pH=2的H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
| Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素。
| 编号 | 溶液B | 操作及现象 |
| Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
| Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
| Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究
③实验Ⅳ中加入Na2SO4溶液的目的是
④为达到丁同学的目的,经讨论,同学们认为应改用下图装置对Ⅳ、Ⅴ重复进行实验,其设计意图是

您最近一年使用:0次
2018-06-04更新
|
266次组卷
|
7卷引用:2016届北京市东城区高三一模理综化学试卷
7 . 84消毒液在生活中有广泛的应用,其主要成份是NaCl和NaClO。
资料: HClO的电离常数为Ka=4.7×10-8;H2CO3的电离常数为Ka1=4.3×10-7,Ka2=5.6×10-11;HClO的氧化性和杀菌消毒效果强于ClO-。
(1)84消毒液溶液呈_______ (填“酸性”或“碱性”)。
(2)84消毒液和医用酒精都是重要的消毒剂。某实验小组同学围绕“84消毒液能否与医用酒精混合使用”这一问题进行了如下实验。
①实验Ⅲ中应分别取_______ mL 84消毒液和蒸馏水混合均匀。
②由实验现象推断,84消毒液和医用酒精_______ (填“能”或“不能”)混合使用。
(3)84消毒液可由氯气与NaOH溶液反应制得。为了防止消毒液在存储过程中失效,通常要在84消毒液中残余一定量的NaOH,请运用平衡移动原理解释NaOH的作用:_______ 。
(4)待消杀物品喷洒上84消毒液后,露置于空气中10~30分钟可增强消毒效果,该过程中发生反应的离子方程式为_______ 。请结合电离平衡常数解释消毒效果增强的原因:_______ 。
资料: HClO的电离常数为Ka=4.7×10-8;H2CO3的电离常数为Ka1=4.3×10-7,Ka2=5.6×10-11;HClO的氧化性和杀菌消毒效果强于ClO-。
(1)84消毒液溶液呈
(2)84消毒液和医用酒精都是重要的消毒剂。某实验小组同学围绕“84消毒液能否与医用酒精混合使用”这一问题进行了如下实验。
| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 分别取40 mL 84消毒液和医用酒精混合均匀,并测量溶液温度变化 | 溶液温度由20℃升高至23℃,并产生大量气泡,略有刺激性气味,溶液颜色无明显变化 |
| Ⅱ | 分别取40 mL医用酒精和蒸馏水混合均匀,水浴加热至23℃ | 溶液中无明显现象 |
| Ⅲ | 分别取_______ mL 84消毒液和蒸馏水混合均匀,水浴加热至23℃ | 溶液中无明显现象,略有刺激性气味 |
②由实验现象推断,84消毒液和医用酒精
(3)84消毒液可由氯气与NaOH溶液反应制得。为了防止消毒液在存储过程中失效,通常要在84消毒液中残余一定量的NaOH,请运用平衡移动原理解释NaOH的作用:
(4)待消杀物品喷洒上84消毒液后,露置于空气中10~30分钟可增强消毒效果,该过程中发生反应的离子方程式为
您最近一年使用:0次
2021-01-20更新
|
379次组卷
|
8卷引用:北京市第五十五中学2021-2022学年高二上学期期中考试化学试题
名校
解题方法
8 . 某兴趣小组同学探究KMnO4溶液与草酸(H2C2O4)溶液反应速率的影响因素。配制1.0×10-3mol/LKMnO4溶液、0.40mol/L草酸溶液。将KMnO4溶液与草酸溶液按如下比例混合。
【设计实验】
(1)实验①和②的目的是___________ 。
(2)甲认为上述实验应控制pH相同,可加入的试剂是___________ (填序号)。
a.盐酸 b.硫酸 c.草酸
【实施实验】
小组同学将溶液pH调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
i.紫色溶液转变为青色溶液,ii.青色溶液逐渐褪至无色溶液。
资料:(a) 无色,在草酸中不能形成配合物;
无色,在草酸中不能形成配合物;
(b) 无色,有强氧化性,发生反应
无色,有强氧化性,发生反应 (青绿色)后氧化性减弱;
(青绿色)后氧化性减弱;
(c) 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。
(3)乙同学从氧化还原角度推测阶段i中可能产生 ,你认为该观点是否合理,并说明理由:
,你认为该观点是否合理,并说明理由:___________ 。
【继续探究】
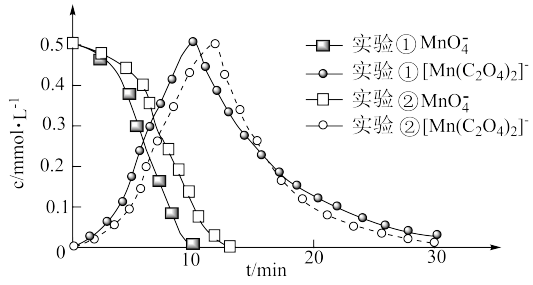
进一步实验证明溶液中含有 ,反应过程中
,反应过程中 和
和 浓度随时间的变化如下图。
浓度随时间的变化如下图。
(4)第i阶段中检测到有 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为___________ 。
(5)实验②在第ii阶段的反应速率较大,可能的原因是___________ 。
(6)据此推测,若在第ii阶段将 调节至
调节至 ,溶液褪至无色的时间会
,溶液褪至无色的时间会___________ (填“增加”“减少”或“不变”)。
【结论与反思】
(7)上述实验涉及的反应中,草酸的作用是___________ 。
结论:反应可能是分阶段进行的。草酸浓度的改变对不同阶段反应速率的影响可能不同。
【设计实验】
| 序号 | 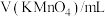 | 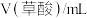 | 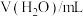 | 反应温度/℃ |
| ① | 2.0 | 2.0 | 0 | 20 |
| ② | 2.0 | 1.0 | 1.0 | 20 |
(2)甲认为上述实验应控制pH相同,可加入的试剂是
a.盐酸 b.硫酸 c.草酸
【实施实验】
小组同学将溶液pH调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
i.紫色溶液转变为青色溶液,ii.青色溶液逐渐褪至无色溶液。
资料:(a)
 无色,在草酸中不能形成配合物;
无色,在草酸中不能形成配合物;(b)
 无色,有强氧化性,发生反应
无色,有强氧化性,发生反应 (青绿色)后氧化性减弱;
(青绿色)后氧化性减弱;(c)
 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。(3)乙同学从氧化还原角度推测阶段i中可能产生
 ,你认为该观点是否合理,并说明理由:
,你认为该观点是否合理,并说明理由:【继续探究】
进一步实验证明溶液中含有
 ,反应过程中
,反应过程中 和
和 浓度随时间的变化如下图。
浓度随时间的变化如下图。
(4)第i阶段中检测到有
 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为(5)实验②在第ii阶段的反应速率较大,可能的原因是
(6)据此推测,若在第ii阶段将
 调节至
调节至 ,溶液褪至无色的时间会
,溶液褪至无色的时间会【结论与反思】
(7)上述实验涉及的反应中,草酸的作用是
结论:反应可能是分阶段进行的。草酸浓度的改变对不同阶段反应速率的影响可能不同。
您最近一年使用:0次
2022-04-01更新
|
1377次组卷
|
8卷引用:北京市第二中学2022-2023学年高二上学期10月月考化学试题
北京市第二中学2022-2023学年高二上学期10月月考化学试题北京市海淀区2022届高三一模化学试题(已下线)必刷卷03-2022年高考化学考前信息必刷卷(河北专用)北京第一零一中学2023届高三10月月考化学试题北京市第二十中学2022-2023学年高三上学期12月月考化学试题超重点8 碳酸盐、草酸盐的创新考查(已下线)北京市海淀区2022届高三一模(实验探究题)北京师范大学附属中学2022-2023学年高二上学期10月月考化学试题
9 . 某兴趣小组同学为探究黑木耳中含铁量,进行如下实验。
已知:ⅰ.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质(如维生素C)等。每100 g黑木耳含铁量高达185 mg。
ⅱ.紫红色的KMnO4溶液在酸性条件下具有强氧化性,其还原产物是无色的Mn2+。
Ⅰ.为确定黑木耳中含有铁元素,甲同学设计实验方案如下。
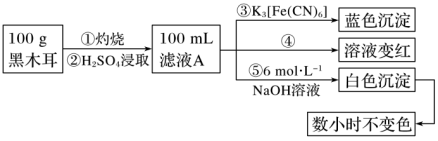
(1)步骤②得到滤液A的操作是___________ 。
(2)步骤④检验Fe3+所用试剂是___________ 溶液。
(3)根据上述实验得出的结论是___________ (填字母)。
a.黑木耳中一定含Fe2+和Fe3+
b.滤液A中一定含Fe2+和Fe3+
c.白色沉淀中一定含Fe(OH)2
Ⅱ.为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
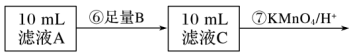
(4)可选做试剂B的物质是___________ (填字母)。
a.Na b.Zn c.Fe d.Cu
(5)步骤⑦中观察到的实验现象是___________ ,反应的离子方程式是___________ 。
(6)若乙同学实验操作规范,但测得含铁量远大于实际的含量,其可能的原因是___________ 。
已知:ⅰ.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质(如维生素C)等。每100 g黑木耳含铁量高达185 mg。
ⅱ.紫红色的KMnO4溶液在酸性条件下具有强氧化性,其还原产物是无色的Mn2+。
Ⅰ.为确定黑木耳中含有铁元素,甲同学设计实验方案如下。

(1)步骤②得到滤液A的操作是
(2)步骤④检验Fe3+所用试剂是
(3)根据上述实验得出的结论是
a.黑木耳中一定含Fe2+和Fe3+
b.滤液A中一定含Fe2+和Fe3+
c.白色沉淀中一定含Fe(OH)2
Ⅱ.为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。

(4)可选做试剂B的物质是
a.Na b.Zn c.Fe d.Cu
(5)步骤⑦中观察到的实验现象是
(6)若乙同学实验操作规范,但测得含铁量远大于实际的含量,其可能的原因是
您最近一年使用:0次
2022-03-31更新
|
198次组卷
|
5卷引用:【区级联考】北京市东城区2018-2019学年高一上学期期末检测化学试题
名校
解题方法
10 . 现榨的苹果汁由于含有Fe2+而显浅绿色,但是在空气中露置一段时间后会变成棕黄色,是因为Fe2+被氧化成 Fe3+。若榨汁的时候加入维生素C,可有效防止这种现象发生。由此可以推理得出维生素C具有
| A.氧化性 | B.还原性 | C.碱性 | D.酸性 |
您最近一年使用:0次
2020-11-03更新
|
110次组卷
|
2卷引用:北京市东直门中学2020-2021学年高一上学期10月阶段性考试化学试题

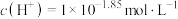 ]
]

