1 . 某化学小组欲测定一份长期放置的补铁药品(有效成分是琥珀酸亚铁,化学式为FeC4H4O4)是否已变质,实验如下:
Ⅰ.取补铁药样品10.00g,碾碎,溶于100.0mL稀盐酸中,过滤,滤液呈浅黄绿色;
Ⅱ.取少量滤液,滴加KSCN溶液,溶液变为浅红色,再滴入3滴H2O2溶液,溶液红色加深;
Ⅲ.准确量取I中滤液20.00mL,加入足量H2O2溶液,再加入足量NaOH溶液,过滤、洗涤、常温晾干,获得Fe(OH)3固体0.642g;
Ⅳ.再准确量取I中滤液20.00mL于大试管中,加入1.00g铜粉,用胶塞塞紧试管口,充分振荡后过滤,最后得到干燥的铜粉0.936g。
(1)I中琥珀酸亚铁与稀盐酸反应生成FeCl2和琥珀酸(分子式为C4H6O4),说明酸性:C4H6O4_______ HCl(填“>”或“<”)。
(2)用离子方程式解释II中实验现象产生的原因:_______ 、Fe3++3SCN-=Fe(SCN)3。
(3)IV中发生反应的离子方程式为_______ 。
(4)该补铁药中琥珀酸亚铁变质程度为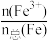 ×100%=
×100%=_______ (保留3位有效数字)。
(5)IV中溶液与铜粉反应时必须使用胶塞塞紧试管口,原因是_______ 。
Ⅰ.取补铁药样品10.00g,碾碎,溶于100.0mL稀盐酸中,过滤,滤液呈浅黄绿色;
Ⅱ.取少量滤液,滴加KSCN溶液,溶液变为浅红色,再滴入3滴H2O2溶液,溶液红色加深;
Ⅲ.准确量取I中滤液20.00mL,加入足量H2O2溶液,再加入足量NaOH溶液,过滤、洗涤、常温晾干,获得Fe(OH)3固体0.642g;
Ⅳ.再准确量取I中滤液20.00mL于大试管中,加入1.00g铜粉,用胶塞塞紧试管口,充分振荡后过滤,最后得到干燥的铜粉0.936g。
(1)I中琥珀酸亚铁与稀盐酸反应生成FeCl2和琥珀酸(分子式为C4H6O4),说明酸性:C4H6O4
(2)用离子方程式解释II中实验现象产生的原因:
(3)IV中发生反应的离子方程式为
(4)该补铁药中琥珀酸亚铁变质程度为
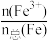 ×100%=
×100%=(5)IV中溶液与铜粉反应时必须使用胶塞塞紧试管口,原因是
您最近一年使用:0次
2023-08-26更新
|
171次组卷
|
5卷引用:北京市第一六六中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
2 . 扑热息痛是最常用的非抗炎解热镇痛药。对扑热息痛进行结构表征,测得的相关数据和谱图如下。回答下列问题:
Ⅰ.测定实验式。
将15.1g扑热息痛样品在足量纯氧中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,测得产物中水的质量为8.1g、二氧化碳的质量为35.2g。再将等量的样品通入二氧化碳气流中,在氧化铜/铜的作用下将有机物中氮元素转化成N2,测得N2的体积为1.12L(已换算成标准状况)。
(1)扑热息痛的实验式为___________ 。
Ⅱ.确定分子式。
测得目标化合物的质谱图如下:
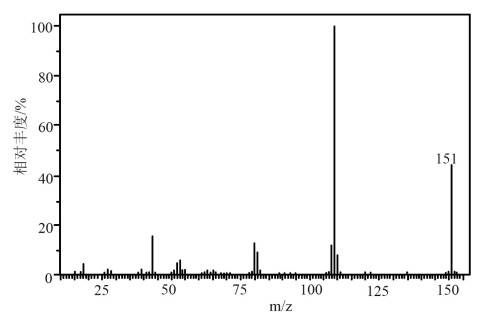
(2)其分子式为___________ 。
Ⅲ.推导结构式
(3)由分子式计算扑热息痛的不饱和度为___________ 。
用化学方法推断样品分子中的官能团:①加入NaHCO3溶液,无明显变化;②加入FeCl3溶液,显紫色:③水解可以得到一种两性化合物。
波谱分析:①测得目标化合物的红外光谱图如下:
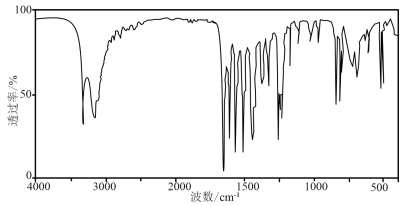
该有机化合物分子中存在: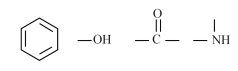
测得目标化合物的核磁共振氢谱图如下:
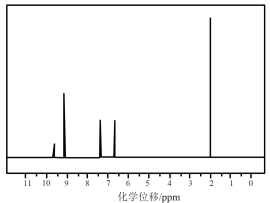
该有机化合物分子含有五种不同化学环境的H原子,其峰面积之比为1:1:2:2:3
(4)综上所述,扑热息痛的结构简式为___________ 。
(5)满足下列条件的扑热息痛的同分异构体有___________ 种,其中任意一种的结构简式是___________ 。
a.含苯环 b.含氨基和羧基,是两性化合物
Ⅰ.测定实验式。
将15.1g扑热息痛样品在足量纯氧中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,测得产物中水的质量为8.1g、二氧化碳的质量为35.2g。再将等量的样品通入二氧化碳气流中,在氧化铜/铜的作用下将有机物中氮元素转化成N2,测得N2的体积为1.12L(已换算成标准状况)。
(1)扑热息痛的实验式为
Ⅱ.确定分子式。
测得目标化合物的质谱图如下:

(2)其分子式为
Ⅲ.推导结构式
(3)由分子式计算扑热息痛的不饱和度为
用化学方法推断样品分子中的官能团:①加入NaHCO3溶液,无明显变化;②加入FeCl3溶液,显紫色:③水解可以得到一种两性化合物。
波谱分析:①测得目标化合物的红外光谱图如下:

该有机化合物分子中存在:
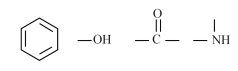
测得目标化合物的核磁共振氢谱图如下:

该有机化合物分子含有五种不同化学环境的H原子,其峰面积之比为1:1:2:2:3
(4)综上所述,扑热息痛的结构简式为
(5)满足下列条件的扑热息痛的同分异构体有
a.含苯环 b.含氨基和羧基,是两性化合物
您最近一年使用:0次
名校
3 . 溶有 的酸雨样品在空气中敞口放置一段时间后酸性增强。下列说法正确的是
的酸雨样品在空气中敞口放置一段时间后酸性增强。下列说法正确的是
 的酸雨样品在空气中敞口放置一段时间后酸性增强。下列说法正确的是
的酸雨样品在空气中敞口放置一段时间后酸性增强。下列说法正确的是| A.汽车发动机中的空气在高温条件下的反应是产生该类酸雨的原因 |
B.加入 溶液,通过产生白色沉淀可检验样品放置后的产物 溶液,通过产生白色沉淀可检验样品放置后的产物 |
C.放置过程中样品的酸性增强﹐是因为 浓度增大 浓度增大 |
D.放置过程中,空气中的 参与了反应 参与了反应 |
您最近一年使用:0次
2023-07-12更新
|
268次组卷
|
4卷引用:北京市东城区2022-2023学年高一下学期期末统一检测化学试题
北京市东城区2022-2023学年高一下学期期末统一检测化学试题北京市陈经纶中学2023-2024学年高一下学期3月月考化学试题(已下线)专题01 硫、氮及其化合物-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(北京专用)北京工业大学附属中学2023-2024学年高一下学期期中考试化学试题
名校
解题方法
4 . 研究小组为探究 在空气中变质后的产物,进行如下实验并记录现象。
在空气中变质后的产物,进行如下实验并记录现象。
实验①:取 样品加水溶解,得到澄清溶液a。
样品加水溶解,得到澄清溶液a。
实验②:取少量溶液a,向其中加入过量盐酸,有臭鸡蛋气味的气体生成,且出现淡黄色浑浊。
实验③:将实验②中的浊液过滤,向滤液中加入 溶液,产生白色沉淀。
溶液,产生白色沉淀。
已知信息:i. 溶液能溶解S,并生成
溶液能溶解S,并生成 ,
, 与酸反应生成S和
与酸反应生成S和 (臭鸡蛋气味);ii.
(臭鸡蛋气味);ii. 易溶于水。
易溶于水。
下列说法不正确的是
 在空气中变质后的产物,进行如下实验并记录现象。
在空气中变质后的产物,进行如下实验并记录现象。实验①:取
 样品加水溶解,得到澄清溶液a。
样品加水溶解,得到澄清溶液a。实验②:取少量溶液a,向其中加入过量盐酸,有臭鸡蛋气味的气体生成,且出现淡黄色浑浊。
实验③:将实验②中的浊液过滤,向滤液中加入
 溶液,产生白色沉淀。
溶液,产生白色沉淀。已知信息:i.
 溶液能溶解S,并生成
溶液能溶解S,并生成 ,
, 与酸反应生成S和
与酸反应生成S和 (臭鸡蛋气味);ii.
(臭鸡蛋气味);ii. 易溶于水。
易溶于水。下列说法不正确的是
A.实验②中淡黄色浑浊可能是 与 与 反应产生的 反应产生的 |
B.实验①和实验②说明 样品中一定含有S 样品中一定含有S |
C.实验③中产生的白色沉淀是 |
D. 样品中可能含有 样品中可能含有 |
您最近一年使用:0次
2023-02-09更新
|
693次组卷
|
12卷引用:北京市第二中学2022-2023学年高二下学期3月月考化学试题
北京市第二中学2022-2023学年高二下学期3月月考化学试题北京市西城区2021~2022学年高三上学期期末考试化学试题河北省五校联盟(保定市第一中学等)2021-2022学年高三下学期3月模拟考试化学试题(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)(已下线)化学-2022年高考押题预测卷01(北京卷)安徽省示范高中培优联盟 2022-2023学年高二上学期联赛化学试题黑龙江省佳木斯市第十二中学2022-2023学年高三上学期期中考试化学试题巩固训练7北京交通大学附属中学2023-2024学年高三上学期开学考试化学试题北京市第二中学2023-2024学年高三上学期12月月考化学试题北京市第一○一中学2023-2024学年高三下学期开学考试化学试题(已下线)北京市第四中学2023-2024学年高三下学期一模模拟化学试题
名校
解题方法
5 . 一种提纯白磷样品(含惰性杂质)的工艺流程如图所示。
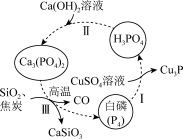
下列说法不正确 的是

下列说法
A. 的空间结构为正四面体形 的空间结构为正四面体形 |
| B.流程中所涉及元素的基态原子未成对电子数最多的是P |
| C.过程I、II、III中发生的均为氧化还原反应 |
| D.过程I中,氧化产物与还原产物的物质的量之比为6:5 |
您最近一年使用:0次
名校
解题方法
6 . 一种提纯白磷样品(含惰性杂质)的工艺流程如图所示。下列说法不正确的是
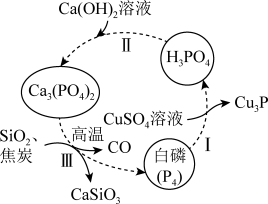

| A.过程Ⅰ中,氧化产物与还原产物的物质的量之比为6∶5 |
B. 的空间结构为正四面体形 的空间结构为正四面体形 |
| C.过程Ⅰ、Ⅱ、Ⅲ中发生的均为氧化还原反应 |
| D.流程中所涉及元素的基态原子未成对电子数最多的是P |
您最近一年使用:0次
2022-05-20更新
|
651次组卷
|
7卷引用:北京市第二中学2022届高三下学期五月模拟考试化学试题
名校
7 . Mn及其化合物在工业生产中具有重要的用途。
I.以含MnCO3的矿石为原料,经硫酸溶解得到含Mn2+的溶液,再经一系列处理后进行电解,获得金属Mn。
(1)Mn在_______ (填“阳极”或“阴极”)生成。
(2)阳极泥中含有MnO2,写出产生MnO2的电极反应式:_______ 。
II.阳极泥中除含锰元素外,还含有铅元素,采用如下方法可将它们分别转化为活性MnO2和PbO。
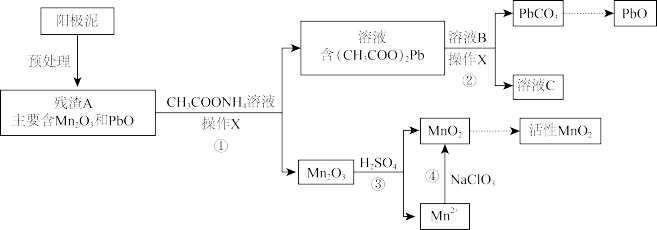
已知:(CH3COO)2Pb在水中难解离。
(3)操作X为_______ 。
(4)①中反应的离子方程式为_______ 。
(5)滤液C能循环使用,②中溶液B的溶质为_______ 。
(6)a.为了将③中Mn2O3完全转化为MnO2,理论上④中加入的NaClO3与Mn2O3的物质的量之比为_______ (已知NaClO3的还原产物为NaCl)。
b.加入NaClO3前,需将溶液pH调大至6左右。调节pH的目的是_______ 。
(7)活性MnO2纯度的测定
i.用V1mLc1mol∙L-1Na2C2O4溶液(H2SO4)酸化)溶解wg活性MnO2样。品。(MnO2+ +4H+=2CO2↑+Mn2++2H2O)
+4H+=2CO2↑+Mn2++2H2O)
ii.用c2mol∙L-1酸性KMnO4标准溶液滴定i中剩余的 消耗KMnO4标准溶液V2mL。(5
消耗KMnO4标准溶液V2mL。(5 +2
+2 +16H+=2Mn2++10CO2↑+8H2O)
+16H+=2Mn2++10CO2↑+8H2O)
样品中MnO2的质量分数=_______ [M(MnO2)=87g·mol-1]。
I.以含MnCO3的矿石为原料,经硫酸溶解得到含Mn2+的溶液,再经一系列处理后进行电解,获得金属Mn。
(1)Mn在
(2)阳极泥中含有MnO2,写出产生MnO2的电极反应式:
II.阳极泥中除含锰元素外,还含有铅元素,采用如下方法可将它们分别转化为活性MnO2和PbO。

已知:(CH3COO)2Pb在水中难解离。
(3)操作X为
(4)①中反应的离子方程式为
(5)滤液C能循环使用,②中溶液B的溶质为
(6)a.为了将③中Mn2O3完全转化为MnO2,理论上④中加入的NaClO3与Mn2O3的物质的量之比为
b.加入NaClO3前,需将溶液pH调大至6左右。调节pH的目的是
(7)活性MnO2纯度的测定
i.用V1mLc1mol∙L-1Na2C2O4溶液(H2SO4)酸化)溶解wg活性MnO2样。品。(MnO2+
 +4H+=2CO2↑+Mn2++2H2O)
+4H+=2CO2↑+Mn2++2H2O)ii.用c2mol∙L-1酸性KMnO4标准溶液滴定i中剩余的
 消耗KMnO4标准溶液V2mL。(5
消耗KMnO4标准溶液V2mL。(5 +2
+2 +16H+=2Mn2++10CO2↑+8H2O)
+16H+=2Mn2++10CO2↑+8H2O)样品中MnO2的质量分数=
您最近一年使用:0次
2022-05-08更新
|
495次组卷
|
4卷引用:北京市东城区2022届高三综合练习(二模)化学试题
名校
解题方法
8 . Cu2(OH)2CO3是用途广泛的化工原料。可用电解废渣[含Cu(NO3)2、AgNO3]和纯碱为原料制备。
(1)制备CuSO4溶液

①过程Ⅰ中,分解产生的气体除NO2外,一定还含有_______ 。
②过程Ⅱ中,分离所采用的试剂是_______ 。
(2)制备Cu2(OH)2CO3
ⅰ.取Na2CO3溶液于锥形瓶中,水浴加热至适当温度。
ⅱ.将CuSO4 溶液逐滴加入到Na2CO3溶液中,产生沉淀,静置。
ⅲ.待沉淀完全沉降后,减压过滤、洗涤、干燥。
①步骤ⅰ中加热Na2CO3溶液的目的是_______ 。
②步骤ⅱ中生成Cu2(OH)2CO3的化学方程式为_______ 。
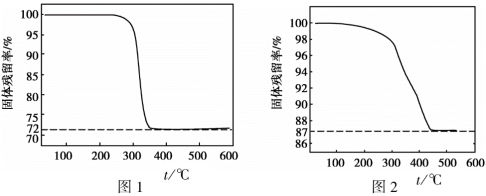
(3)设n(Na2CO3):n(CuSO4)=m,m不同时,所得产物纯度不同。通过测定固体样品的热重分析曲线(样品质量随温度变化曲线),获得固体残留率可检测样品纯度。(已知:固体残留率= ×100%)。
×100%)。
①写出Cu2(OH)2CO3分解的化学方程式_______ 。
②图1、图2分别是m = 1.2和m = 0.8时所得固体的热重分析曲线,依据下列曲线判断制备Cu2(OH)2CO3适宜的m =_______ (填“1.2”或“0.8”)。通过定量分析说明理由:_______ 。
(1)制备CuSO4溶液

①过程Ⅰ中,分解产生的气体除NO2外,一定还含有
②过程Ⅱ中,分离所采用的试剂是
(2)制备Cu2(OH)2CO3
ⅰ.取Na2CO3溶液于锥形瓶中,水浴加热至适当温度。
ⅱ.将CuSO4 溶液逐滴加入到Na2CO3溶液中,产生沉淀,静置。
ⅲ.待沉淀完全沉降后,减压过滤、洗涤、干燥。
①步骤ⅰ中加热Na2CO3溶液的目的是
②步骤ⅱ中生成Cu2(OH)2CO3的化学方程式为
(3)设n(Na2CO3):n(CuSO4)=m,m不同时,所得产物纯度不同。通过测定固体样品的热重分析曲线(样品质量随温度变化曲线),获得固体残留率可检测样品纯度。(已知:固体残留率=
 ×100%)。
×100%)。①写出Cu2(OH)2CO3分解的化学方程式
②图1、图2分别是m = 1.2和m = 0.8时所得固体的热重分析曲线,依据下列曲线判断制备Cu2(OH)2CO3适宜的m =

您最近一年使用:0次
2021-04-05更新
|
393次组卷
|
3卷引用:北京市第一七一中学2021-2022学年高三上学期12月月考化学试题
9 . 某课外小组探究硫化钠晶体( Na2S·9H2O)在空气中放置后的氧化产物。取少量在空气中放置一段时间的硫化钠晶体样品,溶于水得到溶液A,测得溶液A的pH为13。
查阅资料:
i.硫化钠晶体在空气中放置后,可能会有Na2Sx、Na2SO3、Na2S2O3等物质生成。
ii.S2-、S 、S2O
、S2O 都不能使品红褪色,SO
都不能使品红褪色,SO 或高浓度OH- 能使品红褪色。
或高浓度OH- 能使品红褪色。
ii. Na2Sx能与H+反应生成H2S(臭鸡蛋气味气体)和S; Na2Sx能与Cu2+反应生成CuS (黑色固体)和S; Na2S2O3可与Cu2+形成可溶性络合物,该络合物对稀盐酸稳定,受热易分解生成棕黑色沉淀。
(1)取未在空气中放置的硫化钠晶体,溶于水后测得溶液显碱性,用离子方程式解释其原因为__________ 。
(2)进行实验一。
①实验一证明氧化产物中有Na2SO3, 其中编号2实验的目的是________________ 。
②某同学由实验结果进一步推测硫化钠晶体的氧化产物中可能还含有Na2SO4,这是因为Na2SO3有____ 性。
(3)进行实验二。
取溶液A于试管中,加入足量的稀盐酸,立即出现淡黄色浑浊,同时产生大量臭鸡蛋气味的气体,离心沉降(固液分离),得到无色溶液B和淡黄色固体。
①取无色溶液B______ (填操作和现象), 证明溶液A中存在SO 。
。
②该实验现象不能证明样品中存在Na2Sx,因为______________ 。
(4)进行实验三。

①证明氧化产物中存在Na2S2O3的证据是_______________ 。
②溶液A中加入CuCl2溶液生成黑色沉淀,可能发生的反应是______ (用离子方程式表示)。
结论:硫化钠晶体在空气中放置后的氧化产物有Na2SO3、Na24SO4、Na2Sx和Na2S2O3。
查阅资料:
i.硫化钠晶体在空气中放置后,可能会有Na2Sx、Na2SO3、Na2S2O3等物质生成。
ii.S2-、S
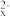 、S2O
、S2O 都不能使品红褪色,SO
都不能使品红褪色,SO 或高浓度OH- 能使品红褪色。
或高浓度OH- 能使品红褪色。ii. Na2Sx能与H+反应生成H2S(臭鸡蛋气味气体)和S; Na2Sx能与Cu2+反应生成CuS (黑色固体)和S; Na2S2O3可与Cu2+形成可溶性络合物,该络合物对稀盐酸稳定,受热易分解生成棕黑色沉淀。
(1)取未在空气中放置的硫化钠晶体,溶于水后测得溶液显碱性,用离子方程式解释其原因为
(2)进行实验一。
 | 编号 | 试剂 | 现象 |
| 1 | 溶液A | 立即褪色 | |
| 2 | pH=13的NaOH溶液 | 无明显变化 |
②某同学由实验结果进一步推测硫化钠晶体的氧化产物中可能还含有Na2SO4,这是因为Na2SO3有
(3)进行实验二。
取溶液A于试管中,加入足量的稀盐酸,立即出现淡黄色浑浊,同时产生大量臭鸡蛋气味的气体,离心沉降(固液分离),得到无色溶液B和淡黄色固体。
①取无色溶液B
 。
。②该实验现象不能证明样品中存在Na2Sx,因为
(4)进行实验三。

①证明氧化产物中存在Na2S2O3的证据是
②溶液A中加入CuCl2溶液生成黑色沉淀,可能发生的反应是
结论:硫化钠晶体在空气中放置后的氧化产物有Na2SO3、Na24SO4、Na2Sx和Na2S2O3。
您最近一年使用:0次
2020-11-06更新
|
233次组卷
|
2卷引用:北京市第二中学2022届高三下学期五月模拟考试化学试题
名校
解题方法
10 . 某小组为探究K3[Fe(C2O4)3·3H2O(三草酸合铁酸钾晶体)的热分解产物,按如图所示装置进行实验。下列有关叙述错误的是
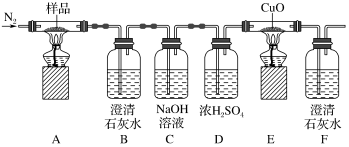

| A.通入氮气的目的有;隔绝空气、使反应产生的气体全部进入后续装置 |
| B.实验中观察到装置F中澄清石灰水变浑浊,装置E中固体变为红色,由此可判断热分解产物中一定含有CO2和CO |
| C.为防止倒吸,停止实验时应进行的操作是:先熄灭装置A、E的酒精灯,冷却后停止通入氮气 |
D.样品完全分解后,取少许装置A中残留物于试管中,加稀硫酸溶解,滴入1~2滴KSCN溶液,溶液变红色,可证明残留物中含有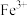 |
您最近一年使用:0次
2020-01-12更新
|
1488次组卷
|
8卷引用:北京市第一七一中学 2020-2021学年高一上学期期中考试化学试题
北京市第一七一中学 2020-2021学年高一上学期期中考试化学试题山东省日照一中2020届高三新高考3月份自测化学试题(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(二)山东省潍坊昌乐县第二中学2020届高三下学期3月阶段测试化学试题(已下线)【浙江新东方】绍兴qw78【省级联考】湖北省2020年第五届高考测评活动高三元月调考(一模)理综化学试题福建省厦门双十中学2022-2023学年高一上学期第二次月考化学试题福建省三明第一中学2023-2024学年高一上学期12月月考化学试题



