名校
解题方法
1 . 为实现碳中和,将 在一定条件下转化为化工原料,其中
在一定条件下转化为化工原料,其中 和
和 可发生如下两个平行反应:
可发生如下两个平行反应:
①

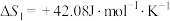
②
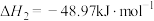
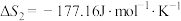
(1)根据所给信息,若要反应②自发进行,需要控制温度范围为___________ ℃(保留一位小数)。
(2)将 和
和 按物质的量之比
按物质的量之比 通入刚性密闭容器中,在催化剂作用下发生反应①和反应②,在相同的时间内
通入刚性密闭容器中,在催化剂作用下发生反应①和反应②,在相同的时间内 的选择性和产率随温度的变化如下表所示。
的选择性和产率随温度的变化如下表所示。
已知:X代表 的选择性=
的选择性=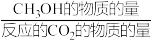 ×100%,Y代表甲醇的产率%
×100%,Y代表甲醇的产率%
①在上述条件下合成甲醇的工业条件是___________ 。
A.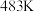 B.
B.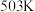
C.催化剂B(CZT) D.催化剂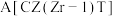
②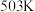 以上,升高温度导致
以上,升高温度导致 的转化率增大,甲醇的产率降低。可能的原因是
的转化率增大,甲醇的产率降低。可能的原因是___________ 。
(3)在容器体积不变的条件下,下列说法中,能判断反应②达到平衡状态的有___________ (填标号)。
A.混合气体总压强不再变化 B.断裂 键的同时断裂
键的同时断裂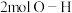 键
键
C. 和
和 的物质的量之比不再变化 D.混合气体的平均相对分子质量不再变化
的物质的量之比不再变化 D.混合气体的平均相对分子质量不再变化
E.混合气体的密度不再变化 F.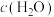 保持不变
保持不变
(4)若体积不变的密闭容器中只发生上述反应①,在进气比 不同、温度不同时,测得相应的
不同、温度不同时,测得相应的 平衡转化率如图所示。则B和D两点的温度
平衡转化率如图所示。则B和D两点的温度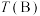
___________ 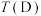 (选填“<”,“>”或“=”)。
(选填“<”,“>”或“=”)。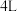 )、乙(容积为
)、乙(容积为 )两刚性容器中分别充入
)两刚性容器中分别充入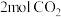 和
和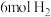 在适宜的催化剂作用下发生反应②,容器内总压强随时间变化如图所示:
在适宜的催化剂作用下发生反应②,容器内总压强随时间变化如图所示:___________ 容器中压强的变化情况(填“甲”或“乙”);
②利用图中数据计算250℃该反应的分压平衡常数
___________ (结果用分数表示)。
 在一定条件下转化为化工原料,其中
在一定条件下转化为化工原料,其中 和
和 可发生如下两个平行反应:
可发生如下两个平行反应:①


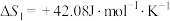
②

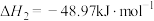
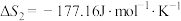
(1)根据所给信息,若要反应②自发进行,需要控制温度范围为
(2)将
 和
和 按物质的量之比
按物质的量之比 通入刚性密闭容器中,在催化剂作用下发生反应①和反应②,在相同的时间内
通入刚性密闭容器中,在催化剂作用下发生反应①和反应②,在相同的时间内 的选择性和产率随温度的变化如下表所示。
的选择性和产率随温度的变化如下表所示。已知:X代表
 的选择性=
的选择性=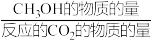 ×100%,Y代表甲醇的产率%
×100%,Y代表甲醇的产率%| 温度/K | 催化剂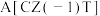 | 催化剂B(CZT) | ||
| X(甲醇选择性) | Y(甲醇产率) | X(甲醇选择性) | Y(甲醇产率) | |
| 483 | 38 | 2 | 19 | 0.9 |
| 503 | 26 | 4.5 | 33 | 2.2 |
| 523 | 23 | 3.9 | 30 | 1.9 |
| 543 | 18 | 3 | 25 | 1.8 |
| 563 | 16 | 3 | 25 | 1.6 |
①在上述条件下合成甲醇的工业条件是
A.
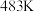 B.
B.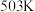
C.催化剂B(CZT) D.催化剂
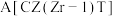
②
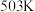 以上,升高温度导致
以上,升高温度导致 的转化率增大,甲醇的产率降低。可能的原因是
的转化率增大,甲醇的产率降低。可能的原因是(3)在容器体积不变的条件下,下列说法中,能判断反应②达到平衡状态的有
A.混合气体总压强不再变化 B.断裂
 键的同时断裂
键的同时断裂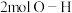 键
键C.
 和
和 的物质的量之比不再变化 D.混合气体的平均相对分子质量不再变化
的物质的量之比不再变化 D.混合气体的平均相对分子质量不再变化E.混合气体的密度不再变化 F.
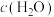 保持不变
保持不变(4)若体积不变的密闭容器中只发生上述反应①,在进气比
 不同、温度不同时,测得相应的
不同、温度不同时,测得相应的 平衡转化率如图所示。则B和D两点的温度
平衡转化率如图所示。则B和D两点的温度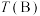
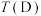 (选填“<”,“>”或“=”)。
(选填“<”,“>”或“=”)。
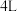 )、乙(容积为
)、乙(容积为 )两刚性容器中分别充入
)两刚性容器中分别充入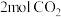 和
和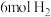 在适宜的催化剂作用下发生反应②,容器内总压强随时间变化如图所示:
在适宜的催化剂作用下发生反应②,容器内总压强随时间变化如图所示:
②利用图中数据计算250℃该反应的分压平衡常数

您最近一年使用:0次
2 . 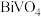 是一种光催化材料。工业利用某废催化剂(主要含
是一种光催化材料。工业利用某废催化剂(主要含 、
、 、
、 及少量
及少量 、
、 )制备
)制备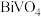 的工艺流程如下:
的工艺流程如下:
Ⅰ. 、
、 都是不溶于水的碱性氧化物
都是不溶于水的碱性氧化物
Ⅱ. 溶液的
溶液的
Ⅲ. (有机层)
(有机层) (有机层)
(有机层)
回答下列问题:
(1)基态镍原子核外电子排布式为___________ ,其核外有___________ 种能量不同的电子。
(2)滤渣的主要成分是___________ ;酸化时, 完全转化为
完全转化为 的最大pH为
的最大pH为___________ 。(已知
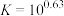 ;离子浓度
;离子浓度 时沉淀完全)
时沉淀完全)
(3)“酸化”后的溶液中存在 ,则“还原”时发生反应的离子方程式为
,则“还原”时发生反应的离子方程式为___________ 。
(4)若“萃取”、“反萃取”的过程中钒的总回收率为90%,则“还原”时加入的 和“氧化”时加入的
和“氧化”时加入的 的物质的量之比为
的物质的量之比为___________ 。
(5)生成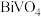 的化学方程式为
的化学方程式为___________ ,实验测得溶液pH、温度和 溶液浓度对生成
溶液浓度对生成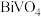 的粒径影响图像如下:
的粒径影响图像如下: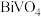 晶体的最佳条件是
晶体的最佳条件是___________ ;制备过程中需加入 维持最佳PH,若
维持最佳PH,若 过量,需要增加
过量,需要增加 的用量,原因是
的用量,原因是___________ 。
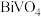 是一种光催化材料。工业利用某废催化剂(主要含
是一种光催化材料。工业利用某废催化剂(主要含 、
、 、
、 及少量
及少量 、
、 )制备
)制备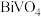 的工艺流程如下:
的工艺流程如下:
Ⅰ.
 、
、 都是不溶于水的碱性氧化物
都是不溶于水的碱性氧化物Ⅱ.
 溶液的
溶液的
Ⅲ.
 (有机层)
(有机层) (有机层)
(有机层)
回答下列问题:
(1)基态镍原子核外电子排布式为
(2)滤渣的主要成分是
 完全转化为
完全转化为 的最大pH为
的最大pH为
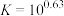 ;离子浓度
;离子浓度 时沉淀完全)
时沉淀完全)(3)“酸化”后的溶液中存在
 ,则“还原”时发生反应的离子方程式为
,则“还原”时发生反应的离子方程式为(4)若“萃取”、“反萃取”的过程中钒的总回收率为90%,则“还原”时加入的
 和“氧化”时加入的
和“氧化”时加入的 的物质的量之比为
的物质的量之比为(5)生成
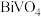 的化学方程式为
的化学方程式为 溶液浓度对生成
溶液浓度对生成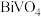 的粒径影响图像如下:
的粒径影响图像如下:
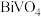 晶体的最佳条件是
晶体的最佳条件是 维持最佳PH,若
维持最佳PH,若 过量,需要增加
过量,需要增加 的用量,原因是
的用量,原因是
您最近一年使用:0次
名校
解题方法
3 . 某小组用淀粉水解液和浓 (作催化剂)、
(作催化剂)、 为原料制取草酸晶体
为原料制取草酸晶体 ,进而制备纳米草酸钙
,进而制备纳米草酸钙 ,按如下流程开展实验(夹持仪器略):
,按如下流程开展实验(夹持仪器略):
①草酸能溶于水,易溶于乙醇;
②纳米草酸钙难溶于水,高温易分解;
③淀粉水解液与混酸反应的方程式: 。
。
请回答下列问题:
(1)仪器甲相比普通分液漏斗的优点是___________ ,步骤Ⅱ的操作名称是___________ 。
(2)NO不与 反应,但在本实验中可以完全被吸收,请用离子方程式表示NO被完全吸收的原因
反应,但在本实验中可以完全被吸收,请用离子方程式表示NO被完全吸收的原因___________ 。
(3)催化剂浓硫酸用量过多,会导致草酸产率减少,原因是___________ 。
(4)下列有关操作说法正确的是___________。
(5)草酸晶体 含有结晶水。
含有结晶水。
Ⅰ.甲同学通过如下实验测定其组成:
①配制标准氢氧化钠溶液。
②标定氢氧化钠溶液的浓度。
③滴定:准确称取一定质量草酸晶体于锥形瓶中,用蒸馏水溶解,以酚酞作指示剂,用上述 标准溶液滴定。若草酸晶体中混有
标准溶液滴定。若草酸晶体中混有 ,则该滴定法测得产品中x的值
,则该滴定法测得产品中x的值___________ (填“偏大”“偏小”“无影响”)。
Ⅱ.乙同学取产品 ,加蒸馏水定容至
,加蒸馏水定容至 摇匀,取
摇匀,取 于锥形瓶中,用
于锥形瓶中,用 酸性
酸性 标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为
标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为 、
、 、
、 。假设其他杂质不干扰结果,产品中结晶水x为
。假设其他杂质不干扰结果,产品中结晶水x为___________ 。
 (作催化剂)、
(作催化剂)、 为原料制取草酸晶体
为原料制取草酸晶体 ,进而制备纳米草酸钙
,进而制备纳米草酸钙 ,按如下流程开展实验(夹持仪器略):
,按如下流程开展实验(夹持仪器略):

①草酸能溶于水,易溶于乙醇;
②纳米草酸钙难溶于水,高温易分解;
③淀粉水解液与混酸反应的方程式:
 。
。请回答下列问题:
(1)仪器甲相比普通分液漏斗的优点是
(2)NO不与
 反应,但在本实验中可以完全被吸收,请用离子方程式表示NO被完全吸收的原因
反应,但在本实验中可以完全被吸收,请用离子方程式表示NO被完全吸收的原因(3)催化剂浓硫酸用量过多,会导致草酸产率减少,原因是
(4)下列有关操作说法正确的是___________。
| A.步骤Ⅲ洗涤可用乙醇水溶液,步骤Ⅳ洗涤可用蒸馏水 |
| B.步骤Ⅳ采用离心分离,装置如图2所示,操作时应将两支离心管放置于1、4处 |
| C.步骤Ⅳ检验纳米二水草酸钙是否洗涤干净可用硝酸银溶液和稀硝酸 |
| D.步骤Ⅴ为提高反应速率,也可采用更高温度加热 |
(5)草酸晶体
 含有结晶水。
含有结晶水。Ⅰ.甲同学通过如下实验测定其组成:
①配制标准氢氧化钠溶液。
②标定氢氧化钠溶液的浓度。
③滴定:准确称取一定质量草酸晶体于锥形瓶中,用蒸馏水溶解,以酚酞作指示剂,用上述
 标准溶液滴定。若草酸晶体中混有
标准溶液滴定。若草酸晶体中混有 ,则该滴定法测得产品中x的值
,则该滴定法测得产品中x的值Ⅱ.乙同学取产品
 ,加蒸馏水定容至
,加蒸馏水定容至 摇匀,取
摇匀,取 于锥形瓶中,用
于锥形瓶中,用 酸性
酸性 标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为
标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为 、
、 、
、 。假设其他杂质不干扰结果,产品中结晶水x为
。假设其他杂质不干扰结果,产品中结晶水x为
您最近一年使用:0次
名校
解题方法
4 . 化学是以实验为基础的学科,下列实验操作、现象、结论均合理的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将乙醇与浓硫酸的混合物加热至170℃,并将产生的气体干燥后通入少量溴的四氯化碳溶液中 | 溴的四氯化碳溶液褪色 | 乙醇发生了消去反应 |
| B | 在硫酸钡沉淀中加入浓碳酸钠溶液,充分搅拌后,取沉淀(洗净)放入盐酸中 | 有气泡产生 | 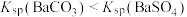 |
| C | 取少量酸催化后的淀粉水解液于试管中,先加入过量氢氧化钠溶液中和酸,再加少量碘水 | 溶液未变蓝 | 淀粉已经完全水解 |
| D | 向盛有 溶液的试管中滴加碳酸氢钠溶液 溶液的试管中滴加碳酸氢钠溶液 | 产生白色沉淀和无色无味的气体 |  与 与 发生了双水解反应 发生了双水解反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
5 . 设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A. 和 和 混合固体中含 混合固体中含 的数目为 的数目为 |
B.向 溶液中通入适量 溶液中通入适量 ,当有 ,当有 被氧化时,共转移电子的数目为 被氧化时,共转移电子的数目为 |
C.用电解的方法将酸性废水中的 转化为 转化为 而除去,阴极为石墨,阳极为铁,理论上电路中每通过 而除去,阴极为石墨,阳极为铁,理论上电路中每通过 电子,就有 电子,就有 个 个 被还原 被还原 |
D.  含 含 键的数目为 键的数目为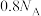 |
您最近一年使用:0次
名校
6 . 关于非金属含氧酸及其盐的性质,下列说法正确的是
| A.Cu与浓硝酸反应比与稀硝酸反应快,所以实验室通常用浓硝酸洗涤附着在试管内壁上的银镜 |
B.加热浓硫酸与 固体的混合物可制备 固体的混合物可制备 ,说明浓硫酸酸性强于 ,说明浓硫酸酸性强于 |
C.将 通入 通入 :溶液无明显现象,则将 :溶液无明显现象,则将 通入 通入 溶液也无明显现象 溶液也无明显现象 |
D.向 溶液中滴加酚酞试剂先变红后褪色,证明 溶液中滴加酚酞试剂先变红后褪色,证明 在溶液中发生了水解反应 在溶液中发生了水解反应 |
您最近一年使用:0次
名校
解题方法
7 . 化学与科技、生产、生活、社会密切相关,下列有关说法不正确的是
| A.2024年央视春晚舞蹈《瓷影》所诠释的青花瓷,其主要原材料为含水的铝硅酸盐 |
| B.5G-A技术所需高频通讯材料之一的LCP(液晶高分子)在一定加热状态下一般会变成液晶,液晶既具有液体的流动性,又表现出类似晶体的各向异性 |
| C.绿色化学的核心思想是治理经济发展所带来的环境污染 |
| D.甘油二酯油是国际公认的健康油脂发展方向,当其进入人体后,可以迅速在体内代谢,从根源上改善多种代谢类疾病。它与普通油脂成分不完全相同,但都可以发生水解反应 |
您最近一年使用:0次
名校
解题方法
8 . 屠呦呦因在抗疟药青蒿素研究中的杰出贡献,成为首个获科学类诺贝尔奖的中国人,青蒿素的结构简式如图所示,回答下列问题:________ (填“烃”还是“烃的衍生物”),是________ (填“脂肪化合物”还是“脂环化合物”)。
(2)青蒿素分子的不饱和度为________ 。
(3)青蒿素分子中具有的官能团有________。
(4)对二甲苯(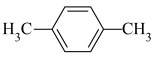 )的一氯代物有
)的一氯代物有________ 种。
(5)分离 与
与 混合物的方法是
混合物的方法是________ 。
(6)庚烷含有三个甲基的同分异构体有________ 种。
(7)分子式为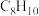 的芳香烃,苯环上的一氯代物有3种,写出所有符合条件的芳香烃的结构简式
的芳香烃,苯环上的一氯代物有3种,写出所有符合条件的芳香烃的结构简式________ 。
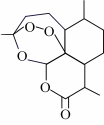
(2)青蒿素分子的不饱和度为
(3)青蒿素分子中具有的官能团有________。
| A.羟基 | B.醚键 | C.羧基 | D.酯基 |
(4)对二甲苯(
 )的一氯代物有
)的一氯代物有(5)分离
 与
与 混合物的方法是
混合物的方法是(6)庚烷含有三个甲基的同分异构体有
(7)分子式为
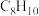 的芳香烃,苯环上的一氯代物有3种,写出所有符合条件的芳香烃的结构简式
的芳香烃,苯环上的一氯代物有3种,写出所有符合条件的芳香烃的结构简式
您最近一年使用:0次
2024-04-27更新
|
370次组卷
|
2卷引用:辽宁省鞍山市2023-2024学年高二下学期4月月考化学试题
9 . 研究氮的循环和转化对生产,生活有重要的价值。
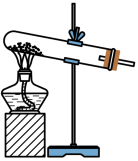
(1)写出用如图所示装置进行实验室制备氨气的化学方程式___________ 。___________ ;___________ 。
②设备2中通入的物质A是___________ 。
(3)氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以 和
和 的形式存在。某工厂处理氨氮废水的流程如图:
的形式存在。某工厂处理氨氮废水的流程如图:
含 的废水
的废水 低浓度氨氮废水
低浓度氨氮废水 含余氯废水
含余氯废水 达标
达标
①过程①的目的是将 转化为
转化为 ,并通过鼓入大量空气将氨气吹出,写出
,并通过鼓入大量空气将氨气吹出,写出 转化为
转化为 的离子方程式
的离子方程式___________ 。
②过程②加入 溶液可将氨氮物质转化为无毒物质氮气,请用离子方程式表示该转化过程
溶液可将氨氮物质转化为无毒物质氮气,请用离子方程式表示该转化过程___________ 。
③含余氯废水的主要成分是 以及
以及 可选用以下哪种溶液以达到将余氯转化为无毒物质的目的
可选用以下哪种溶液以达到将余氯转化为无毒物质的目的___________ (填字母)。
a. b.
b. c.
c. d.
d.
写出其中一个反应的离子方程式:___________ 。
(4) 是燃油汽车尾气中的主要污染物之一、在催化剂和加热条件下,
是燃油汽车尾气中的主要污染物之一、在催化剂和加热条件下, 与
与 可反应生成无害物质,请写出反应的化学方程式
可反应生成无害物质,请写出反应的化学方程式___________ 。
(1)写出用如图所示装置进行实验室制备氨气的化学方程式
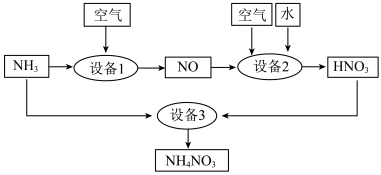
②设备2中通入的物质A是
(3)氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以
 和
和 的形式存在。某工厂处理氨氮废水的流程如图:
的形式存在。某工厂处理氨氮废水的流程如图:含
 的废水
的废水 低浓度氨氮废水
低浓度氨氮废水 含余氯废水
含余氯废水 达标
达标①过程①的目的是将
 转化为
转化为 ,并通过鼓入大量空气将氨气吹出,写出
,并通过鼓入大量空气将氨气吹出,写出 转化为
转化为 的离子方程式
的离子方程式②过程②加入
 溶液可将氨氮物质转化为无毒物质氮气,请用离子方程式表示该转化过程
溶液可将氨氮物质转化为无毒物质氮气,请用离子方程式表示该转化过程③含余氯废水的主要成分是
 以及
以及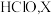 可选用以下哪种溶液以达到将余氯转化为无毒物质的目的
可选用以下哪种溶液以达到将余氯转化为无毒物质的目的a.
 b.
b. c.
c. d.
d.
写出其中一个反应的离子方程式:
(4)
 是燃油汽车尾气中的主要污染物之一、在催化剂和加热条件下,
是燃油汽车尾气中的主要污染物之一、在催化剂和加热条件下, 与
与 可反应生成无害物质,请写出反应的化学方程式
可反应生成无害物质,请写出反应的化学方程式
您最近一年使用:0次
10 . 物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据如图所示,回答下列问题: 的化学式为
的化学式为___________ 。食品中添加适量的 ,可以起到
,可以起到___________ (填两点即可)作用;燃煤时为减少 的排放,可在煤中添加
的排放,可在煤中添加___________ (填名称)。
(2) 与
与 反应时,随着
反应时,随着 的浓度逐渐增大,化学反应速率的变化是
的浓度逐渐增大,化学反应速率的变化是___________ ; 的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为
的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为___________ 。
(3)欲制备 ,从氧化还原角度分析,合理的是
,从氧化还原角度分析,合理的是___________ (填序号)。
a. b.
b. c.
c. d.
d. 
(4)将 与
与 混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为
混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为___________ 。

 的化学式为
的化学式为 ,可以起到
,可以起到 的排放,可在煤中添加
的排放,可在煤中添加(2)
 与
与 反应时,随着
反应时,随着 的浓度逐渐增大,化学反应速率的变化是
的浓度逐渐增大,化学反应速率的变化是 的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为
的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为(3)欲制备
 ,从氧化还原角度分析,合理的是
,从氧化还原角度分析,合理的是a.
 b.
b. c.
c. d.
d. 
(4)将
 与
与 混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为
混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为
您最近一年使用:0次



