1 . 从含钴余液(含 、
、 、
、 、
、 等杂质)中提取氧化钴的流程如下:
等杂质)中提取氧化钴的流程如下:
(1)在去除钙、镁时,选择适当加热条件的理由是___________ ;该步骤控制pH是影响除钙镁效果的重要因素,下图是不同pH条件下硫化钴含量和钴收率图,根据图中信息选择最适宜的pH为___________ ;___________ ;
(3)已知P507萃取剂 和
和 发生如下反应:
发生如下反应:
萃取时适当增加溶液的pH,能增大 的萃取率,原因是
的萃取率,原因是___________ ;
(4)反萃取时加入的试剂a应为___________(填代号);
(5)沉钴的离子方程式为___________ ;
(6)系列操作中如何检验 是否洗涤干净
是否洗涤干净___________ ;
(7)空气中煅烧 生成钴的某种氧化物和
生成钴的某种氧化物和 ,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下
,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下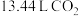 ,则钴的氧化物的化学式为
,则钴的氧化物的化学式为___________ 。
 、
、 、
、 、
、 等杂质)中提取氧化钴的流程如下:
等杂质)中提取氧化钴的流程如下: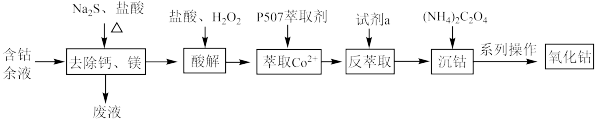
(1)在去除钙、镁时,选择适当加热条件的理由是

(3)已知P507萃取剂
 和
和 发生如下反应:
发生如下反应:
萃取时适当增加溶液的pH,能增大
 的萃取率,原因是
的萃取率,原因是(4)反萃取时加入的试剂a应为___________(填代号);
A. | B.HCl | C.NaOH | D. |
(5)沉钴的离子方程式为
(6)系列操作中如何检验
 是否洗涤干净
是否洗涤干净(7)空气中煅烧
 生成钴的某种氧化物和
生成钴的某种氧化物和 ,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下
,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下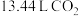 ,则钴的氧化物的化学式为
,则钴的氧化物的化学式为
您最近一年使用:0次
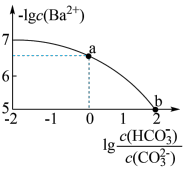
2 . 室温下,向Na2CO3和NaHCO3的混合溶液中逐滴加入BaCl2溶液,溶液中-1gc(Ba2+)与 的关系如图所示(已知:
的关系如图所示(已知: 、
、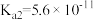 ;
; )。下列说法正确的是
)。下列说法正确的是
 的关系如图所示(已知:
的关系如图所示(已知: 、
、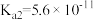 ;
; )。下列说法正确的是
)。下列说法正确的是
| A.a对应溶液pH=6.5 |
B.b对应溶液的c(HCO )=0.05mol/L )=0.05mol/L |
C.a→b的过程中,溶液中 一直增大 一直增大 |
D.a对应的溶液中一定存在: |
您最近一年使用:0次
2023-09-01更新
|
1178次组卷
|
3卷引用:辽宁省鞍山市2023-2024学年高三上学期第一次质量监测化学试题
辽宁省鞍山市2023-2024学年高三上学期第一次质量监测化学试题(已下线)考点4 沉淀溶解平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)内蒙古赤峰二中2023-2024学年高三上学期10月月考化学试题
3 . 空气污染问题日益引起全民关注。工业生产中产生的SO2、NO等为主要污染物。根据你所学化学知识完成下列问题:
Ⅰ.(1)PM2.5是指大气中直径小于或等于2.5μm(1μm=103nm)的颗粒物。下列说法不正确的是_________ (填字母序号)。
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)SO2为重要的含硫化合物,是形成酸雨的主要污染物之一。在实验室中,若用70%的硫酸溶液和亚硫酸钠粉末反应制取二氧化硫,并要求方便控制反应速率,可选用如图所示气体发生装置中的_______ (填下列序号字母)。

(3)为研究SO2的性质,如图在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条火准)。
下列有关说法正确的是___________

(4)一定温度下,在密闭容器中SO2与O2反应生成1molSO3气体时,放出akJ热量。
①该温度下SO2与O2反应的热化学方程式为__________________________ 。
②已知:2NO(g)+O2(g)═2NO2(g) △H=" -b" kJ•mol-1(a>b>0)
则反应NO2(g)+SO2(g)═SO3(g)+NO(g) 的△H=________________ 。
Ⅱ.硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需要处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中的二氧化硫的含量,采用以下方案:
实验步骤如下图流程图所示:
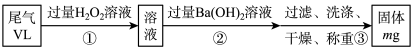
(1)步骤①中反应的离子方程式为____________________________ 。
(2)步骤②中Ba(OH)2是否足量的判断方法是____________________________ 。
Ⅲ.工业生产中产生的SO2、NO直接排放将对大气造成严重污染。利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素).

请回答下列问题.
(1)装置Ⅱ中的反应在酸性条件下进行,写出NO被氧化为NO2-的离子方程式__________ 。
(2)装置Ⅲ的作用之一是再生Ce4+,其原理如图所示;

图中A为电源的______ (填“正”或“负”)极.右侧反应室中发生的主要电极反应式为__________ 。
(3)已知进入装置Ⅳ的溶液中NO2-的浓度为 0.75mol/L,要使 1m3该溶液中的NO2-完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为_______ L。
Ⅰ.(1)PM2.5是指大气中直径小于或等于2.5μm(1μm=103nm)的颗粒物。下列说法不正确的是
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)SO2为重要的含硫化合物,是形成酸雨的主要污染物之一。在实验室中,若用70%的硫酸溶液和亚硫酸钠粉末反应制取二氧化硫,并要求方便控制反应速率,可选用如图所示气体发生装置中的

(3)为研究SO2的性质,如图在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条火准)。
下列有关说法正确的是

| A.蓝色石蕊试纸先变红后褪色 |
| B.湿润的品红试纸、蘸有KMnO4溶液的滤纸均褪色证明SO2具有漂白性 |
| C.湿润的淀粉KI-试纸未变蓝说明SO2的氧化性强于I2 |
| D.NaOH溶液可用于除去实验中多余的SO2 |
①该温度下SO2与O2反应的热化学方程式为
②已知:2NO(g)+O2(g)═2NO2(g) △H=" -b" kJ•mol-1(a>b>0)
则反应NO2(g)+SO2(g)═SO3(g)+NO(g) 的△H=
Ⅱ.硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需要处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中的二氧化硫的含量,采用以下方案:
实验步骤如下图流程图所示:
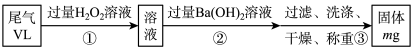
(1)步骤①中反应的离子方程式为
(2)步骤②中Ba(OH)2是否足量的判断方法是
Ⅲ.工业生产中产生的SO2、NO直接排放将对大气造成严重污染。利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素).

请回答下列问题.
(1)装置Ⅱ中的反应在酸性条件下进行,写出NO被氧化为NO2-的离子方程式
(2)装置Ⅲ的作用之一是再生Ce4+,其原理如图所示;

图中A为电源的
(3)已知进入装置Ⅳ的溶液中NO2-的浓度为 0.75mol/L,要使 1m3该溶液中的NO2-完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为
您最近一年使用:0次
13-14高二上·辽宁鞍山·期中
名校
4 . 在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,曲线如图所示,有关粒子的浓度关系正确的是
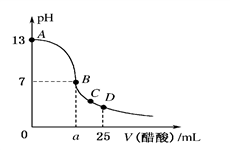

| A.在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)> c(H+) >c(OH-) |
| B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+) |
| C.在C点:c(CH3COO-)>c(Na+)> c(OH-) > c(H+) |
| D.在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
您最近一年使用:0次
2018-01-13更新
|
2115次组卷
|
6卷引用:2013届辽宁省鞍山一中上学期期中考试高二年级化学试卷
名校
5 . 某强酸性的透明溶液中可能含有下列微粒中的几种。
阴离子:MnO4-、SiO32-、CO32-、I-、ClO-、SO32-
阳离子:Fe3+、Fe2+、NH4+、Ag+、Al3+、K+
分子:H2SO3
取该溶液进行以下连续实验。
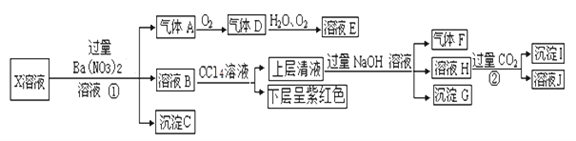
根据以上信息,回答下列问题:
(1)根据“强酸性的透明溶液”可知溶液中不含有的微粒是_____________ ;
(2)沉淀I的化学式为_____________ ;
(3)X溶液中,除H+、Al3+外还肯定含有的微粒是_____________ 。
阴离子:MnO4-、SiO32-、CO32-、I-、ClO-、SO32-
阳离子:Fe3+、Fe2+、NH4+、Ag+、Al3+、K+
分子:H2SO3
取该溶液进行以下连续实验。

根据以上信息,回答下列问题:
(1)根据“强酸性的透明溶液”可知溶液中不含有的微粒是
(2)沉淀I的化学式为
(3)X溶液中,除H+、Al3+外还肯定含有的微粒是
您最近一年使用:0次
6 . 实验研究发现,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出(已知硝酸的还原产物是NH4NO3)。在反应结束后的溶液中,逐滴加入5mol/L的NaOH溶液。所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如下图所示。则下列说法错误的是:

| A.铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为5:4 |
| B.原硝酸溶液中含硝酸的物质的量为0.5mol |
| C.B与A的差值为0.05 mol |
| D.反应结束后的溶液仍有硝酸剩余 |
您最近一年使用:0次
2017-03-17更新
|
2728次组卷
|
2卷引用:2016-2017学年辽宁省鞍山市第一中学高一3月月考化学试卷
7 . 青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药.已知:乙醚沸点为35℃.从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为如图:
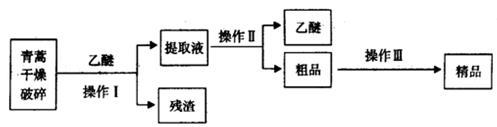
(1)对青蒿进行干燥破碎的目的是_________________________________ ;
(2)操作I需要的玻璃仪器主要有:烧杯、______________ ,操作Ⅱ的名称是______________ ;
(3)操作Ⅲ的主要过程可能是______________ (填字母);
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。

①装置A、E、F中盛放的物质分别是_________ 、__________ 、__________ ;
②G的作用是____________________________ ;
③
则测得青蒿素的最简式是______________ ,欲确定其分子式,则还需要的物理量为____________ ;
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与______________ (填字母)具有相同的性质;
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如图所示:
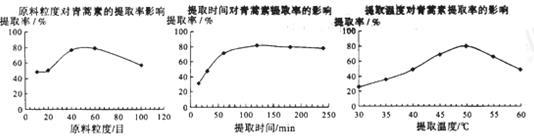
由上图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为______________ 。
A.80目、100分钟、50℃B.60目、120分钟、50℃C.60目、120分钟、55℃

(1)对青蒿进行干燥破碎的目的是
(2)操作I需要的玻璃仪器主要有:烧杯、
(3)操作Ⅲ的主要过程可能是
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。

①装置A、E、F中盛放的物质分别是
②G的作用是
③
| 装置 | 实验前/g | 实验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如图所示:

由上图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为
A.80目、100分钟、50℃B.60目、120分钟、50℃C.60目、120分钟、55℃
您最近一年使用:0次
8 . 【化学——选修3 物质结构与性质】选考下图为元素周期表的一部分,字母下方数值为该元素电负性,根据信息回答下列问题(用相应元素符号进行答题):
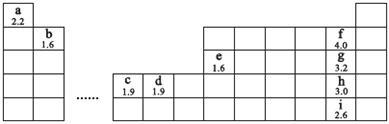
(1)b、h两元素可形成化合物bh2,写出其电子式:________ 。
(2)e、g两元素可形成两种化合物eg3、e2g6,eg3的分子构型为_______ ,eg3、e2g6中心原子e的杂化方式分别为_______ 、_______ 。
(3)d元素形成的单质可与g的氢化物浓溶液在加热条件下反应生成一种以二价d离子为内界中心原子(配位数为4)的配位化合物与一种可燃性气体,写出反应的化学方程式:_______________ 。
(4)f、g、h、i四种元素对应单质分子的键能如下表:
试从原子半径角度阐述f—f键键能反常的原因:______________ 。
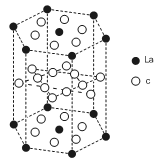
(5)c元素的元素符号是_______ ,价电子排布式为_______ ,下图是
一种受到较多关注的c元素单质与金属镧(La)形成的储氢材料的结构示意图,请在图中勾画出该晶体的一个晶胞。计算出该合金的化学式为:___________________________ 。

(1)b、h两元素可形成化合物bh2,写出其电子式:
(2)e、g两元素可形成两种化合物eg3、e2g6,eg3的分子构型为
(3)d元素形成的单质可与g的氢化物浓溶液在加热条件下反应生成一种以二价d离子为内界中心原子(配位数为4)的配位化合物与一种可燃性气体,写出反应的化学方程式:
(4)f、g、h、i四种元素对应单质分子的键能如下表:
| 共价键 | f—f | g—g | h—h | i—i |
| 键能(kJ/mol) | 157 | 242.7 | 193.7 | 152.7 |
(5)c元素的元素符号是
一种受到较多关注的c元素单质与金属镧(La)形成的储氢材料的结构示意图,请在图中勾画出该晶体的一个晶胞。计算出该合金的化学式为:

您最近一年使用:0次
9 . 软锰矿的主要成分为MnO2,工业可用其按如下方法制备高锰酸钾:

a.将软锰矿初选后粉碎,与固体苛性钾混合,加入反应釜中敞口加热至熔融,并保持熔融状态下搅拌25~30 min,冷却得墨绿色熔渣(主要成分为K2MnO4);
b.将熔渣粉碎,加入去离子水溶解,充分搅拌后过滤得墨绿色滤液1;
c.取适量70%硫酸,加入滤液1中,边加边搅拌,直至不再产生棕褐色沉淀,过滤,得紫色滤液2;
d.提纯滤液2即可得高锰酸钾粗品。
根据上述内容回答下列问题:
(1)步骤a中,反应物熔融状态下搅拌的目的是:__________ ,用化学方程式表示出MnO2转化为K2MnO4的反应原理:___________________________________________________ 。
(2)粉碎后的软锰矿与苛性钾置于_____ 中进行加热。
A.陶瓷反应釜 B.石英反应釜 C.铁制反应釜
(3)写出步骤c中反应的离子方程式:__________________________________________ 。
(4)步骤d中由滤液2得到高锰酸钾粗品的主要操作步骤是:______________________ 。
(5)若将母液循环使用,可能造成的问题是:____________________________________ 。
(6)早先有文献报道:步骤a中加入KClO3固体会缩短流程时间以及提高高锰酸钾的产率,但从绿色化学角度考虑后,现在工厂中一般不采用此法,你认为这种方法不符合绿色化学的原因是:______ 。

a.将软锰矿初选后粉碎,与固体苛性钾混合,加入反应釜中敞口加热至熔融,并保持熔融状态下搅拌25~30 min,冷却得墨绿色熔渣(主要成分为K2MnO4);
b.将熔渣粉碎,加入去离子水溶解,充分搅拌后过滤得墨绿色滤液1;
c.取适量70%硫酸,加入滤液1中,边加边搅拌,直至不再产生棕褐色沉淀,过滤,得紫色滤液2;
d.提纯滤液2即可得高锰酸钾粗品。
根据上述内容回答下列问题:
(1)步骤a中,反应物熔融状态下搅拌的目的是:
(2)粉碎后的软锰矿与苛性钾置于
A.陶瓷反应釜 B.石英反应釜 C.铁制反应釜
(3)写出步骤c中反应的离子方程式:
(4)步骤d中由滤液2得到高锰酸钾粗品的主要操作步骤是:
(5)若将母液循环使用,可能造成的问题是:
(6)早先有文献报道:步骤a中加入KClO3固体会缩短流程时间以及提高高锰酸钾的产率,但从绿色化学角度考虑后,现在工厂中一般不采用此法,你认为这种方法不符合绿色化学的原因是:
您最近一年使用:0次
10 . 氯化硫酰(SO2Cl2)是一种无色液体,遇水剧烈水解,其熔点为-54.1 ℃,沸点为69.1 ℃,可用作氯化剂及锂电池正极活性物质。氯化硫酰可用下列反应制取:
SO2(g)+Cl2(g) SO2Cl2(l) △H=-97.3 kJ/mol。
SO2Cl2(l) △H=-97.3 kJ/mol。
(1)为了提高上述反应中Cl2的平衡转化率,下列措施合理的是(用字母编号填写):_____ 。
a.缩小容器体积 b.使用催化剂 c.提高SO2浓度 d.提高温度
(2)300 ℃时,在体积为1 L的密闭容器中充入16.20 g SO2Cl2,达到平衡时容器中含SO2 7.616 g,则300 ℃时合成SO2Cl2反应的平衡常数的为:______________________ 。
(3)某同学设计了下图所示装置制取氯化硫酰:
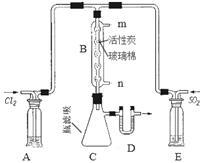
①有关该装置的说法正确的是(用字母编号填写):_______ 。
a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和NaHSO3溶液
b.B处反应管内五球中玻璃棉上的活性炭起催化作用
c.B处反应管的冷却水应从m接口通入
d.装置C处吸滤瓶应放在冰水中冷却
e.D处U形管中盛放的可能是碱石灰
②从化学平衡的角度分析,反应管通冷却水的目的是:____________________________ 。
③氯磺酸(ClSO3H)受热分解也可制得氯化硫酰,并得到另外一种物质,该反应的化学方程式为______ ,分离产物的方法是:____________________________________________________ 。
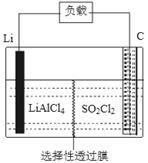
(4)下图为GET公司开发的Li-SO2Cl2军用电池的示意图。已知该电池的总反应为:2Li+SO2Cl2=2LiCl+SO2↑,则该电池工作时的正极反应为:_______________________ 。
SO2(g)+Cl2(g)
 SO2Cl2(l) △H=-97.3 kJ/mol。
SO2Cl2(l) △H=-97.3 kJ/mol。(1)为了提高上述反应中Cl2的平衡转化率,下列措施合理的是(用字母编号填写):
a.缩小容器体积 b.使用催化剂 c.提高SO2浓度 d.提高温度
(2)300 ℃时,在体积为1 L的密闭容器中充入16.20 g SO2Cl2,达到平衡时容器中含SO2 7.616 g,则300 ℃时合成SO2Cl2反应的平衡常数的为:
(3)某同学设计了下图所示装置制取氯化硫酰:

①有关该装置的说法正确的是(用字母编号填写):
a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和NaHSO3溶液
b.B处反应管内五球中玻璃棉上的活性炭起催化作用
c.B处反应管的冷却水应从m接口通入
d.装置C处吸滤瓶应放在冰水中冷却
e.D处U形管中盛放的可能是碱石灰
②从化学平衡的角度分析,反应管通冷却水的目的是:
③氯磺酸(ClSO3H)受热分解也可制得氯化硫酰,并得到另外一种物质,该反应的化学方程式为
(4)下图为GET公司开发的Li-SO2Cl2军用电池的示意图。已知该电池的总反应为:2Li+SO2Cl2=2LiCl+SO2↑,则该电池工作时的正极反应为:

您最近一年使用:0次



