解题方法
1 . Ⅰ.现有几组物质的熔点(℃)数据:
据此回答下列问题:
(1)由表格可知,A组物质熔点普遍偏高,据此回答:A组属于_______ 晶体,硅晶体的熔点低于二氧化硅,是由于_______ 。
(2)B组晶体共同的物理性质是具有良好的延展性和导电性,可用_______ (填序号)理论解释。
①价层电子对互斥理论 ②电子气理论 ③电子云理论
(3)C组中 相对分子质量小于
相对分子质量小于 但熔点却高于
但熔点却高于 ,是由于
,是由于_______ 。
(4)D组晶体中 、
、 、
、 、
、 的熔点由高到低的顺序为
的熔点由高到低的顺序为_______ 。
Ⅱ.下图表示一些常见晶体的微观结构:
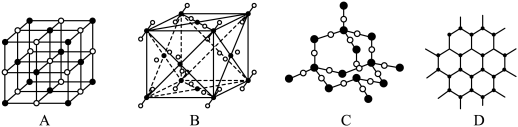
(5)其中代表 的是
的是_______ (填字母),在干冰晶体中,每个CO2分子周围紧邻的 分子有
分子有_______ 个。
(6) 晶体在
晶体在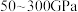 的高压下和
的高压下和 反应生成如图所示的晶胞结构,则该晶体的化学式为
反应生成如图所示的晶胞结构,则该晶体的化学式为_______ 。
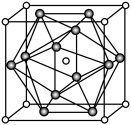
(7) 的晶胞如图所示,密度为
的晶胞如图所示,密度为 ,相邻的两个
,相邻的两个 的最近核间距为
的最近核间距为 ,则
,则 的摩尔质量为
的摩尔质量为_______  (列出代数式,设
(列出代数式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。

| A组 | B组 | C组 | D组 |
| 金刚石:3550 | 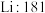 |  |  |
| 硅晶体:1410 | 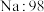 | 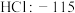 |  |
| 硼晶体:2300 |  | 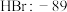 | 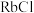 |
| 二氧化硅:1732 | 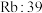 | 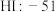 |  |
据此回答下列问题:
(1)由表格可知,A组物质熔点普遍偏高,据此回答:A组属于
(2)B组晶体共同的物理性质是具有良好的延展性和导电性,可用
①价层电子对互斥理论 ②电子气理论 ③电子云理论
(3)C组中
 相对分子质量小于
相对分子质量小于 但熔点却高于
但熔点却高于 ,是由于
,是由于(4)D组晶体中
 、
、 、
、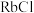 、
、 的熔点由高到低的顺序为
的熔点由高到低的顺序为Ⅱ.下图表示一些常见晶体的微观结构:

(5)其中代表
 的是
的是 分子有
分子有(6)
 晶体在
晶体在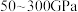 的高压下和
的高压下和 反应生成如图所示的晶胞结构,则该晶体的化学式为
反应生成如图所示的晶胞结构,则该晶体的化学式为
(7)
 的晶胞如图所示,密度为
的晶胞如图所示,密度为 ,相邻的两个
,相邻的两个 的最近核间距为
的最近核间距为 ,则
,则 的摩尔质量为
的摩尔质量为 (列出代数式,设
(列出代数式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
名校
解题方法
2 . 研究氮氧化物等大气污染物对打造宜居环境具有重要意义。NO在空气中存在如下反应:2NO(g)+O2(g) 2NO2(g),其反应历程分两步:
2NO2(g),其反应历程分两步:
①2NO(g) N2O2(g)(快反应) v1正=k1正·c2(NO), v1逆=k1逆·c(N2O2) ΔH1<0
N2O2(g)(快反应) v1正=k1正·c2(NO), v1逆=k1逆·c(N2O2) ΔH1<0
②N2O2(g)+O2(g) 2NO2(g)(慢反应) v2正=k2正·c(N2O2)·c(O2), v2逆=k2逆·c2(NO2) ΔH2<0
2NO2(g)(慢反应) v2正=k2正·c(N2O2)·c(O2), v2逆=k2逆·c2(NO2) ΔH2<0
反应历程的能量变化如图:
请回答下列问题:
(1)反应2NO(g)+O2(g) 2NO2(g)的ΔH
2NO2(g)的ΔH__ 0(填“>”、“<”或“=”)。
(2)决定2NO(g)+O2(g) 2NO2(g)反应速率是反应②,E4+E2
2NO2(g)反应速率是反应②,E4+E2__ E5+E3(填“>”、“<”或“=”)。
(3)一定温度下,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=___ 。
(4)T1℃下一密闭容器中充入一定量的NO2,测得NO2浓度随时间变化的曲线如图所示。前5秒内O2的平均生成速率为___ ;T1℃下反应2NO(g)+O2(g) 2NO2(g)的化学平衡常数K=
2NO2(g)的化学平衡常数K=__ 。
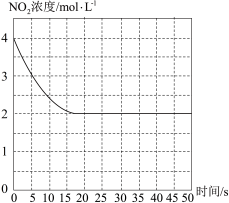
(5)对于(4)中的反应体系达平衡后,若降低温度,再次达平衡后,混合气体的平均相对分子质量___ (填“增大”、“减小”或“不变”);对于(4)中的反应体系达平衡后,若在恒温恒容条件下,追加NO2,再次达平衡后,NO2的体积分数___ (填“增大”、“减小”或“不变”)。
(6)对于(4)中的反应体系达平衡后(压强为P1),若在恒温恒容条件下,向其中充入一定量O2,再次达平衡后,测得压强为P2,P1︰P2 = 5︰8,则再次平衡时NO2的浓度为___ mol·L-1。(精确到小数点后两位)
 2NO2(g),其反应历程分两步:
2NO2(g),其反应历程分两步:①2NO(g)
 N2O2(g)(快反应) v1正=k1正·c2(NO), v1逆=k1逆·c(N2O2) ΔH1<0
N2O2(g)(快反应) v1正=k1正·c2(NO), v1逆=k1逆·c(N2O2) ΔH1<0②N2O2(g)+O2(g)
 2NO2(g)(慢反应) v2正=k2正·c(N2O2)·c(O2), v2逆=k2逆·c2(NO2) ΔH2<0
2NO2(g)(慢反应) v2正=k2正·c(N2O2)·c(O2), v2逆=k2逆·c2(NO2) ΔH2<0反应历程的能量变化如图:

请回答下列问题:
(1)反应2NO(g)+O2(g)
 2NO2(g)的ΔH
2NO2(g)的ΔH(2)决定2NO(g)+O2(g)
 2NO2(g)反应速率是反应②,E4+E2
2NO2(g)反应速率是反应②,E4+E2(3)一定温度下,反应2NO(g)+O2(g)
 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=(4)T1℃下一密闭容器中充入一定量的NO2,测得NO2浓度随时间变化的曲线如图所示。前5秒内O2的平均生成速率为
 2NO2(g)的化学平衡常数K=
2NO2(g)的化学平衡常数K=
(5)对于(4)中的反应体系达平衡后,若降低温度,再次达平衡后,混合气体的平均相对分子质量
(6)对于(4)中的反应体系达平衡后(压强为P1),若在恒温恒容条件下,向其中充入一定量O2,再次达平衡后,测得压强为P2,P1︰P2 = 5︰8,则再次平衡时NO2的浓度为
您最近一年使用:0次
2019-12-19更新
|
685次组卷
|
2卷引用:辽宁省 丹东市第二中学、大石桥第三高级中学2023-2024学年高二上学期期末化学模拟试卷
3 . 含有a mol FeI2的溶液中,通入x mol Cl2。下列各项为通入Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
| A.x≤a,2I−+Cl2=I2+2Cl− |
| B.x=1.2a,10Fe2++14I−+12Cl2=10Fe3++7I2+24Cl− |
| C.x=1.4a,4Fe2++10I−+7Cl2=4Fe3++5I2+14Cl− |
| D.x≥1.5a,2Fe2++4I−+3Cl2=2Fe3++2I2+6Cl− |
您最近一年使用:0次
2019-07-07更新
|
1335次组卷
|
3卷引用:辽宁省凤城市第一中学2018-2019学年高二6月月考化学试题
10-11高三·辽宁丹东·期末
4 . 能源短缺是人类面临的重大问题。甲醇是一种可再生能源。具有广泛的开发和应用前景。因此甲醇被称为21世纪的新型燃料。
(1)已知在常温常压下:
①2CH3OH(I)十3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6 kJ·mol-1
②H2O(I) =H2O(g) △H="+" 44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式______ 。
(2)工业上一般采用下列两种反应合成甲醇:
反应A:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1
反应B:CO(g)+2H2(g)⇌CH3OH(g) △H2
取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如下图所示,则上述CO2转化为甲醇的反应的△H1______ 0(填“>”、“<”或“=”)。
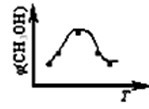
②对于反应A,若容器容积不变,下列措施可增加甲醇产率的是______ 。
A.升高温度 B.增加CO2的量
C.充入He,使体系总压强增大 D.按原比例再充入CO2和H2
③某温度下,将4mol CO和12mol H2,充人2L的密闭容器中,充分反应,达到平衡后,测得c(CO) =0.5 mol·L-1,,则该温度下该反应的平衡常数为______ 。
④。某种甲醇—空气燃料电池是采用铂作为电极,稀硫酸作电解质溶液。其工作时负极的电极反应式可表示为______
(3)对燃煤烟气中的SO2、NO2设物质的量之比为1∶1,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。,则该反应的化学方程式为______ 。
(4)在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na+)+c(H+)______ c(NO )+c(OH-)(填写“>”“=”或“<”)
)+c(OH-)(填写“>”“=”或“<”)
(1)已知在常温常压下:
①2CH3OH(I)十3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6 kJ·mol-1
②H2O(I) =H2O(g) △H="+" 44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式
(2)工业上一般采用下列两种反应合成甲醇:
反应A:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1
反应B:CO(g)+2H2(g)⇌CH3OH(g) △H2
取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如下图所示,则上述CO2转化为甲醇的反应的△H1

②对于反应A,若容器容积不变,下列措施可增加甲醇产率的是
A.升高温度 B.增加CO2的量
C.充入He,使体系总压强增大 D.按原比例再充入CO2和H2
③某温度下,将4mol CO和12mol H2,充人2L的密闭容器中,充分反应,达到平衡后,测得c(CO) =0.5 mol·L-1,,则该温度下该反应的平衡常数为
④。某种甲醇—空气燃料电池是采用铂作为电极,稀硫酸作电解质溶液。其工作时负极的电极反应式可表示为
(3)对燃煤烟气中的SO2、NO2设物质的量之比为1∶1,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。,则该反应的化学方程式为
(4)在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na+)+c(H+)
 )+c(OH-)(填写“>”“=”或“<”)
)+c(OH-)(填写“>”“=”或“<”)
您最近一年使用:0次
解题方法
5 . 【化学—选修5:有机化学基础】M和K为工业生产中常用的两种高聚物,其合成路线如下:
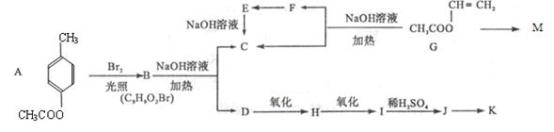
其中J物质与氯化铁溶液能发生显色反应,且苯环上的一元取代物有两种。
已知:①当羟基与双键碳原子相连时,易发生如下转化RCH =CHOH→RCH2CHO
②—ONa连在烃基上不会被氧化
请回答下列问题:
(1)写出M的结构简式__________ 。B中具有的官能团的名称___________ 。
(2)上述变化中G→C+F 的反应类型是______________ ;J在一定条件下能生成高聚物K,K的结构简式是______________________ 。
(3)写出B→C+D反应的化学方程式:______________________________________ 。
(4)同时符合下列要求的A的同分异构体有_____________ 种。
I含有苯环
II能发生银镜反应和水解反应
并写出满足下列条件的同分异构体结构简式:_____________ 。
①核磁共振氢谱有5个吸收峰
②1mol该同分异构体能与1mol NaOH 反应
(5)下列有关说法不正确的是______________ 。
a.1 mol A 完全燃烧消耗标准状况下246.4L O2
b.1 mol J与足量的碳酸氢钠溶液反应,消耗1mol碳酸氢钠
c.D→I 的试剂通常可用酸性KMnO4溶液
d.J能发生加成、消去、取代、氧化等反应

其中J物质与氯化铁溶液能发生显色反应,且苯环上的一元取代物有两种。
已知:①当羟基与双键碳原子相连时,易发生如下转化RCH =CHOH→RCH2CHO
②—ONa连在烃基上不会被氧化
请回答下列问题:
(1)写出M的结构简式
(2)上述变化中G→C+F 的反应类型是
(3)写出B→C+D反应的化学方程式:
(4)同时符合下列要求的A的同分异构体有
I含有苯环
II能发生银镜反应和水解反应
并写出满足下列条件的同分异构体结构简式:
①核磁共振氢谱有5个吸收峰
②1mol该同分异构体能与1mol NaOH 反应
(5)下列有关说法不正确的是
a.1 mol A 完全燃烧消耗标准状况下246.4L O2
b.1 mol J与足量的碳酸氢钠溶液反应,消耗1mol碳酸氢钠
c.D→I 的试剂通常可用酸性KMnO4溶液
d.J能发生加成、消去、取代、氧化等反应
您最近一年使用:0次
6 . 某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程脱除燃煤尾气中的SO2,同时制得电池材料MnO2(反应条件已省略)。

请回答下列问题:
(1)上述流程中多次涉及到过滤操作,实验室进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、_________ 、________ ;其中玻璃棒的作用是__________________________ 。
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原理是__________________________ 。
(3)已知Ksp(CuS)=8.4×10-45,Ksp(NiS)=1.4×10-24;在除铜镍的过程中,当Ni2+恰好完全沉淀 (此时溶液中c(Ni2+)=1.0×10-5mol/L),溶液中Cu2+的浓度是________ mol/L。
(4)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中惰性电极作阳极,铁作阴极,请写出阳极的电极反应式____________________________________________ 。
(5)下列各组试剂中,能准确测定一定体积燃煤尾气中SO2含量的是_________ 。(填编号)
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液 d.氨水、酚酞试液
(6)除杂后得到的MnSO4溶液可以通过____ 制得硫酸锰晶体。(MnSO4•H2O,相对分子质量为169)
a.过滤
b.蒸发浓缩
c.冷却结晶
d.灼烧
e.干燥
(7)已知废气中SO2浓度为8.4 g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000 m3燃煤尾气,可得到硫酸锰晶体质量为__________ kg(结果保留3位有效数字)。

请回答下列问题:
(1)上述流程中多次涉及到过滤操作,实验室进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原理是
(3)已知Ksp(CuS)=8.4×10-45,Ksp(NiS)=1.4×10-24;在除铜镍的过程中,当Ni2+恰好完全沉淀 (此时溶液中c(Ni2+)=1.0×10-5mol/L),溶液中Cu2+的浓度是
(4)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中惰性电极作阳极,铁作阴极,请写出阳极的电极反应式
(5)下列各组试剂中,能准确测定一定体积燃煤尾气中SO2含量的是
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液 d.氨水、酚酞试液
(6)除杂后得到的MnSO4溶液可以通过
a.过滤
b.蒸发浓缩
c.冷却结晶
d.灼烧
e.干燥
(7)已知废气中SO2浓度为8.4 g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000 m3燃煤尾气,可得到硫酸锰晶体质量为
您最近一年使用:0次
名校
7 . 有机物A的分子式为C6H12O3,一定条件下,A与碳酸氢钠、钠均能产生气体,且生成的气体体积比(同温同压)为1:1,则A的结构最多有
| A.33种 | B.31种 | C.28种 | D.19种 |
您最近一年使用:0次
2016-12-09更新
|
2337次组卷
|
10卷引用:2015届辽宁省丹东市高三总复习质量测试(一)理综化学试卷
2015届辽宁省丹东市高三总复习质量测试(一)理综化学试卷2017届湖南省石门一中高三上8月单元测化学试卷(已下线)解密15 乙醇、乙酸及基本营养物质——备战2018年高考化学之高频考点解密【全国百强校】黑龙江省哈尔滨师范大学附属中学2018-2019学年高二下学期4月月考化学试题四川省成都实验高级中学2020届高三上学期入学考试化学试题安徽省合肥市第六中学2019-2020学年高一下学期开学考试化学试题湖北省荆州开发区滩桥高级中学2019-2020学年度高二下学期期中考试化学试题辽宁省实验中学2019-2020学年高二下学期期中考试化学试题辽宁省沈阳市实验中学2019-2020高二下学期期中考试(永志班)化学试题黑龙江省大庆市肇州县肇州中学2019-2020学年高二下学期第二次月考化学试题
12-13高三·湖北襄阳·阶段练习
8 . 近年,为提高能利用率,西方提出共生理念-为提高经济效益,人类生产活动尽可能多功能化.共生工程将会大大促进化学工业的发展。
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V.实际过程中,将SO2通入电池的_______ 极(填“正”或“负”),负极反应式为_______ .用这种方法处理SO2废气的优点是_______ 。
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质.合成路线如图:
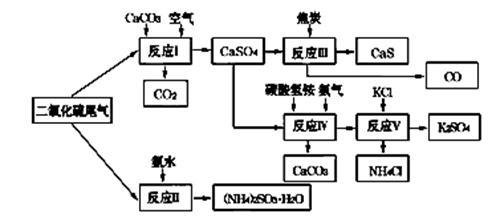
①生产中,向反应Ⅱ中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是_______ 。
②下列有关说法正确的是_______ (填序号)。
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅲ中发生反应的化学方程式为CaSO4+4C CaS+4CO↑
CaS+4CO↑
C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥
③反应Ⅴ中选用了40%的乙二醇溶液做溶剂,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液做溶剂的原因是_______ 。
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的化学方程式_______ .
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V.实际过程中,将SO2通入电池的
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质.合成路线如图:

①生产中,向反应Ⅱ中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是
②下列有关说法正确的是
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅲ中发生反应的化学方程式为CaSO4+4C
 CaS+4CO↑
CaS+4CO↑C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥
③反应Ⅴ中选用了40%的乙二醇溶液做溶剂,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液做溶剂的原因是
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的化学方程式
您最近一年使用:0次
2016-12-08更新
|
515次组卷
|
6卷引用:2015届辽宁省丹东五校协作体高三上学期期末考试理综化学试卷
2015届辽宁省丹东五校协作体高三上学期期末考试理综化学试卷(已下线)2013届湖北省襄阳市高三元月第一次调研考试理综化学试卷(已下线)2014届江西省重点中学协作体高三第一次联考理综化学试卷2015届湖北省部分高中高三元月调考理综化学试卷2015届湖北大冶一中等六校高三元月调考理综化学试卷2015届江西省南昌三中高三上学期第六次考试理综化学试卷
12-13高二上·辽宁丹东·期末
9 . 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
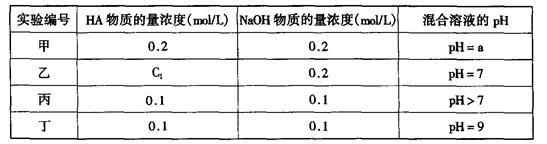
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱 酸______ 。
(2)不考虑其它组的实验结果,单从乙组情况分析,C1是否一定等于0.2mol/L______ (选填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是______
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是______ 酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是______
(4)丁组实验所得混合溶液中由水电离出的c(OH—)=______ mol/L。写出该混合溶液中下列算式的精确结果(不能做近似计算,回答准确值,结果不一定要化简)。 c(Na+)-c(A-)=______ mol/L

请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱 酸
(2)不考虑其它组的实验结果,单从乙组情况分析,C1是否一定等于0.2mol/L
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是
(4)丁组实验所得混合溶液中由水电离出的c(OH—)=
您最近一年使用:0次



