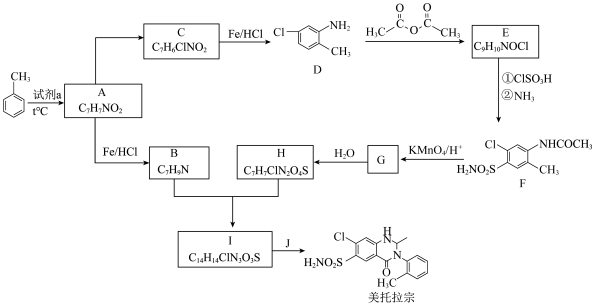
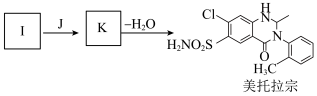
1 . 某研究小组以甲苯为起始原料,按下列路线合成利尿药美托拉宗。
(1)试剂a是_______ 。
(2)C→D的反应类型是_______ 。
(3)E分子中的官能团有_______ 。
(4)属于芳香族化合物的B的同分异构体有_______ 个(提示:不包括B)。
(5)写出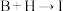 的化学方程式
的化学方程式_______ 。
(6)从D→H的流程看,D→E的主要目的是_______ 。
(7)有人认为由I合成美托拉宗的过程如下:_______ ,K的结构简式_______ 。
已知:ⅰ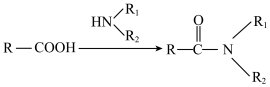 。
。
ⅱ.
(1)试剂a是
(2)C→D的反应类型是
(3)E分子中的官能团有
(4)属于芳香族化合物的B的同分异构体有
(5)写出
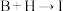 的化学方程式
的化学方程式(6)从D→H的流程看,D→E的主要目的是
(7)有人认为由I合成美托拉宗的过程如下:
您最近一年使用:0次
2 . 常温下,FeS和ZnS的饱和溶液中,金属阳离子( )与
)与 的物质的量浓度的负对数关系如图所示。下列说法正确的是
的物质的量浓度的负对数关系如图所示。下列说法正确的是

 )与
)与 的物质的量浓度的负对数关系如图所示。下列说法正确的是
的物质的量浓度的负对数关系如图所示。下列说法正确的是
A.取一定量主要含 、 、 的浓缩液,向其中滴加 的浓缩液,向其中滴加 溶液,当ZnS开始沉淀时,溶液中的 溶液,当ZnS开始沉淀时,溶液中的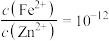 |
B.上述FeS饱和溶液中,只含有 和 和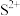 ,不含其他离子 ,不含其他离子 |
C.常温下,将足量ZnS分别加入体积均为100mL的  溶液和 溶液和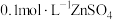 溶液中,充分搅拌后, 溶液中,充分搅拌后, 溶液中 溶液中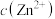 较 较 溶液中 溶液中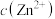 大 大 |
D.常温下,向ZnS饱和溶液中加入稀硝酸,发生的反应为 |
您最近一年使用:0次
2023-11-12更新
|
804次组卷
|
2卷引用:辽宁省葫芦岛市协作校2023-2024学年高三上学期第二次考试化学试题
11-12高一·江西·阶段练习
名校
解题方法
3 .  、
、 和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中
和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中 、
、 和CO的体积比为
和CO的体积比为
 、
、 和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中
和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中 、
、 和CO的体积比为
和CO的体积比为| A.22∶1∶14 | B.29∶8∶13 | C.26∶8∶57 | D.13∶8∶29 |
您最近一年使用:0次
2022-01-03更新
|
2580次组卷
|
34卷引用:辽宁省葫芦岛市第一中学2017-2018学年高一上学期第一次月考化学试题
辽宁省葫芦岛市第一中学2017-2018学年高一上学期第一次月考化学试题辽宁省葫芦岛市第一高级中学2017-2018学年高一上学期第一次月考化学试题(已下线)2012-2013学年江西省四校高一零班第一次月考化学试卷(已下线)2013-2014黑龙江省哈六中高二下学期期末考试化学试卷(已下线)2014-2015学年河南省方城县第一高级中学高一10月月考化学试卷2015-2016学年浙江省余姚中学高一上10月月考化学试卷2015-2016学年辽宁省辽阳一中高一上学期9月教学质检化学试卷2015-2016学年内蒙古集宁一中高一上第一次月考化学试卷2016-2017学年河北省廊坊一中高一上学期第一次月考化学试卷2016-2017学年河北省定州中学高二(承智班)下学期开学考试化学试卷江西省九江市2017-2018学年高一上学期第一次阶段联考化学试题四川省乐山沫若中学2017-2018学年高一上学期第一次月考化学试题(已下线)2019高考备考一轮复习精品资料 第一章 从实验学化学 第3讲 化学计算中常用的几种方法【教学案】湖南省衡阳县第四中学2019届高三第一次月考(9月)化学试题【全国百强校】四川省成都市双流区棠湖中学2018-2019学年高一上学期第一次月考化学试题【校级联考】湖北省重点高中协作体2018-2019学年高一上学期期中联考化学试题吉林省白城市通榆县第一中学2019-2020学年高一上学期第一次月考化学试题河南省鲁山县第一高级中学2019-2020学年高一9月月考化学试卷试题江西省宜春九中(外国语学校)2019-2020学年高一上学期第一次月考化学试题宁夏回族自治区吴忠市吴忠中学2019-2020学年高一上学期期中考试化学试题黑龙江省大兴安岭漠河县第一中学2019-2020学年高一上学期第一次阶段考试化学试题吉林省长春市东北师大附中净月校区2019-2020学年高一12月月考化学试题湖南省株洲市攸县三中2019-2020学年高一上学期第一次月考化学试题夯基提能2020届高三化学选择题对题专练——化学计算中的常见方法和应用(提升练)(已下线)【南昌新东方】江西省九江市2017-2018学年高一上学期第一次阶段联考化学试题山西省运城市稷山中学2022届高三上学期月考(一)化学试题贵州省毕节市威宁第四中学2022届高三第一次月考化学试题黑龙江省漠河市高级中学2021-2022学年高一上学期第一次月考化学试题福建省厦门外国语学校石狮分校2021-2022学年高一上学期第一次月考化学试题福建省师范大学附属中学2021–2022学年高一上学期期中考试化学试题上海市进才中学2022-2023学年高一上学期期中考试化学试题上海师范大学附属中学2022-2023学年高一上学期期中考试化学试题四川省成都市树德中学2022-2023学年高一上学期期末复习化学试题河北省秦皇岛市昌黎第一中学2023届高三第一次调研考试化学试题
解题方法
4 . 青蒿素是烃的含氧衍生物,为无色针状晶体,在乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素60℃以上易分解,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的。
(1)青蒿素在超临界CO2中有很强的溶解性,萃取青蒿素________ (填”能”或“不能”)用超临界CO2作萃取剂;中医古籍《肘后备急方》中“青蒿一握,以水二升渍,绞取汁,尽服之”______ (填“是”或“不是”)为了提取纤维素。现有四氯化碳(沸点76.5℃)和乙醚两种溶剂,应选用__________ 作为萃取剂;青蒿素组成元素中电负性较大的两种元素第一电离能由大到小排序为__________ (填元素符号)。
(2)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与_________ (填字母)具有相似的性质。说明青蒿素的结构中含有_______ (填官能团名称)。
A.乙醇B.乙酸乙酯C.乙酸D.酰胺E.葡萄糖
(3)青蒿素的质谱数据中有一个峰值与另一种抗疟药鹰爪素相同,而鹰爪素的该质谱峰对应过氧基团,于是推测青蒿素中含有_____ (填粒子的电子式)。青蒿素所属晶体类型为_________ 。1974年中科院上海有机所和生物物理研究所在研究青蒿素功能基团的过程中,屠呦呦团队发明了双氢青蒿素。从青蒿素到生成双氢青蒿素发生了_____ 反应。
(4)科学家对H2O2分子结构的认识经历了较为漫长的过程,最初科学家提出了两种观点:甲: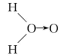 、乙: H—O—O—H,甲式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的分子结构,设计并完成了下列实验:
、乙: H—O—O—H,甲式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的分子结构,设计并完成了下列实验:
a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;
b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;
c.将生成的A与H2反应(已知该反应中H2作还原剂)。
①如果H2O2的结构如甲所示,实验c中化学反应方程式为(A写结构简式)________ 。
②为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:_______________________ 。
(1)青蒿素在超临界CO2中有很强的溶解性,萃取青蒿素
(2)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与
A.乙醇B.乙酸乙酯C.乙酸D.酰胺E.葡萄糖
(3)青蒿素的质谱数据中有一个峰值与另一种抗疟药鹰爪素相同,而鹰爪素的该质谱峰对应过氧基团,于是推测青蒿素中含有
(4)科学家对H2O2分子结构的认识经历了较为漫长的过程,最初科学家提出了两种观点:甲:
 、乙: H—O—O—H,甲式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的分子结构,设计并完成了下列实验:
、乙: H—O—O—H,甲式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的分子结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;
b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;
c.将生成的A与H2反应(已知该反应中H2作还原剂)。
①如果H2O2的结构如甲所示,实验c中化学反应方程式为(A写结构简式)
②为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:
您最近一年使用:0次
名校
解题方法
5 . 肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体。
(1)肉桂酸甲酯由C、H、O三种元素组成,质谱分析其分子的相对分子质量为162,核磁共振氢谱谱图显示有6个峰,其面积之比为1︰2︰2︰1︰1︰3 ,利用红外光谱仪检测其中的某些基团,测得红外光谱如下图:

则肉桂酸甲酯的结构简式是_____________ (不考虑立体异构)。
(2)已知:I.醛与醛能发生反应,原理如下:

II.已知烃A在标准状况下的密度为1.25g·L-1。合成肉桂酸甲酯的工业流程如下图所示:

请回答:
①化合物J的结构简式为_______________ ;
②化合物G中的官能团有______________ ;
③G→H为_______________ 反应(填反应类型);
④写出反应D→E的化学方程式______________________ ;
⑤符合下列条件的I的同分异构体共有5种。写出另两种同分异构体的结构简式:_____________
A.能发生水解反应 B.与银氨溶液作用出现光亮的银镜C.能与溴发生加成反应

(1)肉桂酸甲酯由C、H、O三种元素组成,质谱分析其分子的相对分子质量为162,核磁共振氢谱谱图显示有6个峰,其面积之比为1︰2︰2︰1︰1︰3 ,利用红外光谱仪检测其中的某些基团,测得红外光谱如下图:

则肉桂酸甲酯的结构简式是
(2)已知:I.醛与醛能发生反应,原理如下:

II.已知烃A在标准状况下的密度为1.25g·L-1。合成肉桂酸甲酯的工业流程如下图所示:

请回答:
①化合物J的结构简式为
②化合物G中的官能团有
③G→H为
④写出反应D→E的化学方程式
⑤符合下列条件的I的同分异构体共有5种。写出另两种同分异构体的结构简式:
A.能发生水解反应 B.与银氨溶液作用出现光亮的银镜C.能与溴发生加成反应

您最近一年使用:0次
2016-12-09更新
|
564次组卷
|
2卷引用:2016-2017学年辽宁葫芦岛高级中学高二上期中化学卷
6 . 甲醇是结构最为简单的饱和一元醇,又称“木醇”或“木精”。甲醇是一碳化学基础的原料和优质的燃料,主要应用于精细化工、塑料、能源等领域。已知甲醇制备的有关化学反应如下:
反应①:CO(g)+2H2(g) CH3OH(g) △H1=-90.77kJ/mol
CH3OH(g) △H1=-90.77kJ/mol
反应②:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应③:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3=-49.58kJ/mol
CH3OH(g)+H2O(g) △H3=-49.58kJ/mol
(1)反应②的△H2=__________________
(2)若500℃时三个反应的平衡常数依次为K1、K2与K3,已知500℃时K1、K2的值分别为2.5、1.0,并测得该温度下反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时V正________ V逆(填“>”、“=”或“<”)
(3)在3L容积可变的密闭容器中发生反应②,c(CO)随反应时间t变化如图中曲线I所示。若在t0时刻分别改变一个条件,曲线I变为曲线II和曲线III。当曲线I变为曲线II时,改变的条件是_______________ 。当通过改变压强使曲线I变为曲线III时,曲线III达到平衡时容器的体积为_____________ 。


(4)甲醇燃料电池可能成为未来便携电子产品应用的主流。某种甲醇燃料电池工作原理如图所示,则通入a气体的电极电极反应式为_______________ 。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为________________ 。
反应①:CO(g)+2H2(g)
 CH3OH(g) △H1=-90.77kJ/mol
CH3OH(g) △H1=-90.77kJ/mol反应②:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2反应③:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3=-49.58kJ/mol
CH3OH(g)+H2O(g) △H3=-49.58kJ/mol(1)反应②的△H2=
(2)若500℃时三个反应的平衡常数依次为K1、K2与K3,已知500℃时K1、K2的值分别为2.5、1.0,并测得该温度下反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时V正
(3)在3L容积可变的密闭容器中发生反应②,c(CO)随反应时间t变化如图中曲线I所示。若在t0时刻分别改变一个条件,曲线I变为曲线II和曲线III。当曲线I变为曲线II时,改变的条件是


(4)甲醇燃料电池可能成为未来便携电子产品应用的主流。某种甲醇燃料电池工作原理如图所示,则通入a气体的电极电极反应式为
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为
您最近一年使用:0次
名校
7 . 阿司匹林(乙酰水杨酸, )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:



制备基本操作流程如下:

主要试剂和产品的物理常数如下表所示:
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是_____________________ 。
(2)合成阿司匹林时,最合适的加热方法是_________________________ 。
(3)提纯粗产品流程如下,加热回流装置如图:

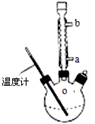
①使用温度计的目的是是控制加热的温度,防止_____________________________ 。
②冷凝水的流进方向是______________ (填“a”或“b”);
③趁热过滤的原因是_________________________________________________ 。
④下列说法正确的是__________ (填选项字母)。
a.此种提纯方法中乙酸乙酯的作用是做溶剂
b.此种提纯粗产品的方法叫重结晶
c.根据以上提纯过程可以得出阿司匹林在乙酸乙酯中的溶解度低温时大
d.可以用紫色石蕊溶液判断产品中是否含有未反应完的水杨酸
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐( ),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为
),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为 ___________ (用百分数表示,小数点后一位)。
 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:


制备基本操作流程如下:

主要试剂和产品的物理常数如下表所示:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
(1)制备阿司匹林时,要使用干燥的仪器的原因是
(2)合成阿司匹林时,最合适的加热方法是
(3)提纯粗产品流程如下,加热回流装置如图:


①使用温度计的目的是是控制加热的温度,防止
②冷凝水的流进方向是
③趁热过滤的原因是
④下列说法正确的是
a.此种提纯方法中乙酸乙酯的作用是做溶剂
b.此种提纯粗产品的方法叫重结晶
c.根据以上提纯过程可以得出阿司匹林在乙酸乙酯中的溶解度低温时大
d.可以用紫色石蕊溶液判断产品中是否含有未反应完的水杨酸
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(
 ),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为
),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为
您最近一年使用:0次
2016-12-09更新
|
299次组卷
|
4卷引用:【全国百强校】辽宁省葫芦岛市第一高级中学2017-2018学年高二下学期期中考试化学试题
8 . 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:

(1)SO2气体还原Fe3+反应的产物是_____________ 、_____________ (填离子符号)。
(2)下列实验方案可以用于在实验室制取所需SO2的是____ 。
(3)装置C的作用是_____________ 。
(4)如果有280 mL SO2气体(已折算为标态)进入C装置中,则C中50 mL NaOH溶液的浓度至少为_____________ mol/L才能达到目的。
(5)在上述装置中通入过量的SO2为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是____ ,原因是_______________________________________ 。
(6)能表明I-的还原性弱于SO2的现象是_________________________________________ ,写出有关离子方程式:_______________________________________ 。

(1)SO2气体还原Fe3+反应的产物是
(2)下列实验方案可以用于在实验室制取所需SO2的是
| A.Na2SO3溶液与HNO3 | B.Na2SO3固体与浓硫酸 |
| C.固体硫在纯氧中燃烧 | D.铜与热浓H2SO4 |
(3)装置C的作用是
(4)如果有280 mL SO2气体(已折算为标态)进入C装置中,则C中50 mL NaOH溶液的浓度至少为
(5)在上述装置中通入过量的SO2为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是
(6)能表明I-的还原性弱于SO2的现象是
您最近一年使用:0次



