1 . 汽车尾气未经处理直接排放,会严重污染环境。某反应可有效降低汽车尾气污染物的排放,一定条件下该反应经历三个基元反应,反应历程如图所示(TS表示过渡态)。下列说法错误的是
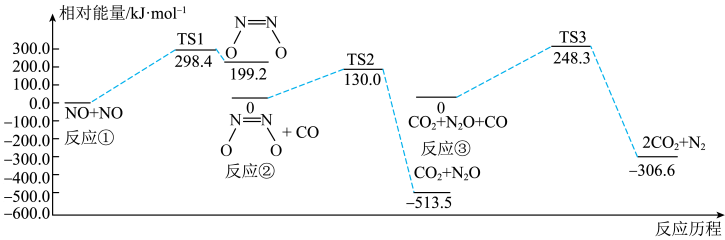
| A.反应达平衡后提高反应温度,反应物转化率减小 |
| B.使用催化剂可以降低反应的活化能,提高活化分子百分数,但不改变反应物的平衡转化率 |
| C.该化学反应的速率主要由反应③决定 |
D. |
您最近一年使用:0次
名校
解题方法
2 . 黄铜 用
用 溶液浸泡后生成单质硫,所得CuSO4溶液可用于制取纳米Cu2O,Cu2O能与酸发生反应。Co3+具有强氧化性,可与浓盐酸反应生成氯气。由
溶液浸泡后生成单质硫,所得CuSO4溶液可用于制取纳米Cu2O,Cu2O能与酸发生反应。Co3+具有强氧化性,可与浓盐酸反应生成氯气。由 、
、 、
、 和
和 反应制备的配合物
反应制备的配合物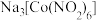 可应用于
可应用于 的鉴定。下列化学反应方程式表示错误的是
的鉴定。下列化学反应方程式表示错误的是
 用
用 溶液浸泡后生成单质硫,所得CuSO4溶液可用于制取纳米Cu2O,Cu2O能与酸发生反应。Co3+具有强氧化性,可与浓盐酸反应生成氯气。由
溶液浸泡后生成单质硫,所得CuSO4溶液可用于制取纳米Cu2O,Cu2O能与酸发生反应。Co3+具有强氧化性,可与浓盐酸反应生成氯气。由 、
、 、
、 和
和 反应制备的配合物
反应制备的配合物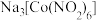 可应用于
可应用于 的鉴定。下列化学反应方程式表示错误的是
的鉴定。下列化学反应方程式表示错误的是A.Cu2O与稀硫酸反应: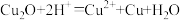 |
B. 溶液和 溶液和 反应: 反应: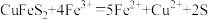 |
C. 与足量浓盐酸反应: 与足量浓盐酸反应: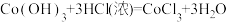 |
D.制备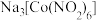 的反应: 的反应: |
您最近一年使用:0次
3 . 中华文化源远流长,化学与文化传承密不可分。下列说法错误的是
| A.蔡伦造纸采用碱液制浆,该过程不涉及化学变化 |
| B.羟基磷灰石是龟甲的成分之一,属于无机物 |
| C.制作徽墨的松烟颗粒直径约30~50nm,溶于水可产生丁达尔现象 |
| D.安徽繁昌窑所产青白瓷是以黏土为原料高温烧结而成 |
您最近一年使用:0次
名校
4 . 二氧化碳的捕集和利用是我国能源领域实现碳达峰、碳中和目标的一个重要研究方向。回答下列问题:
(1)某校科研人员利用NaOH溶液实现“碳捕获”的技术的装置如图。_______ ;
②“碳捕获”技术是减少二氧化碳排放的一种途径,基本思路是将工业排放的二氧化碳分离出来。若用氢氧化钠溶液吸收二氧化碳,反应后碳酸盐和碳酸氢盐的物质的量之比为1∶1,则反应的离子方程式为_______ ;
③下列溶液中,同样能用于“捕捉”二氧化碳的是_______ (填选项字母);
A. 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.
溶液 D. 溶液
溶液
(2) 捕获和转化可减少
捕获和转化可减少 排放并实现资源利用,原理如图所示。
排放并实现资源利用,原理如图所示。_______ ;
②若产生等物质的量CO、 ,写出反应Ⅱ的化学方程式:
,写出反应Ⅱ的化学方程式:_______ 。
(3)从空气中捕获 直接转化为甲醇是二十多年来“甲醇经济”领域的研究热点,诺贝尔化学奖获得者乔治·安德鲁教授首次以金属钉作催化剂实现了这种转化,其转化如图所示。
直接转化为甲醇是二十多年来“甲醇经济”领域的研究热点,诺贝尔化学奖获得者乔治·安德鲁教授首次以金属钉作催化剂实现了这种转化,其转化如图所示。_______ ;
②如图所示转化总反应的化学方程式是_______ 。
(1)某校科研人员利用NaOH溶液实现“碳捕获”的技术的装置如图。
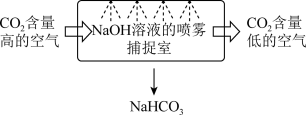
②“碳捕获”技术是减少二氧化碳排放的一种途径,基本思路是将工业排放的二氧化碳分离出来。若用氢氧化钠溶液吸收二氧化碳,反应后碳酸盐和碳酸氢盐的物质的量之比为1∶1,则反应的离子方程式为
③下列溶液中,同样能用于“捕捉”二氧化碳的是
A.
 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.
溶液 D. 溶液
溶液(2)
 捕获和转化可减少
捕获和转化可减少 排放并实现资源利用,原理如图所示。
排放并实现资源利用,原理如图所示。
②若产生等物质的量CO、
 ,写出反应Ⅱ的化学方程式:
,写出反应Ⅱ的化学方程式:(3)从空气中捕获
 直接转化为甲醇是二十多年来“甲醇经济”领域的研究热点,诺贝尔化学奖获得者乔治·安德鲁教授首次以金属钉作催化剂实现了这种转化,其转化如图所示。
直接转化为甲醇是二十多年来“甲醇经济”领域的研究热点,诺贝尔化学奖获得者乔治·安德鲁教授首次以金属钉作催化剂实现了这种转化,其转化如图所示。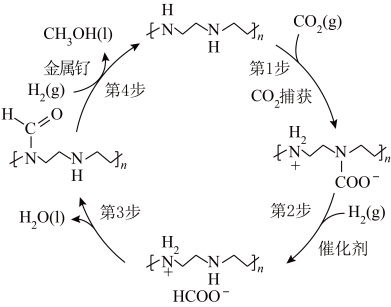
②如图所示转化总反应的化学方程式是
您最近一年使用:0次
名校
解题方法
5 . 丙烯可用于生产多种重要有机化工原料,如制备聚丙烯等。以下是用丙烯制备有机物G的合成路线,回答下列有关问题:_______ ,③的反应类型是_______ 。
(2)C中官能团的名称为_______ 。
(3)反应③除了生成D,还有可能得到另一种副产物,其结构简式为_______ 。
(4)反应⑥的化学方程式为_______ 。
(5)J比G多2个H原子,且能与NaHCO3反应放出CO2的结构有_______ 种。
(6)丙烯生成聚丙烯的化学方程式为_______ 。
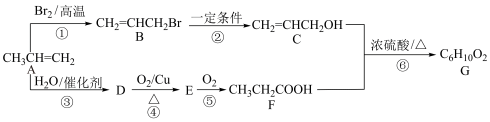
(2)C中官能团的名称为
(3)反应③除了生成D,还有可能得到另一种副产物,其结构简式为
(4)反应⑥的化学方程式为
(5)J比G多2个H原子,且能与NaHCO3反应放出CO2的结构有
(6)丙烯生成聚丙烯的化学方程式为
您最近一年使用:0次
6 . 海洋生物参与氮循环过程如图所示(其他含氮物质不参与反应)。下列说法错误的是
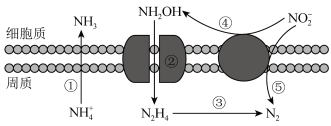
A.1 mol  与1 mol 与1 mol  所含电子数相等 所含电子数相等 |
B.反应③中,若 与 与 反应,则 反应,则 作还原剂 作还原剂 |
| C.以上六种含氮微粒,一共呈现了氮的四种价态 |
D.工业上用铵盐来处理含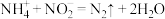 |
您最近一年使用:0次
名校
解题方法
7 . 恒温下,将16 mol  与24 mol
与24 mol  的混合气体通入一个固定容积的密闭容器中,发生如下反应:
的混合气体通入一个固定容积的密闭容器中,发生如下反应: 。回答下列问题:
。回答下列问题:
(1)合成氨反应中的能量变化如图所示,该反应中反应物化学键断裂吸收的总能量_______ (填“大于”或“小于”)生成物化学键形成放出的总能量。_______ (填选项字母)。
a. 的物质的量保持不变
的物质的量保持不变
b.三种气体的浓度相等
c.密闭容器内气体压强不再发生变化
d.反应后混合气体的密度不再发生变化
e.单位时间内消耗1 mol ,同时生成2 mol
,同时生成2 mol 
(3)①若反应进行到某时刻时,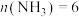 mol,此时
mol,此时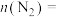
_______ mol;
②反应达到平衡时,混合气体的体积为716.8L(标准状况下), 和
和 的转化率之比
的转化率之比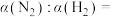
_______ ;原混合气体与平衡时混合气体的压强之比p(始)∶p(平)=_______ 。
(4)若改变下列一个条件,推测该反应的速率发生的变化。
①升温,化学反应速率_______ ;(填“加快”、“减慢”或“不变”,下同)
②恒温恒容下,充入一定量的稀有气体使容器中的压强增大,化学反应速率_______ 。
 与24 mol
与24 mol  的混合气体通入一个固定容积的密闭容器中,发生如下反应:
的混合气体通入一个固定容积的密闭容器中,发生如下反应: 。回答下列问题:
。回答下列问题:(1)合成氨反应中的能量变化如图所示,该反应中反应物化学键断裂吸收的总能量

a.
 的物质的量保持不变
的物质的量保持不变b.三种气体的浓度相等
c.密闭容器内气体压强不再发生变化
d.反应后混合气体的密度不再发生变化
e.单位时间内消耗1 mol
 ,同时生成2 mol
,同时生成2 mol 
(3)①若反应进行到某时刻时,
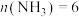 mol,此时
mol,此时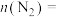
②反应达到平衡时,混合气体的体积为716.8L(标准状况下),
 和
和 的转化率之比
的转化率之比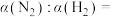
(4)若改变下列一个条件,推测该反应的速率发生的变化。
①升温,化学反应速率
②恒温恒容下,充入一定量的稀有气体使容器中的压强增大,化学反应速率
您最近一年使用:0次
名校
8 . 海洋是一座资源的宝库,下图是利用海洋资源生产卤素单质的工艺流程。
(1)实验室灼烧海带时使用的仪器有_______ 、泥三角、三脚架、酒精灯等,步骤Ⅱ的操作名称为_______ 。
(2)步骤Ⅲ中需要严格控制Cl2的用量,原因是_______ 。
(3)若步骤Ⅲ加H2O2的酸性溶液氧化I-,则其离子方程式为_______ 。
(4)步骤Ⅴ中,从海水提取的粗盐中主要含 、
、 、
、 等杂质离子,除去这些离子可加入的试剂有①盐酸②BaCl2溶液③Na2CO3溶液④NaOH溶液,加入试剂的正确顺序为
等杂质离子,除去这些离子可加入的试剂有①盐酸②BaCl2溶液③Na2CO3溶液④NaOH溶液,加入试剂的正确顺序为_______ (填标号)。
a.①②③④ b.②③④① c.③②④① d.②④③①
(5)步骤Ⅵ中,用SO2吸收Br2的离子方程式为_______ 。
(6)提取Br2的流程中,两次通入Cl2的目的是富集浓缩溴。若最终获得240gBr2,理论上需消耗标准状况下Cl2的体积为_______ 。
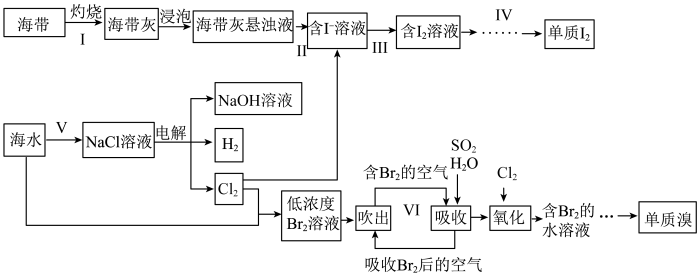

(1)实验室灼烧海带时使用的仪器有
(2)步骤Ⅲ中需要严格控制Cl2的用量,原因是
(3)若步骤Ⅲ加H2O2的酸性溶液氧化I-,则其离子方程式为
(4)步骤Ⅴ中,从海水提取的粗盐中主要含
 、
、 、
、 等杂质离子,除去这些离子可加入的试剂有①盐酸②BaCl2溶液③Na2CO3溶液④NaOH溶液,加入试剂的正确顺序为
等杂质离子,除去这些离子可加入的试剂有①盐酸②BaCl2溶液③Na2CO3溶液④NaOH溶液,加入试剂的正确顺序为a.①②③④ b.②③④① c.③②④① d.②④③①
(5)步骤Ⅵ中,用SO2吸收Br2的离子方程式为
(6)提取Br2的流程中,两次通入Cl2的目的是富集浓缩溴。若最终获得240gBr2,理论上需消耗标准状况下Cl2的体积为
您最近一年使用:0次
名校
9 . 某化学兴趣小组设计实验探究“84”消毒液(主要成分NaClO)的漂白性。
Ⅰ.在2 mL“84”消毒液中加入2 mL水,放入红色纸片,观察到纸片慢慢褪色;
Ⅱ.在2 mL“84”消毒液中加入2 mL醋酸(醋酸不具有漂白性),放入红色纸片,观察到纸片迅速褪色;
Ⅲ.在不同温度时,测得“84”消毒液ORP值随时间的变化曲线如图所示。
下列解释合理的是
Ⅰ.在2 mL“84”消毒液中加入2 mL水,放入红色纸片,观察到纸片慢慢褪色;
Ⅱ.在2 mL“84”消毒液中加入2 mL醋酸(醋酸不具有漂白性),放入红色纸片,观察到纸片迅速褪色;
Ⅲ.在不同温度时,测得“84”消毒液ORP值随时间的变化曲线如图所示。
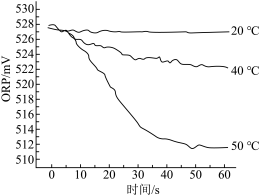
下列解释合理的是
| A.“84”消毒液能导电,属于强电解质 |
| B.可以用pH试纸测定浓次氯酸钠溶液的pH值 |
| C.实验Ⅲ中,ORP值迅速降低可能是次氯酸分解加速了 |
| D.实验Ⅱ迅速褪色是因为NaClO和醋酸发生了氧化还原反应 |
您最近一年使用:0次
名校
10 . 类比法是一种学习化学的重要方法。下列“类比”合理的是
| 选项 | 已知 | 类比 |
| A |  可由化合反应制备 可由化合反应制备 |  也可由化合反应制备 也可由化合反应制备 |
| B |  与 与 反应生成 反应生成 |  与 与 反应生成 反应生成 |
| C |  通入 通入 溶液中无沉淀生成 溶液中无沉淀生成 |  通入 通入 溶液中也无沉淀生成 溶液中也无沉淀生成 |
| D |  根据化合价规律可表示为 根据化合价规律可表示为 |  也可表示为 也可表示为 (铅和碳同族) (铅和碳同族) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



