名校
解题方法
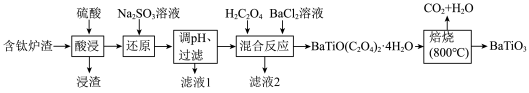
1 . BaTiO3,被用作陶瓷电容器的介电材料、麦克风和其他传感器的压电材料。以含钛炉渣(主要成分是TiO2,含少量Fe2O3、CaO、SiO2等)为原料制备BaTiO3的流程如下:
回答下列问题:
(1)下列为Ba粒子简化电子排布式,其中能量最高的是 (填字母)。
(2)“还原”中发生反应的离子方程式为________ 。若省去“还原”工艺,则________ 。
(3)设计实验检验滤液1中是否含有Fe2+:________ 。
(4)BaTiO(C2O4)2·4H2O中Ti的化合价为________ ,“焙烧”发生反应的化学方程式为________ 。
(5)经X射线分析鉴定,钛酸钡(BaTiO3)的晶胞结构如下图所示(Ti4+、Ba2+均与O2-相接触),已知晶胞边长为 pm,O2-的半径为
pm,O2-的半径为 pm,则Ti4+、Ba2+的半径分别为
pm,则Ti4+、Ba2+的半径分别为______ pm、______ pm。(用含 、
、 的代数式表示)
的代数式表示)
| 金属离子 | TiO2+ | Fe2+ | Fe3+ |
| 开始沉淀的pH | 0.5 | 6.3 | 1.5 |
| 完全沉淀的pH | 2.5 | 8.3 | 2.8 |
(1)下列为Ba粒子简化电子排布式,其中能量最高的是 (填字母)。
| A.[Xe]6s2 | B.[Xe]6s1 | C.[Xe]6s16p1 | D.[Xe]6s0p2 |
(2)“还原”中发生反应的离子方程式为
(3)设计实验检验滤液1中是否含有Fe2+:
(4)BaTiO(C2O4)2·4H2O中Ti的化合价为
(5)经X射线分析鉴定,钛酸钡(BaTiO3)的晶胞结构如下图所示(Ti4+、Ba2+均与O2-相接触),已知晶胞边长为
 pm,O2-的半径为
pm,O2-的半径为 pm,则Ti4+、Ba2+的半径分别为
pm,则Ti4+、Ba2+的半径分别为 、
、 的代数式表示)
的代数式表示)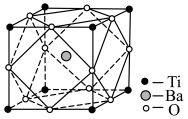
您最近一年使用:0次
名校
解题方法
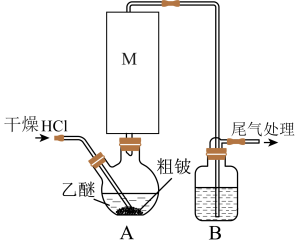
2 . 某实验小组以粗铍(含少量的Mg、Fe、Al、Cu、Si等)为原料制备、提纯BeCl2,并测定产品中BeCl2的含量。利用如图所示装置(夹持装置略)制BeCl2,实验开始前先通入一段时间的氩气。
②BeCl2溶于乙醚,不溶于苯,易发生水解;
③AlCl3溶于乙醚且溶于苯,FeCl2、MgCl2不溶于乙醚和苯;
④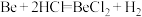 为放热反应。
为放热反应。
请回答下列问题:
(1)装置A中方框内的仪器M应为________ (填“直形冷凝管”或“球形冷凝管”),实验中装置A需置于温度15℃左右的水浴中,其主要目的是________ 。
(2)装置B中盛放的试剂为________ 。
(3)反应后,装置A中BeCl2的乙醚溶液先经过滤除去杂质________ ,再蒸馏滤液将乙醚蒸出得“固体”。为了除去“固体”中的其余杂质,可采取的操作为________ 。
(4)取 g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用
g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用 mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸
mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸 mL(已知:
mL(已知: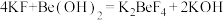 ;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为
;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为________ %(用含 、
、 和
和 的字母表示)。
的字母表示)。
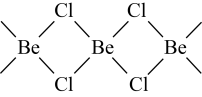
(5)氯化铍在气态时存在BeCl2分子(a)和二聚分子[(BeCl2)2](b),固态时则具有如下图所示的链状结构(c)。____ 。
②BeCl2溶于乙醚,不溶于苯,易发生水解;
③AlCl3溶于乙醚且溶于苯,FeCl2、MgCl2不溶于乙醚和苯;
④
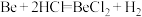 为放热反应。
为放热反应。请回答下列问题:
(1)装置A中方框内的仪器M应为
(2)装置B中盛放的试剂为
(3)反应后,装置A中BeCl2的乙醚溶液先经过滤除去杂质
(4)取
 g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用
g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用 mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸
mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸 mL(已知:
mL(已知: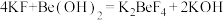 ;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为
;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为 、
、 和
和 的字母表示)。
的字母表示)。(5)氯化铍在气态时存在BeCl2分子(a)和二聚分子[(BeCl2)2](b),固态时则具有如下图所示的链状结构(c)。
您最近一年使用:0次
名校
3 . 乙炔是有机合成的重要原料之一,可由块状的电石和水反应制备。电石(主要成分为CaC2,还含有CaS)能与水反应生成大量溶解度较小的胶态 ,其被乙炔气体冲鼓会产生大量泡沫。某兴趣小组探究实验室制备乙炔的条件及测定乙炔中杂质气体含量的相关实验装置和仪器如图所示,其中如图1所示装置为常用的制备乙炔的发生装置,如图2所示为备选的制备实验仪器。
,其被乙炔气体冲鼓会产生大量泡沫。某兴趣小组探究实验室制备乙炔的条件及测定乙炔中杂质气体含量的相关实验装置和仪器如图所示,其中如图1所示装置为常用的制备乙炔的发生装置,如图2所示为备选的制备实验仪器。
(1)仪器x的名称为___________ ,生成乙炔的化学方程式为___________ 。
(2)为寻找制备乙炔的合适试剂X并消除制备时产生的泡沫,兴趣小组进行了四组探究实验。
①以图1装置进行实验,若试剂X为纯水或饱和食盐水,实验中可能造成的不良后果为___________ 。
②查阅资料知,醇羟基不能与CaC2发生反应,若试剂X为50%酒精,泡沫消除可能与乙醇___________ (填选项字母)有关。
a.可燃性 b.与水任意比互溶 c.挥发性
③结合文字与化学方程式分析试剂X为稀盐酸时,不产生泡沫的原因:___________ 。
④若试剂X为50%酒精,选用图2中仪器___________ (填字母标号)组装装置可达到随时开始和关停实验的效果。
(3)测定VL(标准状况)乙炔中H2S的含量。以足量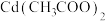 溶液作为吸收液,在酸性条件下,加入
溶液作为吸收液,在酸性条件下,加入
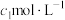 碘标准溶液和指示剂,再用Na2S2O3标准溶液滴定所得溶液,消耗
碘标准溶液和指示剂,再用Na2S2O3标准溶液滴定所得溶液,消耗
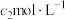 Na2S2O3标准溶液,已知:
Na2S2O3标准溶液,已知: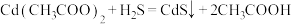 ;
; ;
;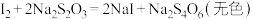 。
。
该气体样品中,H2S体积百分含量为___________ %(用含 、
、 、
、 、
、 、V的代数式表示);若滴定结束后仰视读数,会导致所得H2S体积百分含量
、V的代数式表示);若滴定结束后仰视读数,会导致所得H2S体积百分含量___________ (填“偏高”“偏低”或“无影响”)。
 ,其被乙炔气体冲鼓会产生大量泡沫。某兴趣小组探究实验室制备乙炔的条件及测定乙炔中杂质气体含量的相关实验装置和仪器如图所示,其中如图1所示装置为常用的制备乙炔的发生装置,如图2所示为备选的制备实验仪器。
,其被乙炔气体冲鼓会产生大量泡沫。某兴趣小组探究实验室制备乙炔的条件及测定乙炔中杂质气体含量的相关实验装置和仪器如图所示,其中如图1所示装置为常用的制备乙炔的发生装置,如图2所示为备选的制备实验仪器。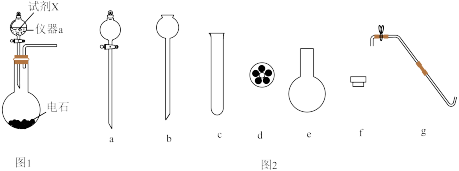
(1)仪器x的名称为
(2)为寻找制备乙炔的合适试剂X并消除制备时产生的泡沫,兴趣小组进行了四组探究实验。
| 序号 | 反应液体 | 反应现象 |
| 1 | 纯水 | 反应剧烈,产气快,有大量灰白色沉淀物[ ]和泡沫 ]和泡沫 |
| 2 | 饱和食盐水 | 反应稍慢,产气稍慢,有大量灰白色沉淀物[ ]和泡沫 ]和泡沫 |
| 3 | 50%酒精 | 反应慢,很适宜气体收集,有沉淀物生成,泡沫很少 |
| 4 | 稀盐酸 | 产气快,但没有沉淀和泡沫产生 |
②查阅资料知,醇羟基不能与CaC2发生反应,若试剂X为50%酒精,泡沫消除可能与乙醇
a.可燃性 b.与水任意比互溶 c.挥发性
③结合文字与化学方程式分析试剂X为稀盐酸时,不产生泡沫的原因:
④若试剂X为50%酒精,选用图2中仪器
(3)测定VL(标准状况)乙炔中H2S的含量。以足量
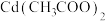 溶液作为吸收液,在酸性条件下,加入
溶液作为吸收液,在酸性条件下,加入
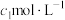 碘标准溶液和指示剂,再用Na2S2O3标准溶液滴定所得溶液,消耗
碘标准溶液和指示剂,再用Na2S2O3标准溶液滴定所得溶液,消耗
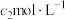 Na2S2O3标准溶液,已知:
Na2S2O3标准溶液,已知: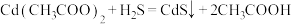 ;
; ;
;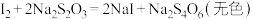 。
。该气体样品中,H2S体积百分含量为
 、
、 、
、 、
、 、V的代数式表示);若滴定结束后仰视读数,会导致所得H2S体积百分含量
、V的代数式表示);若滴定结束后仰视读数,会导致所得H2S体积百分含量
您最近一年使用:0次
名校
4 . 碳排放进入平台期后,进入平稳下降阶段称为“碳达峰”,与“碳中和”一起,简称“双碳”。以CO2为原料合成CH3OH依然是“双碳”环境下的科研热点,相关反应如下:
主反应:
 ;
;
副反应1:
 ;
;
副反应2:
 。
。
回答下列问题:
(1)部分键能的数据如下表所示,则主反应的
___________ ;
___________ (填“>”或“<”)0,原因为___________ 。
(2)化合物M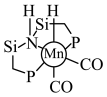 [
[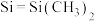 ,
,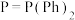 ,Ph代表苯基]可作为CO2合成甲醇的催化剂。化合物M使反应
,Ph代表苯基]可作为CO2合成甲醇的催化剂。化合物M使反应 的速率大大提高,对其逆反应活化能的影响为
的速率大大提高,对其逆反应活化能的影响为___________ 。
(3)某工厂控制条件,建立了存在上述主反应和副反应1的体系,保持其他条件不变,测定温度对合成甲醇过程的影响所得曲线如图1、图2所示(甲醇选择性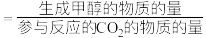 ,CO2转化率在指定时间段内测得),结合图1曲线变化趋势分析图2中温度对甲醇产率的影响:
,CO2转化率在指定时间段内测得),结合图1曲线变化趋势分析图2中温度对甲醇产率的影响:___________ ,242℃时甲醇产率为___________ %(保留三位有效数字)。 ,
, ,达到平衡时CH3OH产率为50%,总压强为p kPa,
,达到平衡时CH3OH产率为50%,总压强为p kPa, ,主反应的平衡常数
,主反应的平衡常数
___________ (保留两位有效数字);达到平衡用时5 min,则0~5 min内,用CH3OH分压表示的平均反应速率为___________ 。
主反应:

 ;
;副反应1:

 ;
;副反应2:

 。
。回答下列问题:
(1)部分键能的数据如下表所示,则主反应的


| 共价键 | H-H | C=O | C-H | C-O | O-H |
键能/( ) ) | 436 | 803 | 414 | 326 | 464 |
(2)化合物M
 [
[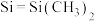 ,
,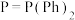 ,Ph代表苯基]可作为CO2合成甲醇的催化剂。化合物M使反应
,Ph代表苯基]可作为CO2合成甲醇的催化剂。化合物M使反应 的速率大大提高,对其逆反应活化能的影响为
的速率大大提高,对其逆反应活化能的影响为(3)某工厂控制条件,建立了存在上述主反应和副反应1的体系,保持其他条件不变,测定温度对合成甲醇过程的影响所得曲线如图1、图2所示(甲醇选择性
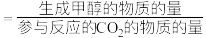 ,CO2转化率在指定时间段内测得),结合图1曲线变化趋势分析图2中温度对甲醇产率的影响:
,CO2转化率在指定时间段内测得),结合图1曲线变化趋势分析图2中温度对甲醇产率的影响:
 ,
, ,达到平衡时CH3OH产率为50%,总压强为p kPa,
,达到平衡时CH3OH产率为50%,总压强为p kPa, ,主反应的平衡常数
,主反应的平衡常数
您最近一年使用:0次
名校
5 . 反应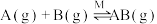 的反应机理为①
的反应机理为①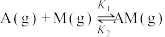
 ;②
;②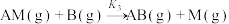
 ,反应过程中的能量变化如图所示。已知反应①:
,反应过程中的能量变化如图所示。已知反应①: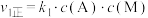 ,
,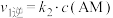 ;反应②:
;反应②: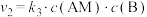 ;总反应
;总反应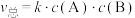 。下列说法错误的是
。下列说法错误的是
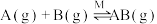 的反应机理为①
的反应机理为①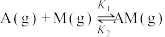
 ;②
;②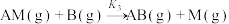
 ,反应过程中的能量变化如图所示。已知反应①:
,反应过程中的能量变化如图所示。已知反应①: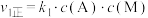 ,
,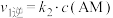 ;反应②:
;反应②: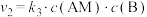 ;总反应
;总反应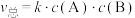 。下列说法错误的是
。下列说法错误的是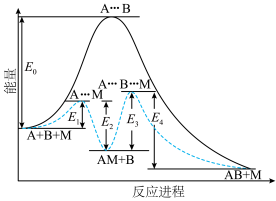
A. , , |
B.反应①先达到平衡状态,平衡时存在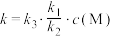 |
C.M为反应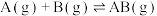 的催化剂 的催化剂 |
| D.反应体系达到平衡后,升高温度,AB浓度增大 |
您最近一年使用:0次
名校
6 . 化合物M是一种合成新型除草剂的中间体,其结构简式如图所示。已知: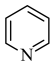 、
、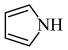 环上的碳原子和氮原子均以sp2杂化轨道相互重叠形成σ键。下列关于M的说法错误的是
环上的碳原子和氮原子均以sp2杂化轨道相互重叠形成σ键。下列关于M的说法错误的是
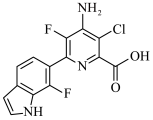
| A.能发生加成反应 |
| B.能发生缩聚反应 |
| C.分子式为C14H9ClN3O2F2 |
| D.所有N原子和C原子可能处于同一平面 |
您最近一年使用:0次
名校
7 . 农业化学品超量使用提高了植物组织中硝酸盐和氨基酸的含量,使农产品中维生素C( )、可溶性糖等营养成分降低。下列说法错误的是
)、可溶性糖等营养成分降低。下列说法错误的是
| A.维生素C存在立体异构 |
| B.维生素C有利于补铁药吸收 |
| C.可溶性糖均能与新制的氢氧化铜反应生成砖红色沉淀 |
| D.氨基酸是两性化合物 |
您最近一年使用:0次
名校
8 . 一种光电反应制备环氧化合物的装置如图所示。下列说法错误的是
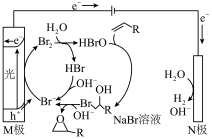
A. 在M极发生氧化反应 在M极发生氧化反应 |
B.可利用该原理由1-丁烯制 |
C.工作一段时间后溶液中 浓度基本不变 浓度基本不变 |
| D.当有1 mol H2生成时,理论上外电路转移2 mol电子 |
您最近一年使用:0次
名校
解题方法
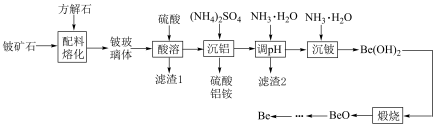
9 . Be是重要的战略性金属,其性质与铝相似。以铍矿石、方解石为原料制备铍的工艺流程如图所示: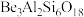 (氧化物形式为
(氧化物形式为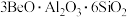 ),还含有Fe2O3(忽略其他元素对工艺流程的影响);方解石的主要成分为CaCO3;铍玻璃体的主要成分为CaAl2Si2O8、CaBe3SiO6,Fe2O3、SiO2;
),还含有Fe2O3(忽略其他元素对工艺流程的影响);方解石的主要成分为CaCO3;铍玻璃体的主要成分为CaAl2Si2O8、CaBe3SiO6,Fe2O3、SiO2;
②硫酸铝铵微溶于水;常温下,相关物质溶度积如下表所示:
回答下列问题:
(1)提高“配料熔化”时的反应速率及效率的措施为___________ (任写一条),该过程中主要反应的化学方程式为___________ 。
(2)“酸溶”时CaBe3SiO6发生反应的离子方程式为___________ 。
(3)常温下,“调pH”时所得滤液的pH为5,则“滤渣2”的成分为___________ (填化学式,下同)。该工业流程中可循环使用的物质为___________ 。
(4)常温时调节pH为7.5进行“沉铍”,通过计算判断 是否完全沉淀:
是否完全沉淀:___________ (溶液中离子浓度低于 时认为该离子完全沉淀);“沉铍”时不选用NaOH溶液的原因为
时认为该离子完全沉淀);“沉铍”时不选用NaOH溶液的原因为___________ (用离子方程式解释)。
(5)先将原料BeO与碳质还原剂压制成团块,再在高温下将其氯化为BeCl2,然后用镍坩埚为阴极,石墨棒为阳极,将等量的BeCl2与氯化钠混合熔融后进行电解,在___________ (填“阴”或“阳”)极上析出固态金属铍,该法的缺点为___________ 。
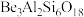 (氧化物形式为
(氧化物形式为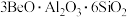 ),还含有Fe2O3(忽略其他元素对工艺流程的影响);方解石的主要成分为CaCO3;铍玻璃体的主要成分为CaAl2Si2O8、CaBe3SiO6,Fe2O3、SiO2;
),还含有Fe2O3(忽略其他元素对工艺流程的影响);方解石的主要成分为CaCO3;铍玻璃体的主要成分为CaAl2Si2O8、CaBe3SiO6,Fe2O3、SiO2;②硫酸铝铵微溶于水;常温下,相关物质溶度积如下表所示:
| 难溶物 |  |  | 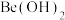 |
 | 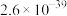 | 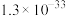 |  |
(1)提高“配料熔化”时的反应速率及效率的措施为
(2)“酸溶”时CaBe3SiO6发生反应的离子方程式为
(3)常温下,“调pH”时所得滤液的pH为5,则“滤渣2”的成分为
(4)常温时调节pH为7.5进行“沉铍”,通过计算判断
 是否完全沉淀:
是否完全沉淀: 时认为该离子完全沉淀);“沉铍”时不选用NaOH溶液的原因为
时认为该离子完全沉淀);“沉铍”时不选用NaOH溶液的原因为(5)先将原料BeO与碳质还原剂压制成团块,再在高温下将其氯化为BeCl2,然后用镍坩埚为阴极,石墨棒为阳极,将等量的BeCl2与氯化钠混合熔融后进行电解,在
您最近一年使用:0次
10 . 稀土元素是国家战略资源,目前我国稀土提炼技术处于世界领先地位。某课题组以含铈废渣(含较多的 、
、 、
、 及少量其他可溶于酸的物质)为原料,设计如图流程回收稀土元素铈,实现资源再利用。
及少量其他可溶于酸的物质)为原料,设计如图流程回收稀土元素铈,实现资源再利用。 不溶于稀硫酸,也不溶于
不溶于稀硫酸,也不溶于 溶液。
溶液。
回答下列问题:
(1)为提高“酸溶”的速率,实验室常用图示仪器进行固体物质的粉碎,该仪器的名称是___________ 。___________ ;“反应1”的离子方程式为___________ ,其中 的作用是
的作用是___________ 。
(3)“反应2”的离子方程式为___________ 。
(4)“滤液1”经一系列反应与操作可制得硫酸铁铵,硫酸铁铵可用作净水剂,其净水原理是___________ (用离子方程式表示)。
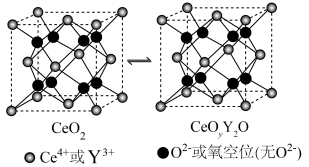
(5)氧化铈( )常用作玻璃工业添加剂,在其立方晶胞中掺杂
)常用作玻璃工业添加剂,在其立方晶胞中掺杂 ,
, 占据原来
占据原来 的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性质和应用,
的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性质和应用, 晶胞中
晶胞中 与最近
与最近 的核间距为
的核间距为 。已知:
。已知: 。
。 晶胞中与
晶胞中与 最近的
最近的 的个数为
的个数为___________ 。
②若掺杂 后得到:
后得到: 的晶体,则此晶体中
的晶体,则此晶体中 的空缺率为
的空缺率为___________ 。
③ 晶体的密度为
晶体的密度为___________ (列出表达式) 。
。
 、
、 、
、 及少量其他可溶于酸的物质)为原料,设计如图流程回收稀土元素铈,实现资源再利用。
及少量其他可溶于酸的物质)为原料,设计如图流程回收稀土元素铈,实现资源再利用。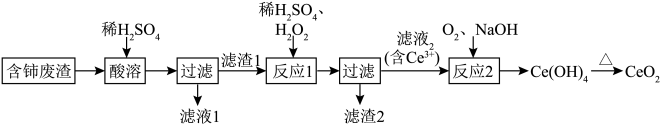
 不溶于稀硫酸,也不溶于
不溶于稀硫酸,也不溶于 溶液。
溶液。回答下列问题:
(1)为提高“酸溶”的速率,实验室常用图示仪器进行固体物质的粉碎,该仪器的名称是
 的作用是
的作用是(3)“反应2”的离子方程式为
(4)“滤液1”经一系列反应与操作可制得硫酸铁铵,硫酸铁铵可用作净水剂,其净水原理是
(5)氧化铈(
 )常用作玻璃工业添加剂,在其立方晶胞中掺杂
)常用作玻璃工业添加剂,在其立方晶胞中掺杂 ,
, 占据原来
占据原来 的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性质和应用,
的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性质和应用, 晶胞中
晶胞中 与最近
与最近 的核间距为
的核间距为 。已知:
。已知: 。
。
 晶胞中与
晶胞中与 最近的
最近的 的个数为
的个数为②若掺杂
 后得到:
后得到: 的晶体,则此晶体中
的晶体,则此晶体中 的空缺率为
的空缺率为③
 晶体的密度为
晶体的密度为 。
。
您最近一年使用:0次



