名校
解题方法
1 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,物质A由原子序数依次增大的元素X、Y、Z组成,其中Z的简单离子半径在同周期中最小,X、Y、Z简单离子的核外电子排布相同,物质A的结构式如图所示:
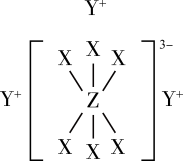
回答下列问题:
(1)Y、Z元素的中文名称为徐寿确定并使用至今,Y在周期表中的位置是___________ ,写出YM的电子式:___________ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):___________ 。
(3)在YZO2,与YX的混合液中,通入足量CO2,是工业制取A的一种方法,写出该反应的化学方程式:___________ 。
(4)镓(31Ga)与Z为同主族元素,氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。废弃的含GaAs的半导体材料可以用浓硝酸溶解,生成H3AsO4和Ga(NO3)3,其中硝酸被还原为NO2写出该反应的化学方程式为___________ 。
(5)YZM4是有机合成的重要还原剂,其合成路线如图所示: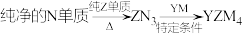 ,利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。
,利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。
①其反应的化学方程式为___________ 。
②现设计如图四种装置测定YZM4样品的纯度(假设杂质不参与反应)。
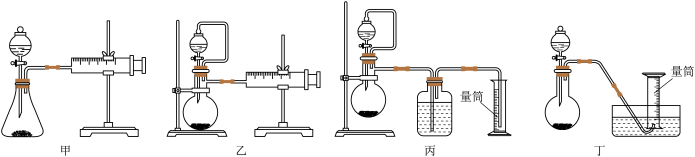
从简约性、准确性考虑,最适宜的方案是___________ (填编号)。
③取样品a g,若实验测得氢气的体积为V mL(标准状态),则YZM4样品纯度为___________ (用代数式表示)。

回答下列问题:
(1)Y、Z元素的中文名称为徐寿确定并使用至今,Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)在YZO2,与YX的混合液中,通入足量CO2,是工业制取A的一种方法,写出该反应的化学方程式:
(4)镓(31Ga)与Z为同主族元素,氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。废弃的含GaAs的半导体材料可以用浓硝酸溶解,生成H3AsO4和Ga(NO3)3,其中硝酸被还原为NO2写出该反应的化学方程式为
(5)YZM4是有机合成的重要还原剂,其合成路线如图所示:
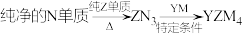 ,利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。
,利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。①其反应的化学方程式为
②现设计如图四种装置测定YZM4样品的纯度(假设杂质不参与反应)。

从简约性、准确性考虑,最适宜的方案是
③取样品a g,若实验测得氢气的体积为V mL(标准状态),则YZM4样品纯度为
您最近一年使用:0次
名校
2 . A、B、D、E四种元素均为短周期元素,原子序数逐渐增大。A元素原子的核外电子数、电子层数和最外层电子数均相等。B、D、E三种元素在周期表中的相对位置如图①所示,只有E元素的单质能与水反应生成两种酸,甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素:W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质,X分子含有10个电子。它们之间的转化关系如图②所示。
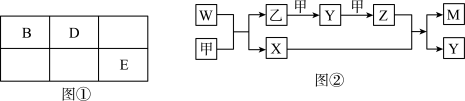
请回答下列问题:
(1)E元素价电子排布式为_____________ ,Z化学式为_____________ ;X分子的空间构型为_____________ 。
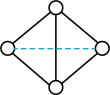
(2)E元素可分别与钙(Ca)、钛(Ti)元素形成化合物,其中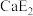 的熔点为782℃,沸点1600℃,
的熔点为782℃,沸点1600℃,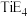 的熔点为−24.1℃,沸点为136.4℃,两者熔沸点差别很大的原因是
的熔点为−24.1℃,沸点为136.4℃,两者熔沸点差别很大的原因是_______________________________________ 。
(3)已知一种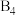 分子结构如图所示:断裂1mol B−B键吸收167kJ的热量,生成1mol B≡B放出942kJ热量。则由
分子结构如图所示:断裂1mol B−B键吸收167kJ的热量,生成1mol B≡B放出942kJ热量。则由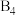 气态分子变成
气态分子变成 气态分子的热化学方程式为:
气态分子的热化学方程式为:_________________________ (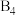 和
和 分子用化学式表示)。
分子用化学式表示)。
(4)将一定量的 、
、 的混合气体放入1L恒容密闭容器中,在200℃下达到平衡。测得平衡气体的总物质的量为0.4mol,其中
的混合气体放入1L恒容密闭容器中,在200℃下达到平衡。测得平衡气体的总物质的量为0.4mol,其中 为0.1mol,
为0.1mol, 为0.1mol。则该条件下
为0.1mol。则该条件下 的平衡转化率为
的平衡转化率为_____________ ,该温度下的平衡常数为_____________ 。

请回答下列问题:
(1)E元素价电子排布式为
(2)E元素可分别与钙(Ca)、钛(Ti)元素形成化合物,其中
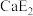 的熔点为782℃,沸点1600℃,
的熔点为782℃,沸点1600℃,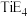 的熔点为−24.1℃,沸点为136.4℃,两者熔沸点差别很大的原因是
的熔点为−24.1℃,沸点为136.4℃,两者熔沸点差别很大的原因是(3)已知一种
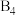 分子结构如图所示:断裂1mol B−B键吸收167kJ的热量,生成1mol B≡B放出942kJ热量。则由
分子结构如图所示:断裂1mol B−B键吸收167kJ的热量,生成1mol B≡B放出942kJ热量。则由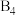 气态分子变成
气态分子变成 气态分子的热化学方程式为:
气态分子的热化学方程式为: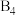 和
和 分子用化学式表示)。
分子用化学式表示)。
(4)将一定量的
 、
、 的混合气体放入1L恒容密闭容器中,在200℃下达到平衡。测得平衡气体的总物质的量为0.4mol,其中
的混合气体放入1L恒容密闭容器中,在200℃下达到平衡。测得平衡气体的总物质的量为0.4mol,其中 为0.1mol,
为0.1mol, 为0.1mol。则该条件下
为0.1mol。则该条件下 的平衡转化率为
的平衡转化率为
您最近一年使用:0次
2023-04-14更新
|
168次组卷
|
2卷引用:湖北省宜城市第一中学、枣阳一中等六校2022-2023学年高二下学期期中考试化学试题
3 . 从钒铬锰矿渣(主要成分为 、
、 、
、 )中提铬的一种工艺流程如下:
)中提铬的一种工艺流程如下: ](在空气中易被氧化.回答下列问题:
](在空气中易被氧化.回答下列问题:
(1)Cr元素位于元素周期表第_______ 周期_______ 族。
(2)用 溶液制备
溶液制备 胶体的化学方程式为
胶体的化学方程式为_______ 。
(3)常温下,各种形态五价钒粒子总浓度的对数[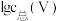 ]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中
]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中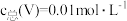 ,“沉钒”过程控制
,“沉钒”过程控制 ,则与胶体共沉降的五价钒粒子的存在形态为
,则与胶体共沉降的五价钒粒子的存在形态为_______ (填化学式)。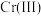 、
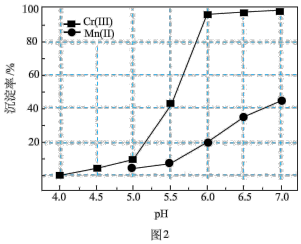
、 的沉淀率与pH关系如图2。“沉铬”过程最佳pH为
的沉淀率与pH关系如图2。“沉铬”过程最佳pH为_______ ;在该条件下滤液B中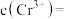
_______  【
【 近似为
近似为 ,
, 的
的 近似为
近似为 】。
】。 的离子方程式为
的离子方程式为_______ 。
(6)“提纯”过程中 的作用为
的作用为_______ 。
 、
、 、
、 )中提铬的一种工艺流程如下:
)中提铬的一种工艺流程如下: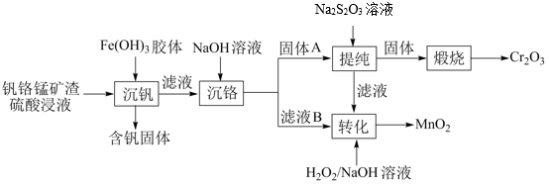
 ](在空气中易被氧化.回答下列问题:
](在空气中易被氧化.回答下列问题:(1)Cr元素位于元素周期表第
(2)用
 溶液制备
溶液制备 胶体的化学方程式为
胶体的化学方程式为(3)常温下,各种形态五价钒粒子总浓度的对数[
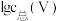 ]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中
]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中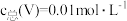 ,“沉钒”过程控制
,“沉钒”过程控制 ,则与胶体共沉降的五价钒粒子的存在形态为
,则与胶体共沉降的五价钒粒子的存在形态为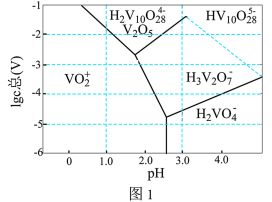
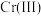 、
、 的沉淀率与pH关系如图2。“沉铬”过程最佳pH为
的沉淀率与pH关系如图2。“沉铬”过程最佳pH为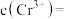
 【
【 近似为
近似为 ,
, 的
的 近似为
近似为 】。
】。
 的离子方程式为
的离子方程式为(6)“提纯”过程中
 的作用为
的作用为
您最近一年使用:0次
2021-09-13更新
|
10983次组卷
|
16卷引用:湖北省枣阳市第一中学2022-2023学年高三上学期8月化学月考试题
湖北省枣阳市第一中学2022-2023学年高三上学期8月化学月考试题2021年新高考辽宁化学高考真题辽宁省实验中学2021-2022学年高二上学期11月期中阶段测化学试题2021年辽宁高考化学试题变式题11-19(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)押新高考卷14题 工艺流程综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)微专题17 热点金属及其化合物制备流程(V、Cr、Mn、Co、Ni)-备战2023年高考化学一轮复习考点微专题第二部分 热点专项突破——解题能力稳提升专项2 物质提纯类的工艺流程(已下线)专题29 无机化工流程综合分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)05 无机化工流程题(5) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)黑龙江省牡丹江市第二高级中学2023-2024学年高三下学期考前热身卷化学(三)试题
4 . 现有下列短周期元素性质的有关数据:
(1)根据元素周期律确定a至h 8种元素在周期表中的位置,将它们的元素编号填入下表相应的空格内。如图:______ 。
(2)上述元素形成的氢化物中,分子间存在氢键的有(填氢化物的化学式)______ 。
(3)氢化铝锂(LiAlH4)是一种易燃易爆具有极强还原性的物质,它在有机合成上应用广泛。在125℃时氢化铝锂分解为氢气、金属铝及氢化锂(LiH)。
①氢化铝锂易水解,最初得三种产物,请写出其水解反应方程式________________ 。
②与氢化铝锂性质相似但较为温和的还原剂由上述a、d、h三种元素组成,请写出这种还原剂的电子式_____ 。写出该物质受热分解的反应方程式:______ 。
(4)原子数相同,电子总数相同的分子或离子互称等电子体。在元素周期表中,与碳相邻的两种元素可形成具有石墨型晶体结构的“白石墨”,“白石墨”和石墨具有等电子体特征,写出“白石墨”的最小结构单元--六元环的结构式______ 。
| 元素编号 | a | b | c | d | e | f | g | h |
| 原子半径/nm | 0.037 | 0.071 | 0.075 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或最低化合价 | +1 | -1 | -3 | +3 | -2 | +3 | +1 | +1 |
(1)根据元素周期律确定a至h 8种元素在周期表中的位置,将它们的元素编号填入下表相应的空格内。如图:
| 族 周期 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | 0 |
| 1 | ||||||||
| 2 | ||||||||
| 3 |
(2)上述元素形成的氢化物中,分子间存在氢键的有(填氢化物的化学式)
(3)氢化铝锂(LiAlH4)是一种易燃易爆具有极强还原性的物质,它在有机合成上应用广泛。在125℃时氢化铝锂分解为氢气、金属铝及氢化锂(LiH)。
①氢化铝锂易水解,最初得三种产物,请写出其水解反应方程式
②与氢化铝锂性质相似但较为温和的还原剂由上述a、d、h三种元素组成,请写出这种还原剂的电子式
(4)原子数相同,电子总数相同的分子或离子互称等电子体。在元素周期表中,与碳相邻的两种元素可形成具有石墨型晶体结构的“白石墨”,“白石墨”和石墨具有等电子体特征,写出“白石墨”的最小结构单元--六元环的结构式
您最近一年使用:0次
11-12高三上·湖北襄阳·期中
5 . 有A、B、C、D四种短周期元素在周期表中相对位置如右图:
(1)A与D形成的液态化合物是常见的重要有机溶剂,则A、B、C、D四种元素最高价氧化物对应的水化物酸性由强到弱的顺序是:_______ >_________ >___________ >______ (用化学式表示),B、C、D三种元素的第一电离能由大到小的顺序是:______________ (用元素符号表示)(2)X、Y为C、D两种元素形成的单质。标准状况下,X的密度为3.17 g/L。Z是一种化合物,焰色反应呈紫色(透过蓝色钴玻璃),室温下0.1 mol/L Z水溶液pH=13。X、Y、Z有如图转化关系:

①写出X与Z反应的离子方程式:_____________________________
②已知丙能与稀硫酸反应生成使品红褪色的气体。丁的化学式_______ ,丁的水溶液pH>7的原因:___________________________________ (用离子方程式表示)
③将20 mL 0.5 mol/L丙溶液逐滴加入20 mL 0.2 mol/L KMnO4溶液(硫酸酸化)中,恰好褪色。写出反应的离子方程式__________ 。
| A | |||
| B | C | D |
(1)A与D形成的液态化合物是常见的重要有机溶剂,则A、B、C、D四种元素最高价氧化物对应的水化物酸性由强到弱的顺序是:

①写出X与Z反应的离子方程式:
②已知丙能与稀硫酸反应生成使品红褪色的气体。丁的化学式
③将20 mL 0.5 mol/L丙溶液逐滴加入20 mL 0.2 mol/L KMnO4溶液(硫酸酸化)中,恰好褪色。写出反应的离子方程式
您最近一年使用:0次



