1 . 由下列实验及现象不能 推出相应结论的是( )
| 实验 | 现象 | 结论 | |
| A. | 向2mL0.1mol/LFeCl3的溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
| B. | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
| C. | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
| D. | 将SO2通入酸性KMnO4溶液 | 紫色溶液褪色 | SO2具有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-09-27更新
|
218次组卷
|
3卷引用:广东省阳春市第一中学2019-2020学年高二上学期月考一化学试题
名校
2 . I.某兴趣学习小组设计如图装置制取SO2,研究其性质。
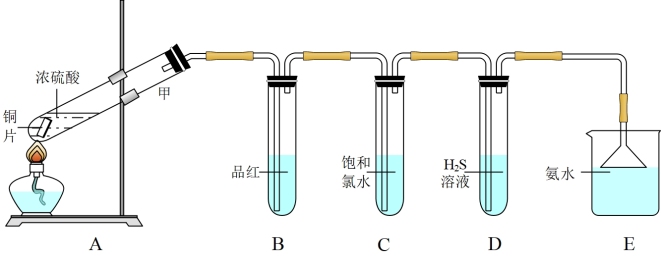
请回答下列问题:
(1)B、C、D分别用于检验SO2的性质,写出C中反应的离子方程式_______ 。
(2)实验中观察到D 中有浑浊出现,有同学提出此现象不能证明SO2具有氧化性,请简述理由________________________ 。
(3)E装置的作用为______________ 。
II.某学习小组进一步探究不同浓度的硫酸氧化性不同,设计并完成如下实验:
称取一定量还原铁粉放入一定体积浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。经检验,气体Y 中含有SO2、H2。
(4)溶液X中含有的金属阳离子是(填化学式)_________ ,简述如何检验该离子______ 。
(5)为了测定气体Y 中SO2的含量,将2.24 L( 标准状况)气体Y 通入到200.00mL0.2000mol/L 酸性高锰酸钾溶液中,充分反应后,取出20.00mL溶液转入锥形瓶中进行滴定,消耗0.1000mol/L的KHC2O4标准液10.00mL (高锰酸钾被还原均生成Mn2+ )。
①已知室温下,0.1000mol/L KHC2O4的溶液中,c(C2O42-) > c(H2C2O4)。滴定操作过程中标准液应用_______ (填仪器名称)盛装;滴定终点的现象为____________ 。
②计算气体Y 中SO2 的物质的量分数为__________ 。

请回答下列问题:
(1)B、C、D分别用于检验SO2的性质,写出C中反应的离子方程式
(2)实验中观察到D 中有浑浊出现,有同学提出此现象不能证明SO2具有氧化性,请简述理由
(3)E装置的作用为
II.某学习小组进一步探究不同浓度的硫酸氧化性不同,设计并完成如下实验:
称取一定量还原铁粉放入一定体积浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。经检验,气体Y 中含有SO2、H2。
(4)溶液X中含有的金属阳离子是(填化学式)
(5)为了测定气体Y 中SO2的含量,将2.24 L( 标准状况)气体Y 通入到200.00mL0.2000mol/L 酸性高锰酸钾溶液中,充分反应后,取出20.00mL溶液转入锥形瓶中进行滴定,消耗0.1000mol/L的KHC2O4标准液10.00mL (高锰酸钾被还原均生成Mn2+ )。
①已知室温下,0.1000mol/L KHC2O4的溶液中,c(C2O42-) > c(H2C2O4)。滴定操作过程中标准液应用
②计算气体Y 中SO2 的物质的量分数为
您最近一年使用:0次
2018-04-13更新
|
384次组卷
|
2卷引用:【全国百强校】广东省阳春市第一中学2018届高三第九次月考理综化学试题
名校
解题方法
3 . 某品牌糖衣片补血剂,除去糖衣后显淡蓝绿色,主要成分是硫酸亚铁,不含其他铁的化合物.某研究性学习小组为测定该补血剂中硫酸亚铁的含量进行了以下探究:
步骤一:取10片补血剂研磨成粉末,加入 的稀硫酸,充分溶解后过滤.
的稀硫酸,充分溶解后过滤.
步骤二:取上述过滤后的滤液,滴加 溶液,再加入过量的
溶液,再加入过量的 溶液,充分反应后,过滤.
溶液,充分反应后,过滤.
步骤三:将步骤二过滤所得固体灼烧至恒重,称量,质量为 .
.
请回答下列问题:
(1)实验室用 的浓硫酸配制
的浓硫酸配制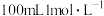 的硫酸溶液,所需浓硫酸的体积为
的硫酸溶液,所需浓硫酸的体积为____________  (计算结果精确到小数点后一位).
(计算结果精确到小数点后一位).
(2)可使用容量瓶进行下列操作中的____________ (填标号).
A.配制一定体积准确浓度的标准溶液
B.长期贮存溶液
C.代替量筒量取一定体积的液体
(3) 的电子式为
的电子式为____________ ,步骤二中加入过量 发生反应的离子方程式为
发生反应的离子方程式为____________ .
(4)每片补血剂中含硫酸亚铁的质量为____________ g(用含a的代数式表示).
(5) 用作补血剂使用时,医生建议与维生素C片同服,同学甲猜测维生素C可将
用作补血剂使用时,医生建议与维生素C片同服,同学甲猜测维生素C可将 转化为
转化为 以利于人体吸收.为了验证这一猜想,设计如下实验:
以利于人体吸收.为了验证这一猜想,设计如下实验:
由上述实验能否得出维生素C可将 转化为
转化为 的结论?
的结论?____________ (填“能”或“否”),请说明理由:____________ .
(6)往 溶液中滴加
溶液中滴加 溶液,有白色沉淀A生成.某实验小组对所得白色沉淀A展开研究:
溶液,有白色沉淀A生成.某实验小组对所得白色沉淀A展开研究:
查阅资料:在溶液中不存在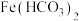 .
.
Ⅰ.取少量白色沉淀A,充分洗涤后,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
Ⅱ.向Ⅰ所得溶液中滴入 试剂,溶液几乎不变色;
试剂,溶液几乎不变色;
Ⅲ.向Ⅱ溶液中再滴入少量氯水,溶液立即变为红色.
根据以上现象,生成的白色沉淀A的化学式为____________ .
步骤一:取10片补血剂研磨成粉末,加入
 的稀硫酸,充分溶解后过滤.
的稀硫酸,充分溶解后过滤.步骤二:取上述过滤后的滤液,滴加
 溶液,再加入过量的
溶液,再加入过量的 溶液,充分反应后,过滤.
溶液,充分反应后,过滤.步骤三:将步骤二过滤所得固体灼烧至恒重,称量,质量为
 .
.请回答下列问题:
(1)实验室用
 的浓硫酸配制
的浓硫酸配制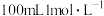 的硫酸溶液,所需浓硫酸的体积为
的硫酸溶液,所需浓硫酸的体积为 (计算结果精确到小数点后一位).
(计算结果精确到小数点后一位).(2)可使用容量瓶进行下列操作中的
A.配制一定体积准确浓度的标准溶液
B.长期贮存溶液
C.代替量筒量取一定体积的液体
(3)
 的电子式为
的电子式为 发生反应的离子方程式为
发生反应的离子方程式为(4)每片补血剂中含硫酸亚铁的质量为
(5)
 用作补血剂使用时,医生建议与维生素C片同服,同学甲猜测维生素C可将
用作补血剂使用时,医生建议与维生素C片同服,同学甲猜测维生素C可将 转化为
转化为 以利于人体吸收.为了验证这一猜想,设计如下实验:
以利于人体吸收.为了验证这一猜想,设计如下实验:| 实验方案 | 实验现象 |
取适量 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液 | 溶液紫红色褪去 |
 转化为
转化为 的结论?
的结论?(6)往
 溶液中滴加
溶液中滴加 溶液,有白色沉淀A生成.某实验小组对所得白色沉淀A展开研究:
溶液,有白色沉淀A生成.某实验小组对所得白色沉淀A展开研究:查阅资料:在溶液中不存在
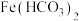 .
.Ⅰ.取少量白色沉淀A,充分洗涤后,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
Ⅱ.向Ⅰ所得溶液中滴入
 试剂,溶液几乎不变色;
试剂,溶液几乎不变色;Ⅲ.向Ⅱ溶液中再滴入少量氯水,溶液立即变为红色.
根据以上现象,生成的白色沉淀A的化学式为
您最近一年使用:0次
2024-02-03更新
|
65次组卷
|
3卷引用:广东省阳江市江城区部分学校2023-2024学年高一上学期期末联考化学试题
4 . 按图装置进行实验。将稀硫酸全部加入Ⅰ中的试管,关闭活塞。下列说法正确的是
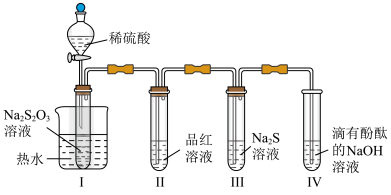
A.Ⅰ中试管内的反应,体现 的氧化性 的氧化性 | B.Ⅱ中品红溶液褪色,体现 的还原性 的还原性 |
| C.在Ⅰ和Ⅲ的试管中,都出现了浑浊现象 | D.撤掉水浴,重做实验,Ⅳ中红色更快褪去 |
您最近一年使用:0次
2023-07-04更新
|
9748次组卷
|
20卷引用:广东省阳江市2023-2024学年高二上学期10月月考化学试题
广东省阳江市2023-2024学年高二上学期10月月考化学试题2023年高考广东卷化学真题(已下线)2023年广东卷高考真题变式题(选择题6-10)(已下线)第12讲 硫及其化合物吉林省长春市第五中学2022-2023学年高一下学期期末考试化学试题福建省厦门第一中学2023-2024学年高三暑期复习检测化学试题黑龙江省双鸭山市第一中学2023-2024学年高三上学期开学考试化学试题(已下线)考点15 硫及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)黑龙江省大庆市东风中学2023-2024学年高三上学期适应性考试化学试题(已下线)实验02 定性与定量研究影响化学反应速率的因素-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)(已下线)考点44 化学实验基础(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点3 物质的制备与性质实验 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)河南省洛阳市新安县第一高级中学2023-2024学年高一上学期致远班10月月考化学试题中国人民大学附属中学2023-2024学年高三下学期化学练习6四川省绵阳市南山中学2023-2024学年高一下学期期中考试 化学 湖南省长沙市一中2024届高三下学期高考适应性演练(三)化学试题湖南省长沙市第一中学2024届高三下学期三模化学试题广东省广州市培正中学等三校联考2023-2024学年高一下学期4月期中检测化学试题2024年中国人民大学附属中学高三下学期高考化学模拟练习试卷(六)(已下线)湖南省永州市道县第一中学2023-2024学年高三下学期5月期中考试化学试题
名校
解题方法
5 . 不是所有灭火都适用CO2灭火器,比如万一金属镁失火,应该用沙土而不是CO2灭火器。原因是CO2可以支持镁燃烧,发生反应:2Mg+CO2=2MgO+C,下列关于该反应的判断正确的是
| A.Mg的化合价由0升高到+2,所以MgO是还原产物 |
| B.由此反应可以判断该反应条件下:氧化性CO2 > MgO,还原性Mg > C |
| C.CO2作氧化剂,表现出氧化性,发生氧化反应 |
| D.Mg原子失去电子的数目与C原子得到电子的数目之比为2∶4 |
您最近一年使用:0次
2022-11-22更新
|
118次组卷
|
2卷引用:广东省阳江市四校2022-2023学年高一上学期期中联考化学试题
名校
解题方法
6 . 根据Cu2++Zn=Zn2++Cu、Ag++Cu=2Ag+Cu2+可知,下列分析正确的是
①氧化性:Ag+>Cu2+>Zn2+
②氧化性:Ag+<Zn2+<Cu2+
③还原性:Zn>Cu>Ag
④还原性:Zn<Ag<Cu
①氧化性:Ag+>Cu2+>Zn2+
②氧化性:Ag+<Zn2+<Cu2+
③还原性:Zn>Cu>Ag
④还原性:Zn<Ag<Cu
| A.①④ | B.①③ | C.②③ | D.②④ |
您最近一年使用:0次
2020-11-27更新
|
114次组卷
|
2卷引用:广东阳江市阳西县第一中学2021-2022学年高一上学期第二次月考化学试题
名校
7 . 甲酸正丁酯是重要的有机原料,可通过酯化反应制得。已知A的核磁共振氢谱吸收峰的高度比为3:2:2:1,丙烯在通常条件下稳定,但遇强 氧化剂时容易被氧化生成CO2。
氧化剂时容易被氧化生成CO2。
Ⅰ.正丁醇(CH3CH2CH2CH2OH)的制备。
某研究性学习小组为合成正丁醇,查阅资料得知一条合成路线:
CH3CH=CH2+CO+H2 A(液态)
A(液态)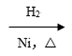 正丁醇;
正丁醇;
(1)已知反应1的原子理论利用率为100%,请写出A的结构简式_________________ 。
(2)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是_______________ (填序号,试剂可以重复使用)。
①饱和Na2SO3溶液 ②酸性KMnO4溶液
③石灰水 ④无水CuSO4 ⑤品红溶液
Ⅱ.甲酸正丁酯的合成。
某研究性学习小组利用如右图装置进一步合成甲酸正丁酯。

(3)大试管中溶液的作用除了溶解正丁醇外,还有____________________________ 。
(5)已知反应结束后烧瓶中是甲酸、正丁醇、甲酸正丁酯和硫酸的混合物,为了回收大量未反应的甲酸和正丁醇,该研究性小组根据相关理化性质设计以下分离操作步骤流程图。

上述流程图中,操作1是___________ ,试剂b是____________ 。
 氧化剂时容易被氧化生成CO2。
氧化剂时容易被氧化生成CO2。Ⅰ.正丁醇(CH3CH2CH2CH2OH)的制备。
某研究性学习小组为合成正丁醇,查阅资料得知一条合成路线:
CH3CH=CH2+CO+H2
 A(液态)
A(液态) 正丁醇;
正丁醇;(1)已知反应1的原子理论利用率为100%,请写出A的结构简式
(2)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是
①饱和Na2SO3溶液 ②酸性KMnO4溶液
③石灰水 ④无水CuSO4 ⑤品红溶液
Ⅱ.甲酸正丁酯的合成。
某研究性学习小组利用如右图装置进一步合成甲酸正丁酯。

(3)大试管中溶液的作用除了溶解正丁醇外,还有
(4)若大试管中溶液是NaOH溶液,则收集到的产物比预期的少,其原因是 学方程式表示)
学方程式表示)
(5)已知反应结束后烧瓶中是甲酸、正丁醇、甲酸正丁酯和硫酸的混合物,为了回收大量未反应的甲酸和正丁醇,该研究性小组根据相关理化性质设计以下分离操作步骤流程图。

| 甲酸 | 正丁醇 | 甲酸正丁酯 | |
| 熔点/℃ | 8.4 | -88.9 | -91 |
| 沸点/℃ | 100.8 | 117.7 | 107 |
| 溶解性 | 三者能相互溶解。 | ||
您最近一年使用:0次
2016-12-09更新
|
1360次组卷
|
2卷引用:2017届广东省阳江市阳东广雅学校高三10月月考化学卷
名校
8 . N2O俗称“笑气”,医疗上曾用作可吸入性麻醉剂,下列反应能产生N2O: 3CO+2NO2=3CO2+N2O。下列关于N2O的说法一定正确的是
| A.上述反应中每生成1mol N2O,消耗67.2LCO |
| B.等质量的N2O和CO2含有相等的电子数 |
| C.N2O只有氧化性,无还原性 |
| D.上述反应中若有3 mol的CO被还原,则转移6NA个电子 |
您最近一年使用:0次
2016-12-09更新
|
936次组卷
|
15卷引用:广东省阳春市第一中学2019-2020学年高二上学期月考一化学试题
广东省阳春市第一中学2019-2020学年高二上学期月考一化学试题2015-2016学年安徽合肥一中高一下期中化学试卷安徽省怀宁中学2019-2020学年高二上学期开学考试化学试题2020届高考化学知识点必练——氧化还原反应的本质及相关概念重庆市江北中学2019-2020学年高一上学期期末模拟考试化学试题四川省泸州市泸县第二中学2019-2020学年高一下学期第一次在线月考化学试题(已下线)【南昌新东方】铁路一中 2019-2020 高一(上)期末吉林省辽源市第五中学校2019-2020学年高一期中考试化学试题天津市第八中学2020-2021学年高一上学期第三次统练化学试题宁夏石嘴山市第三中学2020-2021学年高一上学期第二次月考化学试题专题7 本专题达标检测-高中化学必修第二册苏教版2019江西省南昌市进贤县第一中学2020-2021学年高一上学期期中考试化学试题河北省邯郸市大名县第一中学2020-2021学年高一下学期3月月考化学试题黑龙江省佳木斯市第一中学2021-2022学年高一上学期12月月考化学试题北京市第一六一中学2021-2022学年高一下学期期中阶段(选考班)化学试题
9 . 把浓盐酸分别滴入点滴板上的各种溶液中,下列现象及分析均正确的是
| 实验 | 现象 |
 | ①中溶液变蓝且无其他明显现象 |
| ②中无明显现象 | |
| ③中溶液褪色 | |
| ④中产生黄绿色气体 |
| A.①中现象体现了浓盐酸的酸性和氧化性 |
| B.②中现象说明未发生反应 |
| C.③中溶液褪色体现了氯气的漂白性 |
D.④中产生黄绿色气体的反应是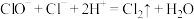 |
您最近一年使用:0次
2023-01-21更新
|
307次组卷
|
2卷引用:广东省阳江市高新区2022-2023学年高一上学期期末考试化学试题
11-12高一·江西上饶·期末
名校
解题方法
10 . 下列有关性质的比较,不正确的是( )
| A.酸性强弱:HI>HBr>HCl |
| B.非金属性:O>S>Se |
| C.还原性强弱:F->Cl->I- |
| D.碱性强弱:KOH>NaOH>LiOH |
您最近一年使用:0次
2016-12-09更新
|
1233次组卷
|
7卷引用:2016-2017学年广东省阳江市阳东区第一中学高一下学期第一次月考(文)化学试卷
2016-2017学年广东省阳江市阳东区第一中学高一下学期第一次月考(文)化学试卷(已下线)2011-2012学年江西上饶中学高一潜能班下期末考试化学试卷(已下线)2012-2013吉林省吉林一中高二下学期期中考试化学试卷步步为赢 高一化学暑假作业:作业五 阶段检测(一)2019—2020学年人教版必修2第一章 第一节《元素周期表》第2课时《元素的性质与原子结构》(跟踪训练)湖北省黄冈市黄梅国际育才高级中学2019-2020学年高一下学期复学考试化学试题(已下线)4.1.2 原子结构与元素的性质练习(2)——《高中新教材同步备课》(人教版 必修第一册)



