名校
1 . 实验室有一包含锰混合物样品,可能含有MnO2(63.2%,难溶于水),MnO(77.5%,难溶于水),MnCO3(47.8%,难溶于水)和MnCl2(43.7%,易溶于水)(括号内是该物质锰元素质量分数)中的一种或几种,为测定其中锰元素的含量,小明查阅资料设计了如下流程。请回答下列问题:

(1)操作X是_______ 。
(2)“酸浸”过程中发生的反应均为复分解反应,“酸浸”的目的是_______ 。
(3)“氧化”步骤的离子方程式是_______ ,上述流程中能够循环利用的物质是_______ 。
(4)若氯气与氢氧化钠溶液反应除了生成NaClO3外,还有部分NaClO,且二者的物质的量之比为3∶1,则反应的离子方程式为_______ ,氧化产物与还原产物的物质的量之比为_______ 。
(5)小明在实验中,消耗混合物样品10g,最终收集到MnO2 5.8g,样品中锰元素质量分数为_______ (保留1位小数)。李华经过分析认为上述结果存在问题,理由是_______ ,经过检查,原来是小明忘记了操作X处所得的MnO2。

(1)操作X是
(2)“酸浸”过程中发生的反应均为复分解反应,“酸浸”的目的是
(3)“氧化”步骤的离子方程式是
(4)若氯气与氢氧化钠溶液反应除了生成NaClO3外,还有部分NaClO,且二者的物质的量之比为3∶1,则反应的离子方程式为
(5)小明在实验中,消耗混合物样品10g,最终收集到MnO2 5.8g,样品中锰元素质量分数为
您最近一年使用:0次
名校
解题方法
2 . 水合肼(N2H4•H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl,据此,某学生设计了下列实验。
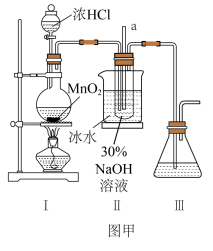
【制备NaClO溶液】实验装置如图图甲所示(部分夹持装置已省略)
已知:3NaClO 2NaCL+NaClO3
2NaCL+NaClO3
(1)装置I中装浓盐酸的装置名称为______ ;装置I圆底烧瓶中发生的化学方程式是_______ 。
(2)II中用冰水浴控制温度在30℃以下,其主要目的________ ;NaClO的电子式为______ 。
【制取水合肼】实验装置如图乙所示
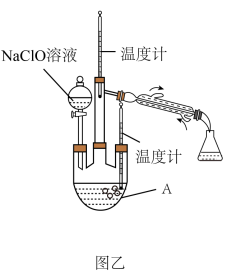
(3)反应过程中,如果分液漏斗中溶液的滴速过快,部分N2H4•H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出产率降低的相关化学反应方程式_________ ;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
【测定肼的含量】
(4)称取馏分0.300g,加水配成20.0mL溶液,一定条件下用0.150mol•L-1的I2溶液滴定。已知:N2H4•H2O+2I2=N2+4HI+H2O。
①滴定时,可以选用的指示剂为______ ;滴定终点的现象为_______ 。
②实验测得消耗I2溶液的平均值为20.00mL,馏分中N2H4•H2O的质量分数为______ (保留三位有效数字)。
【制备NaClO溶液】实验装置如图图甲所示(部分夹持装置已省略)

已知:3NaClO
 2NaCL+NaClO3
2NaCL+NaClO3(1)装置I中装浓盐酸的装置名称为
(2)II中用冰水浴控制温度在30℃以下,其主要目的
【制取水合肼】实验装置如图乙所示

(3)反应过程中,如果分液漏斗中溶液的滴速过快,部分N2H4•H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出产率降低的相关化学反应方程式
【测定肼的含量】
(4)称取馏分0.300g,加水配成20.0mL溶液,一定条件下用0.150mol•L-1的I2溶液滴定。已知:N2H4•H2O+2I2=N2+4HI+H2O。
①滴定时,可以选用的指示剂为
②实验测得消耗I2溶液的平均值为20.00mL,馏分中N2H4•H2O的质量分数为
您最近一年使用:0次
名校
3 . 水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl,据此,某学生设计了下列实验。
【制备NaClO溶液】实验装置如下图图甲所示(部分夹持装置已省略)
已知:3NaClO 2NaCl+NaClO3
2NaCl+NaClO3
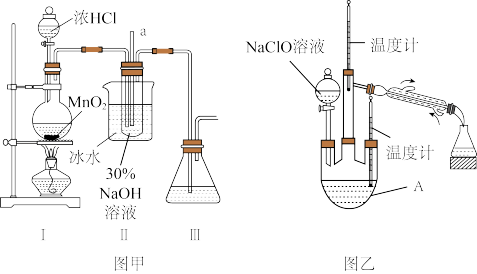
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有___________(填字母)。
(2)装置I中发生的化学方程式是___________ ;Ⅱ中玻璃管a的作用为___________ ;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的___________ 。
【制取水合肼】实验装置如图乙所示
(3)反应过程中,如果分液漏斗中溶液的滴速过快,部分N2H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式___________ ;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
【测定肼的含量】
(4)称取馏分0.3000g,加水配成20.0mL溶液,一定条件下用0.1500mol·L−1的I2溶液滴定。已知:N2H4·H2O+2I2=N2↑+4HI+H2O。
①滴定时,可以选用的指示剂为___________ ;滴定终点的现象为___________ 。
②实验测得消耗I2溶液的平均值为20.00mL,馏分中N2H4·H2O的质量分数为___________ 。
【制备NaClO溶液】实验装置如下图图甲所示(部分夹持装置已省略)
已知:3NaClO
 2NaCl+NaClO3
2NaCl+NaClO3
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有___________(填字母)。
| A.容量瓶 | B.烧杯 | C.移液管 | D.玻璃棒 |
【制取水合肼】实验装置如图乙所示
(3)反应过程中,如果分液漏斗中溶液的滴速过快,部分N2H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式
【测定肼的含量】
(4)称取馏分0.3000g,加水配成20.0mL溶液,一定条件下用0.1500mol·L−1的I2溶液滴定。已知:N2H4·H2O+2I2=N2↑+4HI+H2O。
①滴定时,可以选用的指示剂为
②实验测得消耗I2溶液的平均值为20.00mL,馏分中N2H4·H2O的质量分数为
您最近一年使用:0次
名校
解题方法
4 . 化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:
已知:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中的其它成分与NaOH和盐酸均不反应。
I.摩擦剂中氢氧化铝的定性检验。取适量牙膏样品于烧杯中,加水充分搅拌后过滤,滤渣中加入过量NaOH溶液,过滤,向滤液中通入过量CO2有白色沉淀生成。
(1)在上述操作中,需要用到图中的实验仪器有______ (选填编号)

(2)氢氧化铝与NaOH溶液反应的离子方程式为______ ,有同学认为滤液中通CO2后有白色沉淀生成不能证明摩擦剂中一定含有Al(OH)3,若要进一步证明含Al(OH)3,需要补充的操作是______ (写出操作、现象和结论)。
Ⅱ.牙膏样品中碳酸钙的定量测定。利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
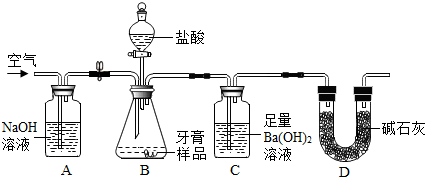
依据实验过程回答下列问题:
(3)装置A中发生反应的离子方程式为______ ,反应结束后,还要持续通一段时间空气的目的是______ 。
(4)下列各项措施中,能提高测定准确度的是______ (选填编号)。
a.把盐酸换成不具有挥发性的硫酸
b.在A~B之间增添盛有浓硫酸的干燥装置
c.滴加盐酸不宜过快
d.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)实验中准确称取8.0 g样品三份,进行三次测定,测得生成BaCO3平均质量为1.97 g。则样品中碳酸钙的质量分数为______ 。
已知:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中的其它成分与NaOH和盐酸均不反应。
I.摩擦剂中氢氧化铝的定性检验。取适量牙膏样品于烧杯中,加水充分搅拌后过滤,滤渣中加入过量NaOH溶液,过滤,向滤液中通入过量CO2有白色沉淀生成。
(1)在上述操作中,需要用到图中的实验仪器有

(2)氢氧化铝与NaOH溶液反应的离子方程式为
Ⅱ.牙膏样品中碳酸钙的定量测定。利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。

依据实验过程回答下列问题:
(3)装置A中发生反应的离子方程式为
(4)下列各项措施中,能提高测定准确度的是
a.把盐酸换成不具有挥发性的硫酸
b.在A~B之间增添盛有浓硫酸的干燥装置
c.滴加盐酸不宜过快
d.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)实验中准确称取8.0 g样品三份,进行三次测定,测得生成BaCO3平均质量为1.97 g。则样品中碳酸钙的质量分数为
您最近一年使用:0次
2020-12-27更新
|
552次组卷
|
5卷引用:四川省邻水实验学校2021-2022学年高三上学期第三阶段考试理综化学试题
四川省邻水实验学校2021-2022学年高三上学期第三阶段考试理综化学试题四川省乐山市2021届高三12月第一次调研考试理综化学试题广西桂林市第十八中学2021届高三上学期第八次月考理科综合化学试题(已下线)大题04 无机定量与探究实验-【考前抓大题】备战2021年高考化学(全国通用)四川省泸县第一中学2023-2024学年高三上学期10月月考理综化学试题
名校
5 . 某血液化验单中,高密度酯蛋白胆固醇的含量为 ,该体检指标所采用的物理量是
,该体检指标所采用的物理量是
 ,该体检指标所采用的物理量是
,该体检指标所采用的物理量是| A.物质的量浓度 | B.摩尔质量 | C.质量分数 | D.溶解度 |
您最近一年使用:0次
2020-03-10更新
|
72次组卷
|
2卷引用:四川省广安代市中学校2020-2021学年高一下学期入学考试化学试题
名校
解题方法
6 . 铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:
【氯化铁】熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
【氯化亚铁】熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用下图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:

(1)在装置A中,用KMnO4与浓盐酸反应制取氯气,反应的离子方程式为_________ 。仪器D的名称是__________________ 。
(2)D中装的药品是碱石灰,其作用是__________________________ 。
(3)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有FeCl2,可用下列试剂中的_____ (只能选取一种试剂,填序号)进行检测,实验现象是__________________________________ 。
①H2O2溶液 ②KI-淀粉溶液 ③KSCN溶液 ④酸性KMnO4溶液
(4)定量分析。取装置C中的产物,按以下步骤进行测定:①称取4.60g产品溶于过量的稀盐酸中;②加入足量H2O2溶液;③再加入足量NaOH溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。则该样品中铁元素的质量分数为_______ %(结果精确到小数点后两位)。
(5)由(4)定量分析数据得出结论,并提出改进措施。
①用题目所给的装置制得的产物中,铁元素含量______ (填“相等”、“偏高”或“偏低”),说明含有FeCl2杂质。
②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是_________ 。
【氯化铁】熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
【氯化亚铁】熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用下图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:

(1)在装置A中,用KMnO4与浓盐酸反应制取氯气,反应的离子方程式为
(2)D中装的药品是碱石灰,其作用是
(3)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有FeCl2,可用下列试剂中的
①H2O2溶液 ②KI-淀粉溶液 ③KSCN溶液 ④酸性KMnO4溶液
(4)定量分析。取装置C中的产物,按以下步骤进行测定:①称取4.60g产品溶于过量的稀盐酸中;②加入足量H2O2溶液;③再加入足量NaOH溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。则该样品中铁元素的质量分数为
(5)由(4)定量分析数据得出结论,并提出改进措施。
①用题目所给的装置制得的产物中,铁元素含量
②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是
您最近一年使用:0次
2019-01-07更新
|
667次组卷
|
4卷引用:四川省广安友谊中学2018-2019学年高一上学期期末模拟化学试题
解题方法
7 . 茶叶中铁元素的含量测定可经过以下步骤完成,按要求回答下列问题:
(1)写出上述番号的仪器名称:②_________ ;⑥________ ;⑧无色______ 口、________ 塞试剂瓶;⑩____________ 。
(2)用_______________ (填名称)准确称量a.0克茶叶灼烧灰化后,滴加浓硝酸溶解并加蒸馏水稀释,选用________ ;
(3)用⑧中的试剂沉淀滤液中的Fe3+,证明沉淀完全的操作是:取_______ 于__________ (填名称)中,继续加入____________ ,若___________ ,则Fe3+沉淀完全。
(4)将沉淀洗涤后,将沉淀灼烧至恒重,称量灼烧后固体为b.0克,则茶叶中铁元素的质量分数为:_____________ 。
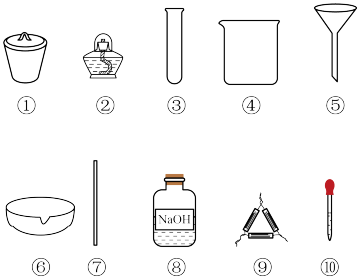
(1)写出上述番号的仪器名称:②
(2)用
(3)用⑧中的试剂沉淀滤液中的Fe3+,证明沉淀完全的操作是:取
(4)将沉淀洗涤后,将沉淀灼烧至恒重,称量灼烧后固体为b.0克,则茶叶中铁元素的质量分数为:
您最近一年使用:0次
名校
解题方法
8 . 化学兴趣小组的同学为测定 和
和 混合物中
混合物中 的质量分数,进行了如图实验。
的质量分数,进行了如图实验。
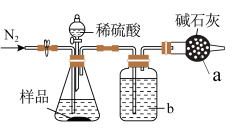
Ⅰ、甲同学取一定质量(xg)的样品,用上图示装置测定 的质量,反应前先打开弹簧夹,通入一段时间的
的质量,反应前先打开弹簧夹,通入一段时间的 ,然后关闭弹簧夹,接上总质量为mg的干燥管,再打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗的活塞,打开弹簧夹,再通入一段时间的
,然后关闭弹簧夹,接上总质量为mg的干燥管,再打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗的活塞,打开弹簧夹,再通入一段时间的 然后取下干燥管称得其质量为ng。
然后取下干燥管称得其质量为ng。
(1)仪器a的名称是_____ ,洗气瓶b中盛放的液体是_____ 。(写名称)
(2)锥形瓶中发生的反应的化学方程式为_____ 。
(3)如果没有第一次通入 ,那么测量的结果会
,那么测量的结果会_____ (填“偏大”“偏小”或“不变”),第二入次通入 的作用是
的作用是_____ 。
(4)该实验设计不足之处_____ 。
Ⅱ、乙同学用图中所示方法和步骤进行实验:
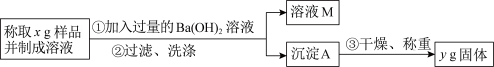
(5)乙同学测得样品中 的质量分数为
的质量分数为_____ 。
 和
和 混合物中
混合物中 的质量分数,进行了如图实验。
的质量分数,进行了如图实验。
Ⅰ、甲同学取一定质量(xg)的样品,用上图示装置测定
 的质量,反应前先打开弹簧夹,通入一段时间的
的质量,反应前先打开弹簧夹,通入一段时间的 ,然后关闭弹簧夹,接上总质量为mg的干燥管,再打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗的活塞,打开弹簧夹,再通入一段时间的
,然后关闭弹簧夹,接上总质量为mg的干燥管,再打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗的活塞,打开弹簧夹,再通入一段时间的 然后取下干燥管称得其质量为ng。
然后取下干燥管称得其质量为ng。(1)仪器a的名称是
(2)锥形瓶中发生的反应的化学方程式为
(3)如果没有第一次通入
 ,那么测量的结果会
,那么测量的结果会 的作用是
的作用是(4)该实验设计不足之处
Ⅱ、乙同学用图中所示方法和步骤进行实验:
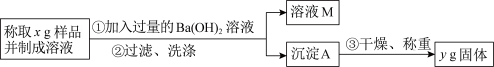
(5)乙同学测得样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2023-12-18更新
|
56次组卷
|
3卷引用:四川省广安市岳池中学2023-2024学年高一上学期期中考试化学试题
名校
解题方法
9 . “84”消毒液是一种以NaClO为有效成分的高效消毒剂,在新冠肺炎防治中被广泛用于宾馆、旅游、医院、家庭等的卫生消毒。某“84”消毒液瓶体部分标签如图所示,回答下列问题:
(1)工业上常用氯气与烧碱溶液在常温下制取“84”消毒液,写出该反应的化学方程式________ 。
(2)曾有报道,在清洗卫生间时,因混合使用“洁厕灵”(主要成分是稀盐酸)与“84”消毒液而发生氯气中毒事件。写出该反应的离子方程式___________ 。
(3)该“84”消毒液中NaClO的物质的量浓度约为___________ mol/L。(保留三位有效数字)。
(4)有同学参阅此“84消毒液”的配方,欲用NaClO固体配制480mL与市售物质的量浓度相同的“84消毒液”。
①配制该溶液需要的仪器有:托盘天平、量筒、烧杯、玻璃棒、胶头滴管,其中还缺少的玻璃仪器有___________ 。
②下列主要操作步骤的正确顺序是___________ (填字母)。
A.称取一定质量的NaClO固体于烧杯中,用适量蒸馏水溶解;
B.加水至液面离容量瓶刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
C.待恢复至室温后,将溶液转移到容量瓶中;
D.盖好瓶塞,反复上下颠倒,摇匀;
E.用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
③若实验遇下列情况,导致所配溶液的物质的量浓度偏低的是___________ (填字母)。
A.容量瓶用蒸馏水洗净后,没烘干就直接使用
B.将溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
C.定容时俯视刻度线
D.定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水至刻度线
| 84消毒液 【有效成分】NaClO 【规格】1000mL 【质量分数】25% 【密度】  |
(2)曾有报道,在清洗卫生间时,因混合使用“洁厕灵”(主要成分是稀盐酸)与“84”消毒液而发生氯气中毒事件。写出该反应的离子方程式
(3)该“84”消毒液中NaClO的物质的量浓度约为
(4)有同学参阅此“84消毒液”的配方,欲用NaClO固体配制480mL与市售物质的量浓度相同的“84消毒液”。
①配制该溶液需要的仪器有:托盘天平、量筒、烧杯、玻璃棒、胶头滴管,其中还缺少的玻璃仪器有
②下列主要操作步骤的正确顺序是
A.称取一定质量的NaClO固体于烧杯中,用适量蒸馏水溶解;
B.加水至液面离容量瓶刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
C.待恢复至室温后,将溶液转移到容量瓶中;
D.盖好瓶塞,反复上下颠倒,摇匀;
E.用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
③若实验遇下列情况,导致所配溶液的物质的量浓度偏低的是
A.容量瓶用蒸馏水洗净后,没烘干就直接使用
B.将溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
C.定容时俯视刻度线
D.定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水至刻度线
您最近一年使用:0次
名校
10 . 下图是某盐酸试剂瓶标签上的内容,下列有关说法正确的是
| 盐酸 分子式:HCl 相对分子质量:36.5 密度:  HCl的质量分数:36.5% |
| A.HCl的摩尔质量是36.5 | B.该浓盐酸中HCl的物质的量浓度为11.8mol/L |
| C.工业制HCl的方法是将氯气与氢气混合并光照 | D.常温常压下,2.24L HCl气体的质量为3.65g |
您最近一年使用:0次
2023-11-29更新
|
371次组卷
|
3卷引用:四川省广安市华蓥中学2023-2024学年高一上学期12月月考化学试题



