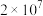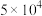名校
1 . NaDCC(结构简式为 ),是一种优良的消毒剂。常温下,NaDCC为白色粉末或颗粒,性质稳定,受热易分解,难溶于冰水,在实验室中可通过以下反应和装置(夹持仪器略去)制取。
),是一种优良的消毒剂。常温下,NaDCC为白色粉末或颗粒,性质稳定,受热易分解,难溶于冰水,在实验室中可通过以下反应和装置(夹持仪器略去)制取。
原理: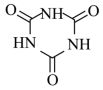 (氰尿酸)+2NaClO
(氰尿酸)+2NaClO
 +NaOH+H2O
+NaOH+H2O
实验装置:
①向D中加入10mL40%NaOH溶液,水浴控温10℃左右,搅拌。
②A中加入KMnO4固体,B中加入浓盐酸,混合使之反应,打开磁力搅拌器。
③D中pH降至8左右时,向其中加入一定量氰尿酸,保持10℃左右,边搅拌边持续通入A中产生的气体,至D中有较多晶体析出,停止反应;
④将D中的混合物用冰水浴冷却,过滤,洗涤,低温晾干得到NaDCC晶体。
Ⅱ.NaDCC有效氯含量测定:
⑤用250mL碘量瓶称取0.2000gNaDCC晶体样品,加蒸馏水100mL,摇动至样品完全溶解,加适量的碘化钾和稀硫酸,避光放置5min。再用少量水冲洗碘量瓶瓶塞和瓶内壁。
⑥用滴定管快速滴入0.2000
 Na2S2O3溶液至浅黄色时,加2滴指示剂后,继续滴定至终点,记录消耗Na2S2O3溶液的体积,重复三次,平均消耗Na2S2O3溶液16.76mL。
Na2S2O3溶液至浅黄色时,加2滴指示剂后,继续滴定至终点,记录消耗Na2S2O3溶液的体积,重复三次,平均消耗Na2S2O3溶液16.76mL。⑦完成一次空白试验,消耗Na2S2O3溶液0.16mL。
已知:
 ;样品有效氯=
;样品有效氯=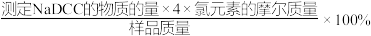 。
。请回答下列问题:
(1)仪器B的名称是
(2)若步骤②中通入气体过快,仪器D中反应热量未及时散失,可生成较多NaClO3副产物,该副反应的离子方程式为
(3)步骤④中洗涤的具体操作是
(4)已知NaDCC在酸性环境中还原得到氰尿酸和氯化物,写出步骤⑤中样品加入适量的碘化钾和稀硫酸的离子反应方程式
(5)步骤⑥中使用的最佳指示剂是
(6)计算得样品有效氯为
您最近一年使用:0次
名校
解题方法
2 . 如图为元素周期表的一部分,请参照a~h在表中的位置,回答下列问题:
(1)g在周期表中的位置是___________ 。
(2)元素d、g、h形成的简单离子中,离子半径最大的是___________ 。(填离子符号)
(3)元素c和元素f形成的化合物的化学式为___________ ,化学键为___________ 。
(4)碲(52Te)的某化合物是常用的VCR光盘记录材料之一,可在激光照射下发生化学或物理的性能改变而记录、储存信号。已知Te与S元素同主族。
①碲及其化合物可能具有的性质为___________ (填标号)。
A.单质Te在常温下是固体
B.H2Te比H2O稳定
C.H2TeO4的酸性比H2SO4的弱
D.Cl2通入H2Te溶液中不发生反应
E.Te元素位于周期表中第六周期
②TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。写出TeO2与过量NaOH溶液反应的离子方程式___________ 。
③工业上,把SO2通入TeCl4溶液中,可得到Te,该反应的化学方程式是___________ 。
| a | |||||||||
| b | c | d | |||||||
| e | f | g | h |
(2)元素d、g、h形成的简单离子中,离子半径最大的是
(3)元素c和元素f形成的化合物的化学式为
(4)碲(52Te)的某化合物是常用的VCR光盘记录材料之一,可在激光照射下发生化学或物理的性能改变而记录、储存信号。已知Te与S元素同主族。
①碲及其化合物可能具有的性质为
A.单质Te在常温下是固体
B.H2Te比H2O稳定
C.H2TeO4的酸性比H2SO4的弱
D.Cl2通入H2Te溶液中不发生反应
E.Te元素位于周期表中第六周期
②TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。写出TeO2与过量NaOH溶液反应的离子方程式
③工业上,把SO2通入TeCl4溶液中,可得到Te,该反应的化学方程式是
您最近一年使用:0次
名校
3 . D为芳香族化合物,有机物 可由
可由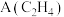 按如图路线合成:
按如图路线合成: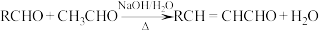 ;
;
ii.同一个碳原子上连有两个羟基的有机物不稳定,易脱水形成羰基。
下列有关说法错误的是
 可由
可由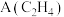 按如图路线合成:
按如图路线合成: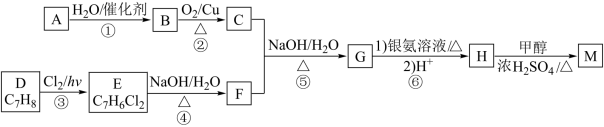
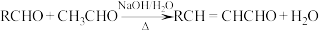 ;
;ii.同一个碳原子上连有两个羟基的有机物不稳定,易脱水形成羰基。
下列有关说法错误的是
| A.C、F中含有相同的官能团 | B.B能与 发生取代反应 发生取代反应 |
C.可利用酸性高锰酸钾溶液鉴别 和 和 | D.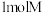 最多能和 最多能和 发生反应 发生反应 |
您最近一年使用:0次
名校
解题方法
4 . 有三种分子式均为C7H8O的芳香族化合物A、B、C,已知:A能与FeCl3溶液发生显色反应;B不能与FeCl3溶液发生显色反应但可与金属钠反应放出气体;C不能与金属钠反应。
请回答下列问题:
(1)A可能的结构有___________ 种,A与苯酚互为___________ (填“同种物质”“同分异构体”或“同系物”)。
(2)若A的核磁共振氢谱有4组峰,则A与浓溴水反应的化学方程式为___________ 。向A的钠盐溶液中通入少量CO2,发生反应的离子方程式为___________ 。
(3)B的结构简式为___________ ;在加热、Cu催化条件下,B被O2氧化的化学方程式为___________ 。
(4)C中含有官能团名称为___________ ,C分子中核磁共振氢谱峰面积之比为___________ 。
请回答下列问题:
(1)A可能的结构有
(2)若A的核磁共振氢谱有4组峰,则A与浓溴水反应的化学方程式为
(3)B的结构简式为
(4)C中含有官能团名称为
您最近一年使用:0次
名校
解题方法
5 . 室温下,通过下列实验探究 溶液的性质。
溶液的性质。
实验Ⅰ:向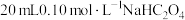 溶液中滴加
溶液中滴加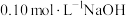 溶液。
溶液。
实验Ⅱ:向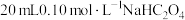 溶液中滴加
溶液中滴加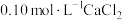 溶液。
溶液。
已知: 的电离常数
的电离常数 ,
,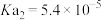 ,
,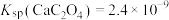 ,溶液混合后体积变化忽略不计。下列说法正确的是
,溶液混合后体积变化忽略不计。下列说法正确的是
 溶液的性质。
溶液的性质。实验Ⅰ:向
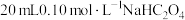 溶液中滴加
溶液中滴加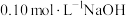 溶液。
溶液。实验Ⅱ:向
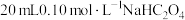 溶液中滴加
溶液中滴加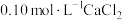 溶液。
溶液。已知:
 的电离常数
的电离常数 ,
,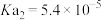 ,
,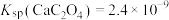 ,溶液混合后体积变化忽略不计。下列说法正确的是
,溶液混合后体积变化忽略不计。下列说法正确的是A.实验I滴定恰好反应时, |
B.实验I滴定至溶液中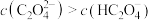 时, 时,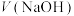 至少大于 至少大于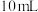 |
C.实验II初始阶段发生反应的离子方程式为 |
D.实验II最后阶段发生反应(最简整数比)的化学平衡常数表达式为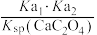 |
您最近一年使用:0次
名校
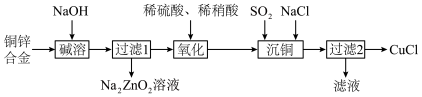
6 . NaOH在工艺提纯流程中有重要应用。一种利用废弃铜锌合金制取CuCl的流程如下图所示:
1.写出碱溶时Zn反应的化学方程式_______ 。
2.写出沉铜时反应的离子方程式_______ 。
将金属钠放入液氨中,钠沉入液氨底部。其中一部分钠与液氨反应: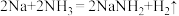 ,并缓慢放出气泡;另一部分钠与液氨溶剂化,生成氨合钠离子
,并缓慢放出气泡;另一部分钠与液氨溶剂化,生成氨合钠离子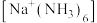 和氨合电子
和氨合电子 ,钠的溶剂化过程如图所示。
,钠的溶剂化过程如图所示。 ,则与液氨反应产生
,则与液氨反应产生 的钠和发生溶剂化作用的钠,两者物质的量之比为
的钠和发生溶剂化作用的钠,两者物质的量之比为_______ 。
1.写出碱溶时Zn反应的化学方程式
2.写出沉铜时反应的离子方程式
将金属钠放入液氨中,钠沉入液氨底部。其中一部分钠与液氨反应:
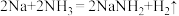 ,并缓慢放出气泡;另一部分钠与液氨溶剂化,生成氨合钠离子
,并缓慢放出气泡;另一部分钠与液氨溶剂化,生成氨合钠离子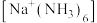 和氨合电子
和氨合电子 ,钠的溶剂化过程如图所示。
,钠的溶剂化过程如图所示。
 ,则与液氨反应产生
,则与液氨反应产生 的钠和发生溶剂化作用的钠,两者物质的量之比为
的钠和发生溶剂化作用的钠,两者物质的量之比为
您最近一年使用:0次
名校
7 . X为乙二胺,Y为乙二胺四乙酸(EDTA),均易与金属离子形成配合物。Z为乙二胺与 形成的配离子,W为EDTA阴离子与
形成的配离子,W为EDTA阴离子与 形成的整合物。下列叙述正确的是
形成的整合物。下列叙述正确的是
 形成的配离子,W为EDTA阴离子与
形成的配离子,W为EDTA阴离子与 形成的整合物。下列叙述正确的是
形成的整合物。下列叙述正确的是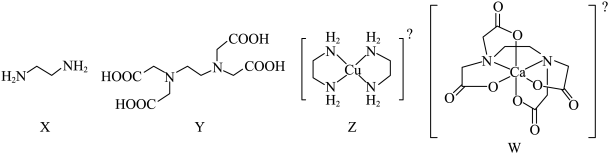
| A.X和Y中均含有手性碳原子 | B.Z和W均带两个单位的正电荷 |
| C.Z和W中金属离子的配位数均为4 | D.Z和W中均含普通共价键和配位键 |
您最近一年使用:0次
名校
解题方法
8 . 铁被誉为“工业之母”,铁也是人体必须的痕量元素之一。
(1)基态Fe原子的核外电子中有_______ 对成对电子。其重要化合物 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的结构式为
中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的结构式为_______ ,其中Fe的配位数为_______ 。
(2)血红素(含 )是吡咯(
)是吡咯(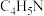 )的重要衍生物,可用于治疗缺铁性贫血。吡咯和血红素的结构如图:
)的重要衍生物,可用于治疗缺铁性贫血。吡咯和血红素的结构如图:_______ ,请描述原因:_______ 。
②已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为。1mol吡咯分子中所含的σ键总数为_______ 个(设 为阿伏伽德罗常数的值)。分子中的大π键可用
为阿伏伽德罗常数的值)。分子中的大π键可用 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为_______ 。
③CO中毒是由于CO与血红蛋白(Hb)发生配位反应: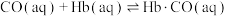 K。
K。
已知CO、 与血红素(Hb)的配位常数K如表所示。
与血红素(Hb)的配位常数K如表所示。
则反应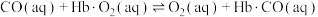 的平衡常数
的平衡常数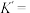
_______ 。
(3)一种由Mg和Fe组成的储氢材料的结构属立方晶系,晶胞参数为a pm,晶胞如图所示(氢未标出)。 ,B点原子的分数坐标为
,B点原子的分数坐标为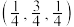 ,则C点原子的分数坐标为
,则C点原子的分数坐标为_______ 。
②该结构中,H原子以正八面体的配位模式有序分布在Fe的周围,H原子与Fe原子之间的最短距离等于晶胞参数的 ,则该晶体的化学式为
,则该晶体的化学式为_______ ,晶胞密度为_______  (列出计算式即可,设阿伏加德罗常数的值为
(列出计算式即可,设阿伏加德罗常数的值为 )。
)。
(1)基态Fe原子的核外电子中有
 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的结构式为
中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的结构式为(2)血红素(含
 )是吡咯(
)是吡咯( )的重要衍生物,可用于治疗缺铁性贫血。吡咯和血红素的结构如图:
)的重要衍生物,可用于治疗缺铁性贫血。吡咯和血红素的结构如图: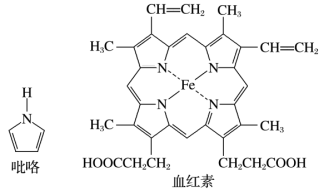
②已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为。1mol吡咯分子中所含的σ键总数为
 为阿伏伽德罗常数的值)。分子中的大π键可用
为阿伏伽德罗常数的值)。分子中的大π键可用 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为③CO中毒是由于CO与血红蛋白(Hb)发生配位反应:
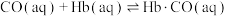 K。
K。已知CO、
 与血红素(Hb)的配位常数K如表所示。
与血红素(Hb)的配位常数K如表所示。CO |
| |
配位常数K |
|
|
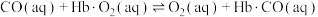 的平衡常数
的平衡常数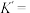
(3)一种由Mg和Fe组成的储氢材料的结构属立方晶系,晶胞参数为a pm,晶胞如图所示(氢未标出)。
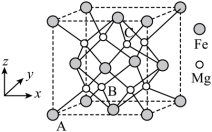
 ,B点原子的分数坐标为
,B点原子的分数坐标为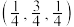 ,则C点原子的分数坐标为
,则C点原子的分数坐标为②该结构中,H原子以正八面体的配位模式有序分布在Fe的周围,H原子与Fe原子之间的最短距离等于晶胞参数的
 ,则该晶体的化学式为
,则该晶体的化学式为 (列出计算式即可,设阿伏加德罗常数的值为
(列出计算式即可,设阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
名校
9 . I. 和
和 在工农业、科研等方面应用广泛。
在工农业、科研等方面应用广泛。
(1) (氨硼烷)是具有广泛应用前景的储氢材料。
(氨硼烷)是具有广泛应用前景的储氢材料。
① 中存在配位键,提供空轨道的原子是
中存在配位键,提供空轨道的原子是___________ 。
② 的沸点高于
的沸点高于 的可能原因是
的可能原因是___________ 。
(2)工业合成 时用到含铁催化剂。
时用到含铁催化剂。
① 元素在周期表第
元素在周期表第___________ 族,基态 原子电子的空间运动状态有
原子电子的空间运动状态有___________ 种。
②从结构的角度分析 容易被氧化成
容易被氧化成 的原因是
的原因是___________ 。
(3)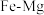 合金是储氢密度很高的材料之一,其晶胞结构如图所示。若该晶体储氢时,
合金是储氢密度很高的材料之一,其晶胞结构如图所示。若该晶体储氢时, 分子在晶胞的体心和棱的中心位置。
分子在晶胞的体心和棱的中心位置。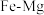 合金中,每个
合金中,每个 原子周围与它最近且相等距离的
原子周围与它最近且相等距离的 原子有
原子有___________ 个。
②要储存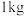
 ,至少需要
,至少需要___________ 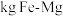 合金。
合金。
II.请回答:
(4)下列说法中正确的有___________ 。
①金属晶体的导电性、导热性均与自由电子有关
②若晶体中有阳离子,必然有阴离子
③分子晶体的熔点一定比金属晶体低
④共价键的强弱决定分子晶体熔、沸点的高低
⑤共价晶体中一定含有共价键
⑥含有离子的晶体一定是离子晶体
⑦硬度由大到小:金刚石>碳化硅>晶体硅
⑧ 和
和 晶体中,阴离子周围紧邻的阳离子数均为8
晶体中,阴离子周围紧邻的阳离子数均为8
 和
和 在工农业、科研等方面应用广泛。
在工农业、科研等方面应用广泛。(1)
 (氨硼烷)是具有广泛应用前景的储氢材料。
(氨硼烷)是具有广泛应用前景的储氢材料。①
 中存在配位键,提供空轨道的原子是
中存在配位键,提供空轨道的原子是②
 的沸点高于
的沸点高于 的可能原因是
的可能原因是(2)工业合成
 时用到含铁催化剂。
时用到含铁催化剂。①
 元素在周期表第
元素在周期表第 原子电子的空间运动状态有
原子电子的空间运动状态有②从结构的角度分析
 容易被氧化成
容易被氧化成 的原因是
的原因是(3)
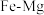 合金是储氢密度很高的材料之一,其晶胞结构如图所示。若该晶体储氢时,
合金是储氢密度很高的材料之一,其晶胞结构如图所示。若该晶体储氢时, 分子在晶胞的体心和棱的中心位置。
分子在晶胞的体心和棱的中心位置。
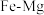 合金中,每个
合金中,每个 原子周围与它最近且相等距离的
原子周围与它最近且相等距离的 原子有
原子有②要储存
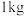
 ,至少需要
,至少需要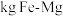 合金。
合金。II.请回答:
(4)下列说法中正确的有
①金属晶体的导电性、导热性均与自由电子有关
②若晶体中有阳离子,必然有阴离子
③分子晶体的熔点一定比金属晶体低
④共价键的强弱决定分子晶体熔、沸点的高低
⑤共价晶体中一定含有共价键
⑥含有离子的晶体一定是离子晶体
⑦硬度由大到小:金刚石>碳化硅>晶体硅
⑧
 和
和 晶体中,阴离子周围紧邻的阳离子数均为8
晶体中,阴离子周围紧邻的阳离子数均为8
您最近一年使用:0次
名校
10 . M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素,M的基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。下列说法正确的是
A.电负性: |
B.第一电离能: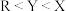 |
| C.X的氢化物的沸点低于与其组成相似的M的氢化物,是因为范德华力较小 |
D.在稀硫酸中,Z的最高价含氧酸的钾盐(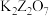 )氧化M的一种氢化物,Z被还原为 )氧化M的一种氢化物,Z被还原为 价,该反应中氧化剂和还原剂的物质的量之比为 价,该反应中氧化剂和还原剂的物质的量之比为 |
您最近一年使用:0次