名校
1 . 将一定量的锌、镁合金与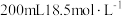 浓硫酸充分反应后,固体完全溶解,同时生成气体
浓硫酸充分反应后,固体完全溶解,同时生成气体 (生成气体全部逸出,测定条件为标准状况)。将反应后的溶液稀释到
(生成气体全部逸出,测定条件为标准状况)。将反应后的溶液稀释到 ,测得稀释后溶液中的
,测得稀释后溶液中的 浓度为
浓度为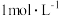 。向反应后的溶液中加入
。向反应后的溶液中加入 溶液
溶液 时,所得沉淀质量最大,其质量为
时,所得沉淀质量最大,其质量为 。下列叙述中错误的是
。下列叙述中错误的是
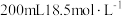 浓硫酸充分反应后,固体完全溶解,同时生成气体
浓硫酸充分反应后,固体完全溶解,同时生成气体 (生成气体全部逸出,测定条件为标准状况)。将反应后的溶液稀释到
(生成气体全部逸出,测定条件为标准状况)。将反应后的溶液稀释到 ,测得稀释后溶液中的
,测得稀释后溶液中的 浓度为
浓度为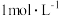 。向反应后的溶液中加入
。向反应后的溶液中加入 溶液
溶液 时,所得沉淀质量最大,其质量为
时,所得沉淀质量最大,其质量为 。下列叙述中错误的是
。下列叙述中错误的是A.气体A中 和 和 的体积比为 的体积比为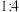 | B.该合金中锌、镁的物质的量之比为 |
C.该实验所有 的浓度是 的浓度是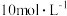 | D.沉淀质量最大时,溶液中所含溶质的质量为 |
您最近一年使用:0次
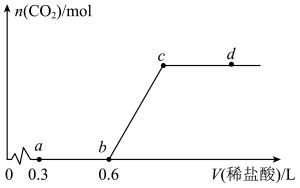
2 . 向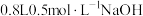 溶液中通入一定体积的
溶液中通入一定体积的 使其充分反应,再向所得溶液中逐滴滴加
使其充分反应,再向所得溶液中逐滴滴加 的稀盐酸,测得产生
的稀盐酸,测得产生 的物质的量随加入盐酸的体积变化如图所示(不考虑
的物质的量随加入盐酸的体积变化如图所示(不考虑 的溶解)。下列说法正确的是
的溶解)。下列说法正确的是
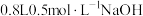 溶液中通入一定体积的
溶液中通入一定体积的 使其充分反应,再向所得溶液中逐滴滴加
使其充分反应,再向所得溶液中逐滴滴加 的稀盐酸,测得产生
的稀盐酸,测得产生 的物质的量随加入盐酸的体积变化如图所示(不考虑
的物质的量随加入盐酸的体积变化如图所示(不考虑 的溶解)。下列说法正确的是
的溶解)。下列说法正确的是
A.根据题中所给信息,可以求得图中的c点坐标为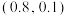 |
| B.由0到a的过程中,溶质的总物质的量持续增大 |
| C.由a到b的过程中,发生了1个化学反应 |
D.若减少初始 的通入量,则c点横纵坐标都将减小 的通入量,则c点横纵坐标都将减小 |
您最近一年使用:0次
名校
解题方法
3 . 下列离子方程式正确的是
| A.少量SO2通入Ca(ClO)2溶液:Ca2++ClO-+SO2+H2O=CaSO4↓+Cl-+2H+ |
B.FeI2溶于过量的硝酸溶液中:Fe2++4H++NO =Fe3++NO↑+2H2O =Fe3++NO↑+2H2O |
C.用热NaOH溶液洗涤试管内壁的硫黄:3S+6OH- SO SO +2S2-+3H2O +2S2-+3H2O |
D.Fe与稀硝酸反应,当n(Fe)﹕n(HNO3)=1﹕3时,3Fe+8H++2NO =3Fe2++2NO↑+4H2O =3Fe2++2NO↑+4H2O |
您最近一年使用:0次
2023-04-21更新
|
1499次组卷
|
5卷引用:辽宁省实验中学2023-2024学年高一下学期4月月考测试化学试卷
名校
解题方法
4 . 溶液X中含有下表离子中的某5种,且其浓度均为 (不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是
(不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是
 (不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是
(不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是阳离子 | 阴离子 |
|
|
| A.X溶液中可能含3种阳离子、2种阴离子 | B.X溶液中不可能含有 或 或 |
C.生成的无色气体是 | D.根据电荷守恒,原溶液中一定含 |
您最近一年使用:0次
2023-04-20更新
|
1309次组卷
|
9卷引用:辽宁省沈阳市铁路实验中学2022-2023学年高一下学期第一次月考化学试题
辽宁省沈阳市铁路实验中学2022-2023学年高一下学期第一次月考化学试题辽宁省大连市金普新区省示范性高中2022届高三上学期第一次联合考试化学试题(已下线)上海市华东师范大学第二附属中学2021-2022学年高一下学期3月阶段反馈化学试题河北省石家庄市第二中学2023-2024高一上学期第一次诊断测评化学试题上海市育才中学2022-2023学年高三上学期10月月考化学试题黑龙江省鹤岗市绥滨县第一中学2021-2022学年高三上学期期中考试化学试题黑龙江省哈尔滨师范大学附属中学2022-2023学年高三下学期开学考试化学试题黑龙江省哈尔滨师范大学附属中学2024届高三上学期开学考试化学试题河北省秦皇岛市昌黎第一中学2023届高三第一次调研考试化学试题
名校
解题方法
5 . 已知Na2SO3 +S= Na2S2O3,实验室用下述方法制备 固体:①铜和浓硫酸加热产生
固体:①铜和浓硫酸加热产生 ;②将
;②将 通入含
通入含 和
和 的混合溶液,溶液先变浑浊,后逐渐澄清,反应结束;③将溶液经浓缩结晶、过滤洗涤等操作得到
的混合溶液,溶液先变浑浊,后逐渐澄清,反应结束;③将溶液经浓缩结晶、过滤洗涤等操作得到 产品。下列说法错误的是
产品。下列说法错误的是
 固体:①铜和浓硫酸加热产生
固体:①铜和浓硫酸加热产生 ;②将
;②将 通入含
通入含 和
和 的混合溶液,溶液先变浑浊,后逐渐澄清,反应结束;③将溶液经浓缩结晶、过滤洗涤等操作得到
的混合溶液,溶液先变浑浊,后逐渐澄清,反应结束;③将溶液经浓缩结晶、过滤洗涤等操作得到 产品。下列说法错误的是
产品。下列说法错误的是A.①中消耗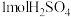 转移 转移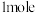 |
| B.②中溶液先变浑浊的原因:2Na2S+3SO2= 2Na2SO3+3S↓ |
C.为提高产品的纯度,混合液中 的最佳比例为1∶2 的最佳比例为1∶2 |
D.用适量 溶液吸收②中逸出的 溶液吸收②中逸出的 、 、 气体,吸收液可直接返回到步骤② 气体,吸收液可直接返回到步骤② |
您最近一年使用:0次
2023-01-14更新
|
3003次组卷
|
9卷引用:辽宁省实验中学2023-2024学年高一下学期4月月考测试化学试卷
名校
解题方法
6 . 把NaOH、 、
、 三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如下图所示。下列说法错误的是
三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如下图所示。下列说法错误的是
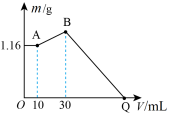
 、
、 三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如下图所示。下列说法错误的是
三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如下图所示。下列说法错误的是
| A.三种固体溶于足量水反应后有NaOH剩余 |
B.B点的沉淀物为 和 和 |
| C.原混合物中NaOH的质量是5.20g |
| D.Q点HCl溶液加入量是120mL |
您最近一年使用:0次
2023-01-04更新
|
1405次组卷
|
2卷引用:辽宁省沈阳市第一二0中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
7 .  可消除NO的污染,反应方程式为:
可消除NO的污染,反应方程式为: 。现有NO与
。现有NO与 的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是
的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是
 可消除NO的污染,反应方程式为:
可消除NO的污染,反应方程式为: 。现有NO与
。现有NO与 的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是
的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是| A.氧化产物与还原产物物质的量之比为3:2 |
B.反应中有4.48 L  被氧化 被氧化 |
C.转移电子数为1.2 |
D.原混合气体中NO、 物质的量之比为3:7或4:1 物质的量之比为3:7或4:1 |
您最近一年使用:0次
2022-12-07更新
|
1511次组卷
|
4卷引用:辽宁省六校协作体2023-2024学年高一上学期第三次考试化学试题
名校
解题方法
8 . 已知:将Cl2通入适量NaOH溶液中,反应会放热,当温度升高后会发生如下反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O。则Cl2通入NaOH溶液的产物中可能有NaCl、NaClO、NaClO3中的两种或三种,且 的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
 的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是| A.与碱的反应中,Cl2既是氧化剂又是还原剂 |
| B.参加反应的Cl2物质的量为0.5a mol |
C.若某温度下,反应后 =6,则溶液中 =6,则溶液中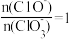 |
D.改变温度,反应中转移电子的物质的量可能为 mol mol |
您最近一年使用:0次
2022-10-24更新
|
2107次组卷
|
12卷引用:辽宁省沈阳市五校协作体2022-2023学年高一上学期期末考试化学试题
辽宁省沈阳市五校协作体2022-2023学年高一上学期期末考试化学试题 江苏省无锡市锡山高级中学2021-2022学年高一上学期期中考试化学试题山东省实验中学2022-2023学年高一上学期11月期中考试化学试题甘肃省酒泉市玉门油田第一中学2022-2023学年高一上学期期中考试化学(A卷)试题北京市第八中学2022-2023学年高一上学期12月月考化学试题陕西省榆林中学2022-2023学年高一上学期期末考试化学试题浙江省宁波市北仑中学2022-2023学年高一下学期期初返校考试(选考)化学试题江苏省苏州中学2022-2023学年高一下学期开学考试化学试题陕西省安康市2022-2023学年高一下学期开学摸底考试化学试题山东省淄博市部分学校联考2022-2023学年高一下学期4月期中考试化学试题新疆塔城地区第一高级中学2022-2023学年高一下学期开学考试化学试题(已下线)专题03 氧化还原反应-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)
解题方法
9 . 回答下列问题
(1)一定温度下,在密闭容器中充入1molN2和3molH2发生反应:N2(g)+3H2(g)⇌2NH3(g) ΔH<0。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的 ,则N2的转化率a1=
,则N2的转化率a1=_______ ;
(2)对于反应2NO(g)+O2(g)⇌2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。

①比较P1、P2的大小关系:P1_______ P2(填“>”、“<”或“=”)。
②该反应的平衡常数K的表达式为_______ ,随温度升高,该反应平衡常数变化的趋势是_______ 。(填“增大”、“减小”或“不变”)。
③下列措施中能够同时满足增大反应速率和提高NO转化率的是_______ 。(填写相应字母)
A.使用高效催化剂
B.保持容器体积不变加入惰性气体
C.保持容器体积不变加入O2
D.降低温度
E.压缩容器体积
(3)已知同温同压下,下列反应的焓变和平衡常数分别表示为
①2SO2(g)+O2(g)⇌2SO3(g) ΔH1=-197kJ·mol-1 K1=a
②2NO(g)+O2(g)⇌2NO2(g) ΔH2=-144kJ·mol-1 K2=b
③NO2(g)+SO2(g)⇌SO3(g)+NO(g) ΔH3=mkJ·mol-1 K3=c
则m的数值为_______ ,c与a、b之间的关系为_______ 。
(4)目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。在体积为2L的密闭容器中,充入1molCO2和3molH2,在相同温度、容积不变的条件下,能说明该反应已达平衡状态的是_______ (填序号)。
A.CO2、H2、CH3OH、H2O的浓度均不再变化
B.v生成(CH3OH)=v消耗(CO2)
C.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶1∶1∶1
D.容器中混合气体的密度保持不变
E.H2的消耗速率与CH3OH的消耗速率之比为3∶1
(1)一定温度下,在密闭容器中充入1molN2和3molH2发生反应:N2(g)+3H2(g)⇌2NH3(g) ΔH<0。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的
 ,则N2的转化率a1=
,则N2的转化率a1=(2)对于反应2NO(g)+O2(g)⇌2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。

①比较P1、P2的大小关系:P1
②该反应的平衡常数K的表达式为
③下列措施中能够同时满足增大反应速率和提高NO转化率的是
A.使用高效催化剂
B.保持容器体积不变加入惰性气体
C.保持容器体积不变加入O2
D.降低温度
E.压缩容器体积
(3)已知同温同压下,下列反应的焓变和平衡常数分别表示为
①2SO2(g)+O2(g)⇌2SO3(g) ΔH1=-197kJ·mol-1 K1=a
②2NO(g)+O2(g)⇌2NO2(g) ΔH2=-144kJ·mol-1 K2=b
③NO2(g)+SO2(g)⇌SO3(g)+NO(g) ΔH3=mkJ·mol-1 K3=c
则m的数值为
(4)目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。在体积为2L的密闭容器中,充入1molCO2和3molH2,在相同温度、容积不变的条件下,能说明该反应已达平衡状态的是
A.CO2、H2、CH3OH、H2O的浓度均不再变化
B.v生成(CH3OH)=v消耗(CO2)
C.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶1∶1∶1
D.容器中混合气体的密度保持不变
E.H2的消耗速率与CH3OH的消耗速率之比为3∶1
您最近一年使用:0次
名校
解题方法
10 . 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等。请回答下列问题:

(1)Q元素在元素周期表中的位置为_______ 。
(2)Q元素的非金属性(原子的得电子能力)弱于W元素的非金属性,能证明这一事实的化学方程式为_______ 。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_______ 。
(4)R、T、W元素形成的简单离子的半径由小到大的顺序为_______ (用离子符号表示)。
(5)R有多种氧化物,其中甲的相对分子质量最小。一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是_______ 。
(6)W的单质能溶于Q和W形成的一种化合物中,用电子式表示该化合物的形成过程:_______ 。

(1)Q元素在元素周期表中的位置为
(2)Q元素的非金属性(原子的得电子能力)弱于W元素的非金属性,能证明这一事实的化学方程式为
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为
(4)R、T、W元素形成的简单离子的半径由小到大的顺序为
(5)R有多种氧化物,其中甲的相对分子质量最小。一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是
(6)W的单质能溶于Q和W形成的一种化合物中,用电子式表示该化合物的形成过程:
您最近一年使用:0次

 、
、 、
、 、
、 、
、
 、
、 、
、 、
、


