名校
1 . 沙格列丁(J)是二肽基肽酶-Ⅳ抑制剂,可用于2型糖尿病的治疗,一种以金刚甲酸(A)为原料制备沙格列丁的流程如下:
(1)A的分子式为_______ 。
(2)B→C的化学方程式为_______ ,该反应的类型为_______ 。
(3)C→D中,实现了官能团由氰基(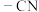 )变为
)变为_______ (填官能团的名称)。
(4)G→I中,还有HCl生成,H的结构简式为_______ 。
(5)化合物A的同分异构体满足下列条件的有_______ 种(不考虑立体异构,填字母);
a.苯环上有三个取代基,且其中两个酚羟基处于间位;b.分子中含有3个甲基。
A.7 B.8 C.9 D.10
其中核磁共振氢谱有5组峰,且峰面积之比为9∶2∶2∶2∶1的结构简式为_______ 。(任写一种)。

(1)A的分子式为
(2)B→C的化学方程式为
(3)C→D中,实现了官能团由氰基(
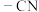 )变为
)变为(4)G→I中,还有HCl生成,H的结构简式为
(5)化合物A的同分异构体满足下列条件的有
a.苯环上有三个取代基,且其中两个酚羟基处于间位;b.分子中含有3个甲基。
A.7 B.8 C.9 D.10
其中核磁共振氢谱有5组峰,且峰面积之比为9∶2∶2∶2∶1的结构简式为
您最近一年使用:0次
2023-07-12更新
|
330次组卷
|
4卷引用:辽宁省朝阳市2022-2023学年高二下学期期末联考化学试题
辽宁省朝阳市2022-2023学年高二下学期期末联考化学试题辽宁省凌源市2022-2023学年高二下学期期末联考化学试题(已下线)综合02 有机化学基础压轴40题-备战2023-2024学年高二化学下学期期末真题分类汇编(辽宁、黑龙江、吉林专用)重庆市万州第二高级中学2023-2024学年高三上学期8月月考化学试题
名校
2 . 25 °C时,1L 0.1mol·L-1的某二元酸H2RO3溶液中各含R物种的pc-pOH关系如图所示。图中pc表示各含R物种的浓度负对数[pc=-lgc,pOH= -lgc(OH)]。下列说法正确的是
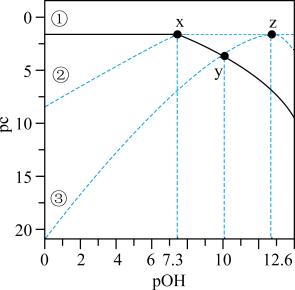

A.曲线③表示pc(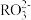 )随pOH的变化 )随pOH的变化 |
B.y点的溶液中:c(H2RO3)+2c(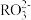 )=0.1mol·L-1 )=0.1mol·L-1 |
| C.H2RO3的Ka1=1.0×10-6.7 |
D.2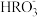  H2RO3+ H2RO3+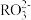 的平衡常数K=1.0×10-5.3 的平衡常数K=1.0×10-5.3 |
您最近一年使用:0次
2023-05-21更新
|
1035次组卷
|
4卷引用:辽宁省实验中学2023-2024学年高二上学期期中阶段测试化学试题
辽宁省实验中学2023-2024学年高二上学期期中阶段测试化学试题安徽省马鞍山市2023届高三下学期第三次教学质量监测理科综合化学试题(已下线)专题09 水溶液中的离子平衡-2023年高考化学真题题源解密(新高考专用)(已下线)专题08 反应速率与化学平衡-2023年高考化学真题题源解密(新高考专用)
名校
解题方法
3 . 室温下,通过下列实验探究Na2SO3、NaHSO3溶液的性质。下列说法错误的是
| 实验 | 实验操作和现象 |
| ① | 用pH试纸测定0.1 mol/L Na2SO3溶液的pH,测得pH约为10 |
| ② | 向0.1 mol/L Na2SO3溶液中通入少量SO2,测得溶液pH约为8 |
| ③ | 用pH试纸测定0.1 mol/L NaHSO3溶液的pH,测得pH约为5 |
| ④ | 向0.1 mol/L Na2SO3溶液中加入等体积等浓度的BaCl2溶液,产生白色沉淀 |
A.0.1 mol/L的Na2SO3溶液中存在:c(OH-)>c(H2SO3)+c( ) ) |
B.实验②得到的溶液中存在: c(Na+)>c(H2SO3)+c( )+c( )+c( ) ) |
| C.实验③可以得出:Ka1(H2SO3)Ka2(H2SO3)>Kw |
| D.实验④中可推测Ksp(BaSO3)>2.5×10-3 |
您最近一年使用:0次
4 . 常温下,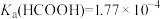 ,
, ,
,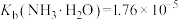 ,下列说法正确的是
,下列说法正确的是
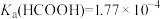 ,
, ,
,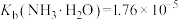 ,下列说法正确的是
,下列说法正确的是A.浓度均为 的 的 和 和 溶液中阳离子的物质的量浓度之和:前者小于后者 溶液中阳离子的物质的量浓度之和:前者小于后者 |
B.用相同浓度的 溶液分别滴定等体积 溶液分别滴定等体积 均为3的 均为3的 和 和 溶液至终点,消耗 溶液至终点,消耗 溶液的体积相等 溶液的体积相等 |
C.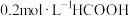 溶液与 溶液与 溶液等体积混合后的溶液中: 溶液等体积混合后的溶液中: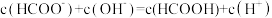 |
D.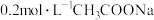 与 与 盐酸等体积混合后的溶液 盐酸等体积混合后的溶液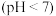 中: 中: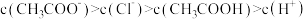 |
您最近一年使用:0次
2022-12-28更新
|
675次组卷
|
3卷引用:辽宁省大连育明高级中学2023-2024学年高二上学期期中考试化学试卷
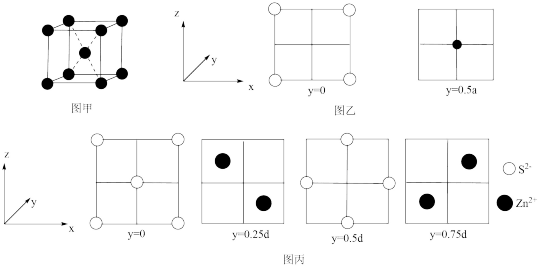
5 . 已知图甲为金属钠的晶胞,晶胞边长为 ,其晶胞截面如图乙所示。图丙为ZnS晶胞截面,已知ZnS属立方晶体,假设晶胞边长为
,其晶胞截面如图乙所示。图丙为ZnS晶胞截面,已知ZnS属立方晶体,假设晶胞边长为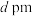 。下列关于ZnS晶胞的描述错误的是
。下列关于ZnS晶胞的描述错误的是
 ,其晶胞截面如图乙所示。图丙为ZnS晶胞截面,已知ZnS属立方晶体,假设晶胞边长为
,其晶胞截面如图乙所示。图丙为ZnS晶胞截面,已知ZnS属立方晶体,假设晶胞边长为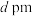 。下列关于ZnS晶胞的描述错误的是
。下列关于ZnS晶胞的描述错误的是
A.每个晶胞中含有的 数目为4 数目为4 |
B.与 距离最近且相等的 距离最近且相等的 有8个 有8个 |
C.该晶胞中两个距离最近的 和 和 的核间距的计算表达式为 的核间距的计算表达式为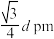 |
D.ZnS晶体的密度为 ( ( 表示阿伏加德罗常数) 表示阿伏加德罗常数) |
您最近一年使用:0次
2022-12-16更新
|
1134次组卷
|
3卷引用:辽宁省大连市第八中学2022-2023学年高二下学期期中考试化学试题
6 . 绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了 的深度利用和
的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:
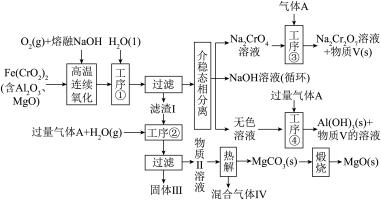
回答下列问题:
(1)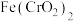 中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式:
中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式:_________ 。
(2)滤渣Ⅰ的主要成分是_________ (填化学式)。工序③中发生反应的离子方程式为_________ 。
(3)热解工序产生的混合气体Ⅳ最适宜返回工序_________ (填“①”或“②”或“③”或“④”)参与内循环。
(4) 难溶于水,常温时
难溶于水,常温时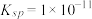 ;
; 难溶于水,能溶于强酸、强碱。
难溶于水,能溶于强酸、强碱。
①欲使 的
的 溶液中的
溶液中的 沉淀完全(离子浓度小于
沉淀完全(离子浓度小于 ),需加入等体积浓度至少为
),需加入等体积浓度至少为_________  的
的 溶液。
溶液。
②20℃时,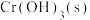 在不同浓度的NaOH溶液中的最大溶解量(
在不同浓度的NaOH溶液中的最大溶解量( )如图1所示。下列叙述正确
)如图1所示。下列叙述正确_________ 的是(填字母)。
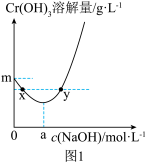
A.NaOH浓度越小,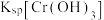 越小
越小
B.x、y两点对应的溶液中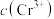 不相等
不相等
C.当NaOH浓度小于 时,随着NaOH浓度的增大,
时,随着NaOH浓度的增大, 溶解量减小是因为
溶解量减小是因为 浓度增大使
浓度增大使 溶解平衡逆向移动
溶解平衡逆向移动
D.当NaOH浓度为 时,溶液中
时,溶液中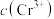 一定最小
一定最小
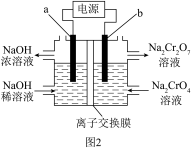
(5)工序③也可以利用电解法制 ,工作原理如下图2所示(a、b电极均为石墨)。该装置中的离子交换膜为
,工作原理如下图2所示(a、b电极均为石墨)。该装置中的离子交换膜为_________ (填离子符号)交换膜。制备 时,若电路中有4mol电子转移时,理论上右侧溶液总质量减少
时,若电路中有4mol电子转移时,理论上右侧溶液总质量减少_________ g。
 的深度利用和
的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:
回答下列问题:
(1)
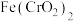 中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式:
中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式:(2)滤渣Ⅰ的主要成分是
(3)热解工序产生的混合气体Ⅳ最适宜返回工序
(4)
 难溶于水,常温时
难溶于水,常温时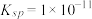 ;
; 难溶于水,能溶于强酸、强碱。
难溶于水,能溶于强酸、强碱。①欲使
 的
的 溶液中的
溶液中的 沉淀完全(离子浓度小于
沉淀完全(离子浓度小于 ),需加入等体积浓度至少为
),需加入等体积浓度至少为 的
的 溶液。
溶液。②20℃时,
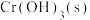 在不同浓度的NaOH溶液中的最大溶解量(
在不同浓度的NaOH溶液中的最大溶解量( )如图1所示。下列叙述正确
)如图1所示。下列叙述正确
A.NaOH浓度越小,
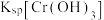 越小
越小B.x、y两点对应的溶液中
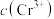 不相等
不相等C.当NaOH浓度小于
 时,随着NaOH浓度的增大,
时,随着NaOH浓度的增大, 溶解量减小是因为
溶解量减小是因为 浓度增大使
浓度增大使 溶解平衡逆向移动
溶解平衡逆向移动D.当NaOH浓度为
 时,溶液中
时,溶液中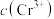 一定最小
一定最小(5)工序③也可以利用电解法制
 ,工作原理如下图2所示(a、b电极均为石墨)。该装置中的离子交换膜为
,工作原理如下图2所示(a、b电极均为石墨)。该装置中的离子交换膜为 时,若电路中有4mol电子转移时,理论上右侧溶液总质量减少
时,若电路中有4mol电子转移时,理论上右侧溶液总质量减少
您最近一年使用:0次
2022-11-30更新
|
992次组卷
|
5卷引用:辽宁省部分省级示范性高中2022-2023学年高二下学期3月测试化学试题
辽宁省部分省级示范性高中2022-2023学年高二下学期3月测试化学试题江西省临川第一中学2022-2023学年高三上学期11月教学质量检测化学试题 (已下线)河南省湘豫名校联考2022-2023学年高三上学期12月期末摸底考试变式汇编(17-21)江西省宁冈中学2022-2023学年高三上学期12月月考化学试题江西省吉安市第三中学2022-2023学年高三上学期12月月考化学试题
名校
解题方法
7 . 含氨污染物的有效去除和含碳资源的充分利用是重要研究课题。回答下列问题:
(1)利用工业尾气 与
与 反应制备新型硝化剂
反应制备新型硝化剂 ,过程中涉及以下反应:
,过程中涉及以下反应:
I.


II.


III.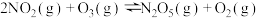


平衡常数K与温度T的函数关系为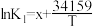 ,
, ,
,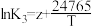 ,其中x、y、z为常数,则反应I的活化能
,其中x、y、z为常数,则反应I的活化能 (正)
(正)______  (逆)(填“>”或“<”),
(逆)(填“>”或“<”), 的数值范围是
的数值范围是______ 。(填标号)
A. B.
B. ~0 C.0~2 D.>2
~0 C.0~2 D.>2
(2) 与
与 重整是
重整是 利用的研究热点之一。该重整反应体系有以下反应:
利用的研究热点之一。该重整反应体系有以下反应:
I.

II.
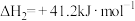
III.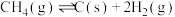
 (只在高温下自发进行)
(只在高温下自发进行)
①在一定压强和催化剂的条件下,将等物质的量的 和
和 通入重整反应器中,平衡时,
通入重整反应器中,平衡时, 、
、 的物质的量分数及转化率随温度变化的关系如图所示。平衡时
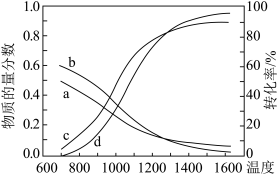
的物质的量分数及转化率随温度变化的关系如图所示。平衡时 的物质的量分数随温度变化的曲线是
的物质的量分数随温度变化的曲线是______ (填标号)。温度高于1300K后,曲线d超过曲线c的可能原因为__________________ 。
②在p MPa时,将 和
和 按物质的量之比为1∶1充入密闭容器中,分别在无催化剂和
按物质的量之比为1∶1充入密闭容器中,分别在无催化剂和 催化下反应相同时间,所得
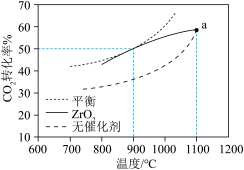
催化下反应相同时间,所得 的转化率与温度的关系如图所示。a点
的转化率与温度的关系如图所示。a点 转化率相等的原因是
转化率相等的原因是___________ 。
③设 为相对压力平衡常数,用相对分压代替浓度即可得相对压力平衡常数的表达式[气体的相对分压等于其分压(单位为kPa)除以标准压强
为相对压力平衡常数,用相对分压代替浓度即可得相对压力平衡常数的表达式[气体的相对分压等于其分压(单位为kPa)除以标准压强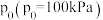 ]。某温度下反应Ⅲ的
]。某温度下反应Ⅲ的 ,向恒容密闭容器中按
,向恒容密闭容器中按 充入原料气,初始总压为150kPa,发生反应I、II、Ⅲ,体系达到平衡时
充入原料气,初始总压为150kPa,发生反应I、II、Ⅲ,体系达到平衡时 的分压为b kPa,则
的分压为b kPa,则 的平衡转化率为
的平衡转化率为______ 。(用含b的代数式表示)
(1)利用工业尾气
 与
与 反应制备新型硝化剂
反应制备新型硝化剂 ,过程中涉及以下反应:
,过程中涉及以下反应:I.



II.



III.
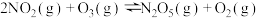


平衡常数K与温度T的函数关系为
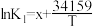 ,
, ,
,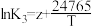 ,其中x、y、z为常数,则反应I的活化能
,其中x、y、z为常数,则反应I的活化能 (正)
(正) (逆)(填“>”或“<”),
(逆)(填“>”或“<”), 的数值范围是
的数值范围是A.
 B.
B. ~0 C.0~2 D.>2
~0 C.0~2 D.>2(2)
 与
与 重整是
重整是 利用的研究热点之一。该重整反应体系有以下反应:
利用的研究热点之一。该重整反应体系有以下反应:I.


II.

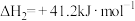
III.
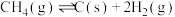
 (只在高温下自发进行)
(只在高温下自发进行)①在一定压强和催化剂的条件下,将等物质的量的
 和
和 通入重整反应器中,平衡时,
通入重整反应器中,平衡时, 、
、 的物质的量分数及转化率随温度变化的关系如图所示。平衡时
的物质的量分数及转化率随温度变化的关系如图所示。平衡时 的物质的量分数随温度变化的曲线是
的物质的量分数随温度变化的曲线是
②在p MPa时,将
 和
和 按物质的量之比为1∶1充入密闭容器中,分别在无催化剂和
按物质的量之比为1∶1充入密闭容器中,分别在无催化剂和 催化下反应相同时间,所得
催化下反应相同时间,所得 的转化率与温度的关系如图所示。a点
的转化率与温度的关系如图所示。a点 转化率相等的原因是
转化率相等的原因是
③设
 为相对压力平衡常数,用相对分压代替浓度即可得相对压力平衡常数的表达式[气体的相对分压等于其分压(单位为kPa)除以标准压强
为相对压力平衡常数,用相对分压代替浓度即可得相对压力平衡常数的表达式[气体的相对分压等于其分压(单位为kPa)除以标准压强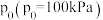 ]。某温度下反应Ⅲ的
]。某温度下反应Ⅲ的 ,向恒容密闭容器中按
,向恒容密闭容器中按 充入原料气,初始总压为150kPa,发生反应I、II、Ⅲ,体系达到平衡时
充入原料气,初始总压为150kPa,发生反应I、II、Ⅲ,体系达到平衡时 的分压为b kPa,则
的分压为b kPa,则 的平衡转化率为
的平衡转化率为
您最近一年使用:0次
2022-11-17更新
|
752次组卷
|
3卷引用:辽宁省部分省级示范性高中2022-2023学年高二下学期3月测试化学试题
解题方法
8 . 500mLKNO3和Cu(NO3)2的混合溶液中c(NO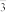 )=0.6mol•L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24L气体(标准状况下),假定电解后溶液体积仍为500mL,下列说法正确的是
)=0.6mol•L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24L气体(标准状况下),假定电解后溶液体积仍为500mL,下列说法正确的是
 )=0.6mol•L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24L气体(标准状况下),假定电解后溶液体积仍为500mL,下列说法正确的是
)=0.6mol•L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24L气体(标准状况下),假定电解后溶液体积仍为500mL,下列说法正确的是| A.原混合溶液中c(K+)为0.4mol•L-1 | B.上述电解过程中共转移0.2mol电子 |
| C.电解得到的Cu的物质的量为0.05mol | D.电解后溶液中c(H+)为0.4mol•L-1 |
您最近一年使用:0次
2022-10-27更新
|
854次组卷
|
2卷引用:辽宁省部分省级示范性高中2022-2023学年高二下学期3月测试化学试题
名校
解题方法
9 . 甲烷水蒸气催化重整是制备高纯氢的方法之一、反应如下:
反应ⅰ:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH1=+206kJ·mol-1;
CO(g)+3H2(g) ΔH1=+206kJ·mol-1;
反应ⅱ:CH4(g)+2H2O(g) CO2(g)+4H2(g) ΔH2=+165kJ·mol-1。
CO2(g)+4H2(g) ΔH2=+165kJ·mol-1。
(1)反应ⅲ:CO2(g)+H2(g) CO(g)+H2O(g)的ΔH3=
CO(g)+H2O(g)的ΔH3=___________ ;若在一定温度下的容积固定的密闭容器中进行该反应,则可以提高CO2转化率的措施为___________ ,下列说法可以证明该反应已达到平衡状态的是___________ (填字母)。
a、v正(CO2)=v正(H2)
b、容器内气体压强不再改变
c、H2的浓度不再改变
d、CO和H2O的浓度之比为1∶1
(2)对于反应ⅰ,向体积为2L的恒容密闭容器中,按 =1:1投料。
=1:1投料。
①若在恒温条件下,反应达到平衡时CH4的转化率为50%,则平衡时容器内的压强与起始压强之比为___________ (最简单整数比)。
②其他条件相同时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应相同时间,CH4的转化率随反应温度的变化如图所示。a点___________ (填“是”或“不是")化学平衡状态,CH4的转化率:c点>b点,原因是___________ 。

(3)某科研小组研究了反应ⅱ的动力学,获得其速率方程v=k·cm(CH4)·c0.5(H2O),k为速率常数(只受温度影响),m为CH4的反应级数。在某温度下进行实验,测得各组分初浓度和反应初速率如下:
CH4的反应级数m=___________ ,当实验2进行到某时刻,测得c(H2O)=0.040mol·L-1,则此时的反应速率v=___________ (已知 )。
)。
(4)甲烷水蒸气催化重整制备高纯氢只发生反应ⅰ、反应ⅱ。在恒温、恒压条件下,1molCH4(g)和1molH2O(g)反应达平衡时,CH4(g)的转化率为a,CO2(g)的物质的量为bmol,则反应ⅰ的平衡常数Kx=___________ [写出含有a、b的计算式;对于反应mA(g)+nB(g) pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx= ,x为物质的量分数]。
,x为物质的量分数]。
反应ⅰ:CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH1=+206kJ·mol-1;
CO(g)+3H2(g) ΔH1=+206kJ·mol-1;反应ⅱ:CH4(g)+2H2O(g)
 CO2(g)+4H2(g) ΔH2=+165kJ·mol-1。
CO2(g)+4H2(g) ΔH2=+165kJ·mol-1。(1)反应ⅲ:CO2(g)+H2(g)
 CO(g)+H2O(g)的ΔH3=
CO(g)+H2O(g)的ΔH3=a、v正(CO2)=v正(H2)
b、容器内气体压强不再改变
c、H2的浓度不再改变
d、CO和H2O的浓度之比为1∶1
(2)对于反应ⅰ,向体积为2L的恒容密闭容器中,按
 =1:1投料。
=1:1投料。①若在恒温条件下,反应达到平衡时CH4的转化率为50%,则平衡时容器内的压强与起始压强之比为
②其他条件相同时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应相同时间,CH4的转化率随反应温度的变化如图所示。a点

(3)某科研小组研究了反应ⅱ的动力学,获得其速率方程v=k·cm(CH4)·c0.5(H2O),k为速率常数(只受温度影响),m为CH4的反应级数。在某温度下进行实验,测得各组分初浓度和反应初速率如下:
| 实验序号 | c(H2O)/mol·L-1 | c(CH4)/mol·L-1 | v//mol·L-1·s-1 |
| 1 | 0.100 | 0.100 | 1.2×10-2 |
| 2 | 0.100 | 0.200 | 2.4×10-2 |
 )。
)。(4)甲烷水蒸气催化重整制备高纯氢只发生反应ⅰ、反应ⅱ。在恒温、恒压条件下,1molCH4(g)和1molH2O(g)反应达平衡时,CH4(g)的转化率为a,CO2(g)的物质的量为bmol,则反应ⅰ的平衡常数Kx=
 pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx= ,x为物质的量分数]。
,x为物质的量分数]。
您最近一年使用:0次
2022-10-11更新
|
442次组卷
|
5卷引用:辽宁省朝阳市凌源市实验中学2022-2023学年高二上学期9月月考化学试题
解题方法
10 . Ⅰ.现有几组物质的熔点(℃)数据:
据此回答下列问题:
(1)由表格可知,A组物质熔点普遍偏高,据此回答:A组属于_______ 晶体,硅晶体的熔点低于二氧化硅,是由于_______ 。
(2)B组晶体共同的物理性质是具有良好的延展性和导电性,可用_______ (填序号)理论解释。
①价层电子对互斥理论 ②电子气理论 ③电子云理论
(3)C组中 相对分子质量小于
相对分子质量小于 但熔点却高于
但熔点却高于 ,是由于
,是由于_______ 。
(4)D组晶体中 、
、 、
、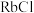 、
、 的熔点由高到低的顺序为
的熔点由高到低的顺序为_______ 。
Ⅱ.下图表示一些常见晶体的微观结构:
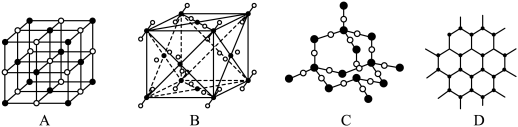
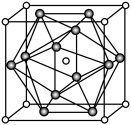
(5)其中代表 的是
的是_______ (填字母),在干冰晶体中,每个CO2分子周围紧邻的 分子有
分子有_______ 个。
(6) 晶体在
晶体在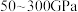 的高压下和
的高压下和 反应生成如图所示的晶胞结构,则该晶体的化学式为
反应生成如图所示的晶胞结构,则该晶体的化学式为_______ 。
(7) 的晶胞如图所示,密度为
的晶胞如图所示,密度为 ,相邻的两个
,相邻的两个 的最近核间距为
的最近核间距为 ,则
,则 的摩尔质量为
的摩尔质量为_______  (列出代数式,设
(列出代数式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。

| A组 | B组 | C组 | D组 |
| 金刚石:3550 |  |  |  |
| 硅晶体:1410 | 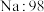 | 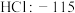 |  |
| 硼晶体:2300 |  | 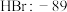 | 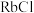 |
| 二氧化硅:1732 | 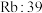 | 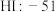 |  |
据此回答下列问题:
(1)由表格可知,A组物质熔点普遍偏高,据此回答:A组属于
(2)B组晶体共同的物理性质是具有良好的延展性和导电性,可用
①价层电子对互斥理论 ②电子气理论 ③电子云理论
(3)C组中
 相对分子质量小于
相对分子质量小于 但熔点却高于
但熔点却高于 ,是由于
,是由于(4)D组晶体中
 、
、 、
、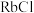 、
、 的熔点由高到低的顺序为
的熔点由高到低的顺序为Ⅱ.下图表示一些常见晶体的微观结构:

(5)其中代表
 的是
的是 分子有
分子有(6)
 晶体在
晶体在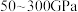 的高压下和
的高压下和 反应生成如图所示的晶胞结构,则该晶体的化学式为
反应生成如图所示的晶胞结构,则该晶体的化学式为
(7)
 的晶胞如图所示,密度为
的晶胞如图所示,密度为 ,相邻的两个
,相邻的两个 的最近核间距为
的最近核间距为 ,则
,则 的摩尔质量为
的摩尔质量为 (列出代数式,设
(列出代数式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次



