1 .  NaOH溶液滴定20.00mL
NaOH溶液滴定20.00mL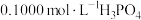 溶液时,
溶液时, 、各含磷元素微粒的
、各含磷元素微粒的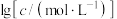 和pH的关系如图。下列说法错误的是
和pH的关系如图。下列说法错误的是
 NaOH溶液滴定20.00mL
NaOH溶液滴定20.00mL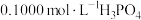 溶液时,
溶液时,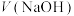 、各含磷元素微粒的
、各含磷元素微粒的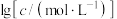 和pH的关系如图。下列说法错误的是
和pH的关系如图。下列说法错误的是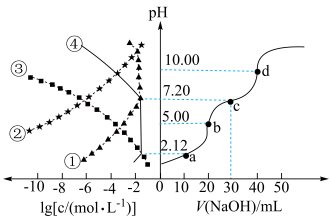
A. 的 的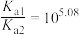 |
| B.水的电离程度:d>c>b>a |
C.③为 的 的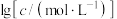 与pH的关系 与pH的关系 |
D.c点时,溶液中存在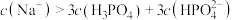 |
您最近一年使用:0次
2024-06-08更新
|
175次组卷
|
4卷引用:辽宁省凌源市2024届高三下学期第三次模拟考试化学试卷
名校
2 . Ⅰ、CO2催化加氢制CH3OH的反应体系中,发生的主要反应有:
①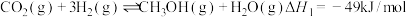
②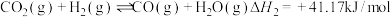
③
(1)③___________ (填“高温自发”“低温自发”或“任何温度下都自发”),该反应中活化能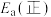
___________ 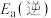 。(填“>”或“<”)
。(填“>”或“<”)
(2)反应①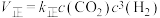 ,
, ,(
,( 、
、 只是温度的函数)。若该温度下的平衡常数K=10,则
只是温度的函数)。若该温度下的平衡常数K=10,则
___________  。升高温度,
。升高温度, 增大的倍数
增大的倍数___________ (填“大于”“小于”或“等于”) 增大的倍数。
增大的倍数。
(3)一定压强下,往某密闭容器中按投料比 充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。___________ 。
A.恒温恒压时充入氦气,反应①、③的平衡均逆向移动,反应②不移动
B.增大 的比值,H2的平衡转化率增大
的比值,H2的平衡转化率增大
C.图中X、Y分别代表CO、H2O
D.体系中的CO2的物质的量分数随温度变化不大,原因是温度变化,反应①、②的平衡移动方向相反
②在一定温度下,向恒容密闭容器中充入lnolCO2和3molH2,仅发生反应①。实验测得CH3OH的平衡分压与起始投料比[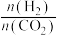 ]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp=
]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp=___________  (用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
(用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
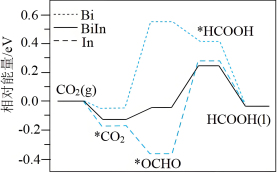
(4)我国学者探究了BiIn合金催化剂电化学还原CO2生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态),试从图分析,采用BiIn合金催化剂优于中金属Bi和单金属In催化剂的原因分别是___________ 。
①
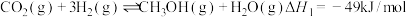
②
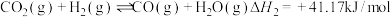
③

(1)③
 。(填“>”或“<”)
。(填“>”或“<”)(2)反应①
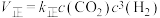 ,
, ,(
,( 、
、 只是温度的函数)。若该温度下的平衡常数K=10,则
只是温度的函数)。若该温度下的平衡常数K=10,则
 。升高温度,
。升高温度, 增大的倍数
增大的倍数 增大的倍数。
增大的倍数。(3)一定压强下,往某密闭容器中按投料比
 充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。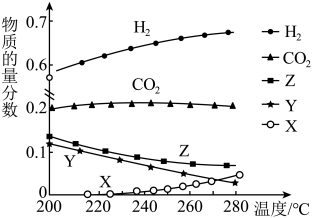
A.恒温恒压时充入氦气,反应①、③的平衡均逆向移动,反应②不移动
B.增大
 的比值,H2的平衡转化率增大
的比值,H2的平衡转化率增大C.图中X、Y分别代表CO、H2O
D.体系中的CO2的物质的量分数随温度变化不大,原因是温度变化,反应①、②的平衡移动方向相反
②在一定温度下,向恒容密闭容器中充入lnolCO2和3molH2,仅发生反应①。实验测得CH3OH的平衡分压与起始投料比[
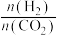 ]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp=
]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp= (用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
(用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。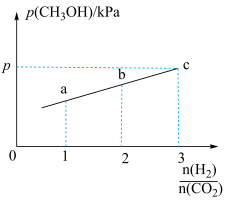
(4)我国学者探究了BiIn合金催化剂电化学还原CO2生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态),试从图分析,采用BiIn合金催化剂优于中金属Bi和单金属In催化剂的原因分别是
您最近一年使用:0次
2024-06-06更新
|
335次组卷
|
3卷引用:2024届辽宁省实验中学高三下学期考前模拟训练(五模)化学试卷
2024·黑龙江吉林·模拟预测
解题方法
3 . 乙苯是生产苯乙烯的一种重要工业原料,工业上一般采用苯烷基化法制取乙苯。回答下列问题:
I.目前工业上生产乙苯主要采用乙烷裂解和苯与乙烯催化烷基化法,发生的反应如下:
①C2H6(g)=C2H4(g)+H2(g)______ (填字母),反应③在热力学上能实现的温度范围为_______ 。______ eV,该步基元反应的化学方程式为______ 。
②能提高反应①平衡转化率的适宜条件为_______ (填字母)。
A.升温 B.加压 C.使用高效的催化剂 D.分离出H2
II.工业上还可以在催化条件下用氯乙烷和苯反应制取乙苯,发生的反应如下:
乙苯的选择性=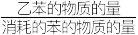 ×100%
×100%
Ka为为物质的量分数平衡常数_______ 。
(4)反应最适宜的时间为_______ (填字母)。
A.10min B.20min C.30min
(5)该温度下,反应④的平衡常数Kx=______ 。
I.目前工业上生产乙苯主要采用乙烷裂解和苯与乙烯催化烷基化法,发生的反应如下:
①C2H6(g)=C2H4(g)+H2(g)
②C2H4(g)+ (g)=
(g)=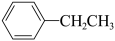 (g)
(g)
③C2H6(g)+ (g)=
(g)= (g)+H2(g)
(g)+H2(g)


②能提高反应①平衡转化率的适宜条件为
A.升温 B.加压 C.使用高效的催化剂 D.分离出H2
II.工业上还可以在催化条件下用氯乙烷和苯反应制取乙苯,发生的反应如下:
④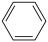 (g)+CH3CH2Cl(g)=
(g)+CH3CH2Cl(g)= (g)+HCl(g)
(g)+HCl(g)
⑤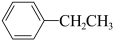 (g)+CH3CH2Cl(g)=
(g)+CH3CH2Cl(g)=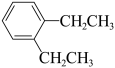 (g)+HCl(g)
(g)+HCl(g)
乙苯的选择性=
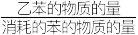 ×100%
×100%Ka为为物质的量分数平衡常数

(4)反应最适宜的时间为
A.10min B.20min C.30min
(5)该温度下,反应④的平衡常数Kx=
您最近一年使用:0次
4 . 已知SrF2为难溶于水、可溶于酸的盐。常温下,向SrF2浊液中滴加稀盐酸,溶液中-lgc(X)(X为Sr2+)变化关系如图。下列说法正确的是

A.L1表示-lgc(Sr2+)与lg 的变化关系 的变化关系 |
| B.Ksp(SrF2)的数量级为10-8 |
| C.c点溶液的pH=3.2 |
| D.b点溶液中存在:2c(Sr2+)+c(H+)=c(OH-)+c(F-) |
您最近一年使用:0次
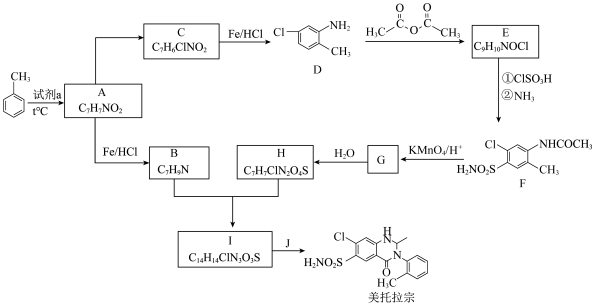
5 . 某研究小组以甲苯为起始原料,按下列路线合成利尿药美托拉宗。
(1)试剂a是_______ 。
(2)C→D的反应类型是_______ 。
(3)E分子中的官能团有_______ 。
(4)属于芳香族化合物的B的同分异构体有_______ 个(提示:不包括B)。
(5)写出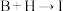 的化学方程式
的化学方程式_______ 。
(6)从D→H的流程看,D→E的主要目的是_______ 。
(7)有人认为由I合成美托拉宗的过程如下:_______ ,K的结构简式_______ 。
已知:ⅰ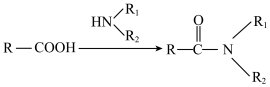 。
。
ⅱ.
(1)试剂a是
(2)C→D的反应类型是
(3)E分子中的官能团有
(4)属于芳香族化合物的B的同分异构体有
(5)写出
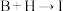 的化学方程式
的化学方程式(6)从D→H的流程看,D→E的主要目的是
(7)有人认为由I合成美托拉宗的过程如下:
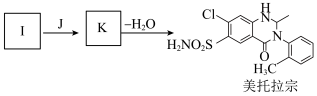
您最近一年使用:0次
6 . 常温下,向 饱和溶液[有足量
饱和溶液[有足量 固体]中滴加氨水,发生反应:
固体]中滴加氨水,发生反应: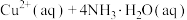

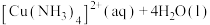 ,溶液中
,溶液中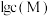 与
与 的关系如图所示,其中
的关系如图所示,其中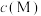 表示
表示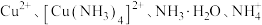 的浓度,单位为
的浓度,单位为 。下列说法正确的是
。下列说法正确的是
 饱和溶液[有足量
饱和溶液[有足量 固体]中滴加氨水,发生反应:
固体]中滴加氨水,发生反应: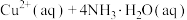

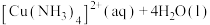 ,溶液中
,溶液中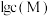 与
与 的关系如图所示,其中
的关系如图所示,其中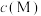 表示
表示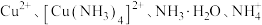 的浓度,单位为
的浓度,单位为 。下列说法正确的是
。下列说法正确的是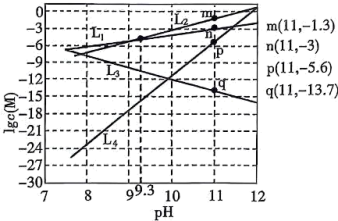
A. 表示溶液中 表示溶液中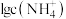 与 与 的关系 的关系 |
B. 的溶度积常数 的溶度积常数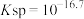 |
C. 时,溶液中: 时,溶液中: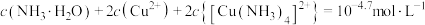 |
D.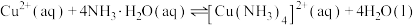 的平衡常数 的平衡常数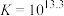 |
您最近一年使用:0次
解题方法
7 . 甲醇和乙醇都是清洁能源,也是重要的化工原料。回答下列问题:
(1)工业上利用合成气合成甲醇: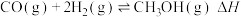
已知:① ;
;
②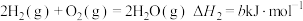 ;
;
③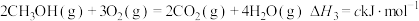
上述反应中的
___________  。
。
(2)一定温度下,在恒容密闭容器中充入1molCO和1molH2,在固体催化剂作用下合成甲醇: ,下列叙述错误的是___________(填字母)。
,下列叙述错误的是___________(填字母)。
(3)甲醇是一种潜在储氢材料。我国学者研究甲醇在钯基催化剂表面上分解制氢: ,其反应历程如图a所示(吸附在催化剂表面的物种用“*”表示)。
,其反应历程如图a所示(吸附在催化剂表面的物种用“*”表示)。___________ 下(高温、低温、任意温度)自发进行;图示历程包括___________ 个基元反应;其中决速反应是反应___________ (填序号),写出该步反应式:___________ 。
(4)工业上,可以采用CO2催化还原制备CH3OH、CH3CH2OH.发生反应如下:
① (主反应);
(主反应);
② (主反应);
(主反应);
③ (副反应)。
(副反应)。
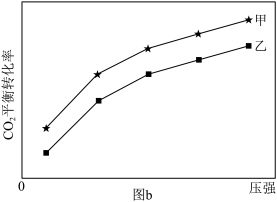
一定温度下,在甲、乙体积相同的反应容器中分别充入1molCO2和3molH2,发生上述反应,其中一个容器使用水分子膜分离技术,另一个容器不使用水分子膜分离技术。实验测得CO2平衡转化率与压强关系如图b所示。其他条件相同,增大压强,CO2平衡转化率增大,其原因是___________ ;采用水分子膜分离技术的容器是___________ (填“甲”或“乙”)。 为
为___________  。(写出数字表达式即可,分压=总压×物质的量分数)
。(写出数字表达式即可,分压=总压×物质的量分数)
(1)工业上利用合成气合成甲醇:
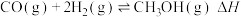
已知:①
 ;
;②
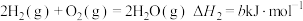 ;
;③
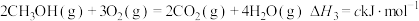
上述反应中的

 。
。(2)一定温度下,在恒容密闭容器中充入1molCO和1molH2,在固体催化剂作用下合成甲醇:
 ,下列叙述错误的是___________(填字母)。
,下列叙述错误的是___________(填字母)。| A.当CO体积分数不变时达到平衡状态 |
| B.平衡后充入少量氩气,平衡不移动 |
| C.平衡后再充入0.1molCO和0.1molH2,CO平衡转化率增大 |
| D.增大催化剂质量,正、逆反应速率同倍数增大 |
(3)甲醇是一种潜在储氢材料。我国学者研究甲醇在钯基催化剂表面上分解制氢:
 ,其反应历程如图a所示(吸附在催化剂表面的物种用“*”表示)。
,其反应历程如图a所示(吸附在催化剂表面的物种用“*”表示)。
(4)工业上,可以采用CO2催化还原制备CH3OH、CH3CH2OH.发生反应如下:
①
 (主反应);
(主反应);②
 (主反应);
(主反应);③
 (副反应)。
(副反应)。一定温度下,在甲、乙体积相同的反应容器中分别充入1molCO2和3molH2,发生上述反应,其中一个容器使用水分子膜分离技术,另一个容器不使用水分子膜分离技术。实验测得CO2平衡转化率与压强关系如图b所示。其他条件相同,增大压强,CO2平衡转化率增大,其原因是
 为
为 。(写出数字表达式即可,分压=总压×物质的量分数)
。(写出数字表达式即可,分压=总压×物质的量分数)
您最近一年使用:0次
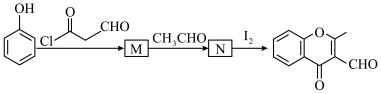
8 . 有机化合物H为某药物中间体,一种合成化合物H的路线如图。
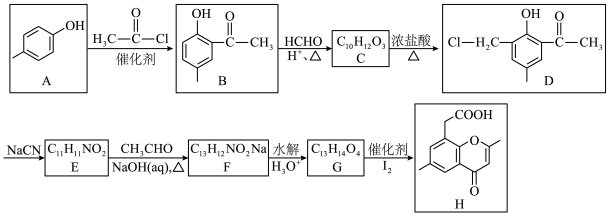
已知:Ⅰ. (R为烃基或H原子,X为卤素原子,下同)
(R为烃基或H原子,X为卤素原子,下同)
Ⅱ.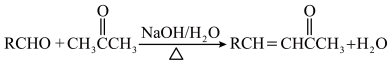
Ⅲ.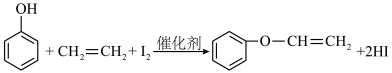
回答下列问题:
(1)A的名称为______ ,H中含氧官能团的名称为醚键、______ 。
(2)C的结构简式为______ 。
(3)E→F的化学方程式为______ 。
(4)B有多种同分异构体,其中能发生银镜反应和水解反应的芳香族化合物的同分异构体有______ 种(不考虑立体异构),核磁共振氢谱有4组峰的同分异构体的结构简式为______ 。(任写一个)
(5)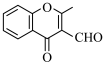 的合成路线如图(部分反应条件已略去),其中M和N的结构简式分别为
的合成路线如图(部分反应条件已略去),其中M和N的结构简式分别为______ 和______ 。

已知:Ⅰ.
 (R为烃基或H原子,X为卤素原子,下同)
(R为烃基或H原子,X为卤素原子,下同)Ⅱ.

Ⅲ.

回答下列问题:
(1)A的名称为
(2)C的结构简式为
(3)E→F的化学方程式为
(4)B有多种同分异构体,其中能发生银镜反应和水解反应的芳香族化合物的同分异构体有
(5)
 的合成路线如图(部分反应条件已略去),其中M和N的结构简式分别为
的合成路线如图(部分反应条件已略去),其中M和N的结构简式分别为
您最近一年使用:0次
9 . 从含钴余液(含 、
、 、
、 、
、 等杂质)中提取氧化钴的流程如下:
等杂质)中提取氧化钴的流程如下:
(1)在去除钙、镁时,选择适当加热条件的理由是___________ ;该步骤控制pH是影响除钙镁效果的重要因素,下图是不同pH条件下硫化钴含量和钴收率图,根据图中信息选择最适宜的pH为___________ ;___________ ;
(3)已知P507萃取剂 和
和 发生如下反应:
发生如下反应:
萃取时适当增加溶液的pH,能增大 的萃取率,原因是
的萃取率,原因是___________ ;
(4)反萃取时加入的试剂a应为___________(填代号);
(5)沉钴的离子方程式为___________ ;
(6)系列操作中如何检验 是否洗涤干净
是否洗涤干净___________ ;
(7)空气中煅烧 生成钴的某种氧化物和
生成钴的某种氧化物和 ,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下
,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下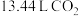 ,则钴的氧化物的化学式为
,则钴的氧化物的化学式为___________ 。
 、
、 、
、 、
、 等杂质)中提取氧化钴的流程如下:
等杂质)中提取氧化钴的流程如下: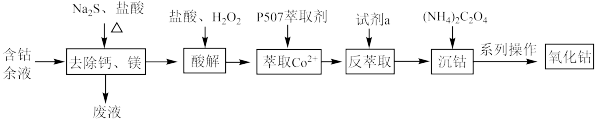
(1)在去除钙、镁时,选择适当加热条件的理由是

(3)已知P507萃取剂
 和
和 发生如下反应:
发生如下反应:
萃取时适当增加溶液的pH,能增大
 的萃取率,原因是
的萃取率,原因是(4)反萃取时加入的试剂a应为___________(填代号);
A. | B.HCl | C.NaOH | D. |
(5)沉钴的离子方程式为
(6)系列操作中如何检验
 是否洗涤干净
是否洗涤干净(7)空气中煅烧
 生成钴的某种氧化物和
生成钴的某种氧化物和 ,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下
,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下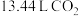 ,则钴的氧化物的化学式为
,则钴的氧化物的化学式为
您最近一年使用:0次
名校
解题方法
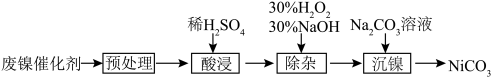
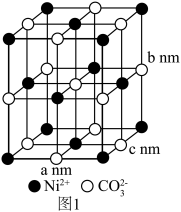
10 . 碳酸镍具有良好的催化性能,在化学和工业领域广泛应用。利用废镍催化剂(主要成分为 Ni及其氧化物、Al和 Fe的氧化物)获得碳酸镍的过程如下:
回答下列问题:
(1)“酸浸”时,稀硫酸比稀硝酸更合理,理由是_______ 。
(2)“除杂”时,先加入30% H2O2溶液,再用30% NaOH溶液调pH, 适当升温,反应2 h。
①若除杂后溶液中Ni2+浓度为0.10 mol/L,需控制溶液的pH范围是_______ 。
②加入30% H2O2的目的为_______ 。
③该过程还可用NaClO替代H2O2, 调节pH 为3.5,其反应的离子方程式为_______ 。
(3)“沉镍”后获得产品的一系列操作为_______ 。
(4)碳酸镍的晶胞如图1所示,Ni2+的配位数为_______ ,晶胞密度为_______ g/cm³(列出计算式,阿伏加德罗常数的值为NA)。_______ 。
| 物质 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | Fe(OH)2 |
| 开始沉淀pH | 2.2 | 3.7 | 7.2 | 7.5 |
| 完全沉淀pH | 3.2 | 4.7 | 8.7 | 9.0 |
(1)“酸浸”时,稀硫酸比稀硝酸更合理,理由是
(2)“除杂”时,先加入30% H2O2溶液,再用30% NaOH溶液调pH, 适当升温,反应2 h。
①若除杂后溶液中Ni2+浓度为0.10 mol/L,需控制溶液的pH范围是
②加入30% H2O2的目的为
③该过程还可用NaClO替代H2O2, 调节pH 为3.5,其反应的离子方程式为
(3)“沉镍”后获得产品的一系列操作为
(4)碳酸镍的晶胞如图1所示,Ni2+的配位数为
您最近一年使用:0次
2024-03-22更新
|
780次组卷
|
4卷引用:东北三省三校(哈师大附中、东北师大附中、辽宁省实验中学)2023-2024学年高三下学期第一次联合模拟考化学试卷
东北三省三校(哈师大附中、东北师大附中、辽宁省实验中学)2023-2024学年高三下学期第一次联合模拟考化学试卷(已下线)化学(辽宁卷03)-2024年高考押题预测卷河北省石家庄市河北正定中学2023-2024学年高三下学期4月模拟考试化学试题(已下线)江苏省南京师范大学附属中学2024届高三下学期5月模拟化学试题



