解题方法
1 . 1,3-丙二胺[H2N(CH2)3NH2]是一种二元弱碱[可简写为M(OH)2],25℃时,向一定浓度的MCl2溶液中逐滴加入NaOH溶液,以X表示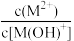 或
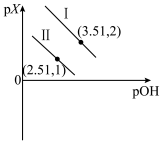
或 已知pX=-lgX,混合溶液中pX与pOH的关系如图所示。下列说法正确的是
已知pX=-lgX,混合溶液中pX与pOH的关系如图所示。下列说法正确的是
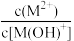 或
或 已知pX=-lgX,混合溶液中pX与pOH的关系如图所示。下列说法正确的是
已知pX=-lgX,混合溶液中pX与pOH的关系如图所示。下列说法正确的是
A.曲线Ⅱ表示p{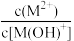 }与pOH的关系 }与pOH的关系 |
| B.M(OH)2第一步电离的电离常数为1×10-1.51 |
| C.pOH=4.01时,c(M2+)=c[M(OH)2]>c[M(OH)+] |
| D.pOH=3.51时,3c[M(OH)2]+c(OH-)=c(H+)+c(Na+) |
您最近一年使用:0次
2 . 室温下,用HCl调节 Na3R溶液的 pH,混合溶液的 pH与离子浓度的关系如图所示。下列说法正确的是
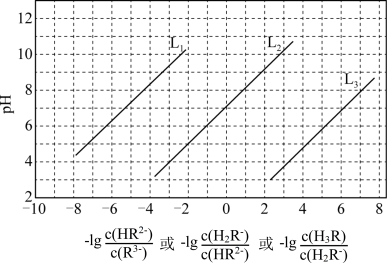

A.L1表示 pH与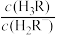 的关系曲线 的关系曲线 |
| B.NaH2R溶液呈酸性 |
| C.电离常数[Ka1(H3R)]的数量级为10-3 |
D.混合溶液的pH=7时,存在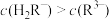 |
您最近一年使用:0次
解题方法
3 . 某兴趣小组利用氢离子交换树脂吸附溶液中其他阳离子,同时交换出氢离子的特性(如图所示),设计了测定 溶度积常数的实验。准确量取
溶度积常数的实验。准确量取 饱和溶液于烧杯中,加入过量的阳离子交换树脂,充分搅拌,静置,过滤,使用蒸馏水洗涤离子交换树脂至洗涤液呈中性,合并滤液和洗涤液至锥形瓶,用滴定法测定锥形瓶中氢离子的物质的量,计算出
饱和溶液于烧杯中,加入过量的阳离子交换树脂,充分搅拌,静置,过滤,使用蒸馏水洗涤离子交换树脂至洗涤液呈中性,合并滤液和洗涤液至锥形瓶,用滴定法测定锥形瓶中氢离子的物质的量,计算出 溶度积常数。(
溶度积常数。(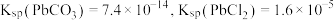 )
)

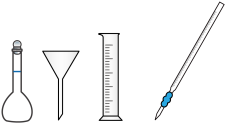
(1)下列仪器中,本实验用不到的有___________ (写名称)。
(2)配制 饱和溶液时需要使用煮沸后的蒸馏水,原因是
饱和溶液时需要使用煮沸后的蒸馏水,原因是___________ 。
(3)判断洗涤液已至中性的方法是___________ 。
(4)过滤后的溶液中发现有树脂小颗粒,此时应该___________ 。
(5)若实验使用的烧杯未干燥,测定结果___________ (填“偏高”,“偏低”或“不变”)。
(6)为了测定锥形瓶中氢离子的物质的量,使用浓度为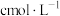 的氢氧化钠溶液进行滴定,可选用
的氢氧化钠溶液进行滴定,可选用___________ 为指示剂,滴定终点现象为___________ 。到达滴定终点时,消耗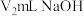 溶液,则
溶液,则 的
的
___________ (写出计算式)。
(7)兴趣小组对实验进行讨论,某同学提出可以利用该方法测定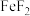 的
的 ,是否可行,原因是
,是否可行,原因是___________ 。
 溶度积常数的实验。准确量取
溶度积常数的实验。准确量取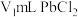 饱和溶液于烧杯中,加入过量的阳离子交换树脂,充分搅拌,静置,过滤,使用蒸馏水洗涤离子交换树脂至洗涤液呈中性,合并滤液和洗涤液至锥形瓶,用滴定法测定锥形瓶中氢离子的物质的量,计算出
饱和溶液于烧杯中,加入过量的阳离子交换树脂,充分搅拌,静置,过滤,使用蒸馏水洗涤离子交换树脂至洗涤液呈中性,合并滤液和洗涤液至锥形瓶,用滴定法测定锥形瓶中氢离子的物质的量,计算出 溶度积常数。(
溶度积常数。(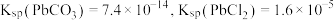 )
)
(1)下列仪器中,本实验用不到的有

(2)配制
 饱和溶液时需要使用煮沸后的蒸馏水,原因是
饱和溶液时需要使用煮沸后的蒸馏水,原因是(3)判断洗涤液已至中性的方法是
(4)过滤后的溶液中发现有树脂小颗粒,此时应该
(5)若实验使用的烧杯未干燥,测定结果
(6)为了测定锥形瓶中氢离子的物质的量,使用浓度为
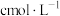 的氢氧化钠溶液进行滴定,可选用
的氢氧化钠溶液进行滴定,可选用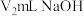 溶液,则
溶液,则 的
的
(7)兴趣小组对实验进行讨论,某同学提出可以利用该方法测定
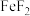 的
的 ,是否可行,原因是
,是否可行,原因是
您最近一年使用:0次
名校
解题方法
4 . 科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为 。设
。设 为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是
 。设
。设 为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是
A.晶体的最简化学式为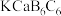 |
B.晶体中与 最近且距离相等的 最近且距离相等的 有4个 有4个 |
| C.晶胞中B和C原子构成的多面体有14个面 |
D.晶体的密度为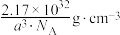 |
您最近一年使用:0次
2023-12-05更新
|
1186次组卷
|
4卷引用:专题04 物质结构与性质-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
(已下线)专题04 物质结构与性质-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)吉林省长春市2024届高三上学期质量监测(一)化学试题(已下线)专题04 物质结构与性质 元素推断-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)2024届天津市宁河区芦台第一中学高三下学期第三次模拟化学试题
解题方法
5 . K2Cr2O7溶液中存在多个平衡。在考虑平衡:① (aq) +H2O(l)
(aq) +H2O(l) 2
2 (aq) K1=3.0× 10-2(25°C);②
(aq) K1=3.0× 10-2(25°C);② (aq)
(aq)
 (aq) +H+(aq) K2=3.3× 10-7(25°C)的条件下,25°C时,向0.10 mol/L K2Cr2O7溶液中加入NaOH,溶液中
(aq) +H+(aq) K2=3.3× 10-7(25°C)的条件下,25°C时,向0.10 mol/L K2Cr2O7溶液中加入NaOH,溶液中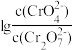 ,随pH的变化关系如图所示,溶液体积变化可忽略。下列说法中正确的是
,随pH的变化关系如图所示,溶液体积变化可忽略。下列说法中正确的是

 (aq) +H2O(l)
(aq) +H2O(l) 2
2 (aq) K1=3.0× 10-2(25°C);②
(aq) K1=3.0× 10-2(25°C);② (aq)
(aq)
 (aq) +H+(aq) K2=3.3× 10-7(25°C)的条件下,25°C时,向0.10 mol/L K2Cr2O7溶液中加入NaOH,溶液中
(aq) +H+(aq) K2=3.3× 10-7(25°C)的条件下,25°C时,向0.10 mol/L K2Cr2O7溶液中加入NaOH,溶液中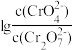 ,随pH的变化关系如图所示,溶液体积变化可忽略。下列说法中正确的是
,随pH的变化关系如图所示,溶液体积变化可忽略。下列说法中正确的是
| A.已知Ka1(H2SO3) = 1.29× 10-2,由②可知向K2CrO4溶液中通SO2可制得KHCrO4 |
B.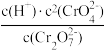 的值随溶液 pH的增大逐渐减小 的值随溶液 pH的增大逐渐减小 |
C.当溶液pH=9时,溶液中的 平衡浓度约为6 × 10-4mol/L 平衡浓度约为6 × 10-4mol/L |
D.当溶液pH=7时,c(K+) =c ( ) +c( ) +c(  ) +2c ( ) +2c ( ) ) |
您最近一年使用:0次
名校
6 . 25℃时,向20.00mL0.1mol·L-1H2X溶液中滴入0.1mol·L-1 NaOH溶液,溶液中由水电离出的c水(OH-)的负对数[-1gc水(OH-)]与所加NaOH溶液体积的关系如图所示。
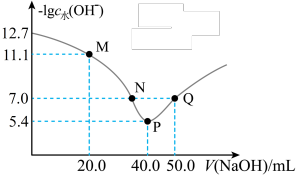
| A.水的电离程度:M>N=Q>P |
B.图中M、P、Q三点对应溶液中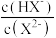 相等 相等 |
| C.N点溶液中c(Na+)>c(X2-)>c(HX-)>c(H+)=c(OH-) |
| D.P点溶液中c(OH-)=c(H+)+c(HX-)+c(H2X) |
您最近一年使用:0次
2019-05-17更新
|
3239次组卷
|
7卷引用:甘肃省张掖市2021-2022学年高三第二次全市联考(3月)理综化学试题
7 . 高锰酸钾[KMnO4]是常用的氧化剂。工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体。中间产物为锰酸钾[K2MnO4]。下图是实验室模拟制备的操作流程:

相关资料:
①物质溶解度
②锰酸钾[K2MnO4]
外观性状:墨绿色结晶。其水溶液呈深绿色,这是锰酸根(MnO42—)的特征颜色。
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42—会发生歧化反应。
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是______________ ;
实验中用铁坩埚煅烧暴露在空气中的固体混合物发生反应的化学方程式为_______ 。
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低。请写出实验中通入适量CO2时体系中可能发生反应离子方程式 :________ ;
其中氧化还原反应中氧化剂和还原剂的质量比为_________________________ 。
(3)由于CO2的通入量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸。从理论上分析,选用下列酸中________ ,得到的产品纯度更高。
A.醋酸 B.浓盐酸 C.稀硫酸
(4)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程为_________ ;
传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低。有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图)。
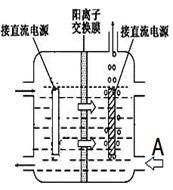
图中A口加入的溶液最好为__________ 。
使用阳离子交换膜可以提高Mn元素利用率的原因为_______________ 。

相关资料:
①物质溶解度
| 物质 | KMnO4 | K2CO3 | KHCO3网] | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
外观性状:墨绿色结晶。其水溶液呈深绿色,这是锰酸根(MnO42—)的特征颜色。
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42—会发生歧化反应。
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是
实验中用铁坩埚煅烧暴露在空气中的固体混合物发生反应的化学方程式为
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低。请写出实验中通入适量CO2时体系中可能发生反应离子方程式 :
其中氧化还原反应中氧化剂和还原剂的质量比为
(3)由于CO2的通入量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸。从理论上分析,选用下列酸中
A.醋酸 B.浓盐酸 C.稀硫酸
(4)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程为
传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低。有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图)。

图中A口加入的溶液最好为
使用阳离子交换膜可以提高Mn元素利用率的原因为
您最近一年使用:0次
2019-01-30更新
|
390次组卷
|
2卷引用:2015届甘肃省天水市秦安县二中高三下学期二模考试理综化学试卷
8 . 硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取,其工艺流程如下图所示。
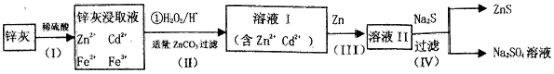
(1)为提高锌灰的浸取率,可采用的方法是___________ (填序号)。
① 研磨 ② 多次浸取 ③ 升高温度 ④ 加压 ⑤ 搅拌
(2)步骤II中加入ZnCO3的作用是________ 、___________ (用离子方程式表示),所得滤渣中的物质是________ (写化学式)。
(3)步骤IV还可以回收Na2SO4来制取Na2S及Na2SO4·10H2O。
①等物质的量的Na2SO4和CH4在高温、催化剂条件下可以制取Na2S,化学反应方程式为___________ ;
②已知Na2SO4·10H2O及Na2SO4的溶解度随温度变化曲线如图所示。从滤液中得到Na2SO4·10H2O晶体的操作方法是______________ 。

(4)若步骤II加入的ZnCO3为bmol,步骤Ⅲ所得Cd为dmol,最后得到VL、物质的量浓度为cmol/L的Na2SO4溶液。则理论上所用锌灰中含有锌元素的质量为________ 。
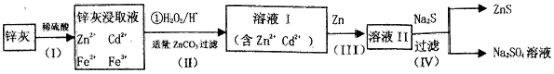
(1)为提高锌灰的浸取率,可采用的方法是
① 研磨 ② 多次浸取 ③ 升高温度 ④ 加压 ⑤ 搅拌
(2)步骤II中加入ZnCO3的作用是
(3)步骤IV还可以回收Na2SO4来制取Na2S及Na2SO4·10H2O。
①等物质的量的Na2SO4和CH4在高温、催化剂条件下可以制取Na2S,化学反应方程式为
②已知Na2SO4·10H2O及Na2SO4的溶解度随温度变化曲线如图所示。从滤液中得到Na2SO4·10H2O晶体的操作方法是

(4)若步骤II加入的ZnCO3为bmol,步骤Ⅲ所得Cd为dmol,最后得到VL、物质的量浓度为cmol/L的Na2SO4溶液。则理论上所用锌灰中含有锌元素的质量为
您最近一年使用:0次
9 . 聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景。PPG的一种合成路线如下:
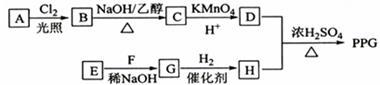
已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物B为单氯代烃:化合物C的分子式为C5H8;
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质;
④ 。
。
回答下列问题:
(1)A的结构简式为______ 。
(2)由B生成C的化学方程式为_______ 。
(3)由E和F生成G的反应类型为______ ,G的化学名称为_________ 。
(4)①由D和H生成PPG的化学方程式为_______ 。
②若PPG平均相对分子质量为10000,则其平均聚合度约为_______ (填标号)。
a.48 b.58 c.76 d.122
(5)D的同分异构体中能同时满足下列条件的共有_____ 种(不含立体异构):
①能与饱和NaHCO3溶液反应产生气体
②既能发生银镜反应,又能发生皂化反应
其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是_____ (写结构简式):
D的所有同分异构体在下列—种表征仪器中显示的信号(或数据)完全相同,该仪器是_____ (填标号)。
a.质谱仪b.红外光谱仪c.元素分析仪d.核磁共振仪

已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物B为单氯代烃:化合物C的分子式为C5H8;
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质;
④
 。
。回答下列问题:
(1)A的结构简式为
(2)由B生成C的化学方程式为
(3)由E和F生成G的反应类型为
(4)①由D和H生成PPG的化学方程式为
②若PPG平均相对分子质量为10000,则其平均聚合度约为
a.48 b.58 c.76 d.122
(5)D的同分异构体中能同时满足下列条件的共有
①能与饱和NaHCO3溶液反应产生气体
②既能发生银镜反应,又能发生皂化反应
其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是
D的所有同分异构体在下列—种表征仪器中显示的信号(或数据)完全相同,该仪器是
a.质谱仪b.红外光谱仪c.元素分析仪d.核磁共振仪
您最近一年使用:0次
2019-01-30更新
|
6309次组卷
|
11卷引用:甘肃省平凉市泾川市2019届高三模拟测试化学试题
甘肃省平凉市泾川市2019届高三模拟测试化学试题2016届黑龙江哈尔滨六中高三下三模理综化学试卷陕西省西安市高新第一中学2020届高三教学质量监测理综化学试题2015年全国普通高等学校招生统一考试化学(新课标II卷)黑龙江省哈尔滨师范大学附属中学2016-2017学年高二下学期期中考试化学试题河北省唐山市开滦第二中学2016-2017学年高二6月月考化学试题2018版化学(苏教版)高考总复习专题十二课时跟踪训练--基本营养物质 合成有机高分子广东省仲元中学2017-2018学年高二上学期期中考试化学(理)试题贵州省遵义航天高级中学2018届高三假期模拟考试理科综合化学试题2020届成都市第七中学高中毕业班四月份教学质量监测卷理科综合化学部分黑龙江省哈尔滨市哈尔滨师范大学附属中学2021-2022学年高二下学期开学考试化学试题
10 . 某学生对SO2与漂粉精的反应进行实验探究:
(1)C12和Ca(OH)2制取漂粉精的化学方程是_________ 。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是_________ 。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
① 实验a目的是______ 。
②由实验a、b不能判断白雾中含有HCl,理由是________ 。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是______ 。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HCl,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是_____ 。
②用离子方程式解释现象iii中黄绿色褪去的原因:________ 。
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
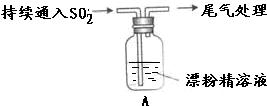 | i、液面上方出现白雾; ii、稍后,出现浑浊,溶液变为黄绿色; iii、稍后,产生大量白色沉淀,黄绿色褪去 |
(1)C12和Ca(OH)2制取漂粉精的化学方程是
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
① 实验a目的是
②由实验a、b不能判断白雾中含有HCl,理由是
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HCl,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是
②用离子方程式解释现象iii中黄绿色褪去的原因:
您最近一年使用:0次
2019-01-30更新
|
4670次组卷
|
9卷引用:甘肃省酒泉市敦煌中学2020届高三上学期第二次调研考试化学试题
甘肃省酒泉市敦煌中学2020届高三上学期第二次调研考试化学试题2013年全国普通高等学校招生统一考试理科综合能力测试化学(北京卷)(已下线)2014届高考化学二轮专题冲刺第10讲 非金属及其化合物练习卷2016届福建省莆田市第二十五中学高三上学期第一次月考化学试卷2015-2016学年安徽省六安一中高一下周末测试一化学试卷福建省泉州第五中学高中化学必修1专题4 《硫、氮和可持续发展》 专题检测山东省济宁市泗水县2020届高三上学期期中考试化学试题(已下线)解密12 实验化学(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密13 实验化学(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)



