1 . 部分含Fe或Cu元素物质的分类与相应化合价关系如图所示。下列推断不合理的是
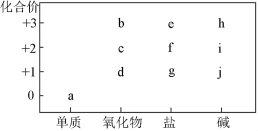
| A.a和足量S混合加热,可能生成f或g,不可能生成e |
| B.往f中加入浓NaOH溶液,则最终会生成i |
| C.新制的i和葡萄糖混合溶液加热,可能得到d |
D.d和j溶于稀 ,如果有f生成,则有a生成 ,如果有f生成,则有a生成 |
您最近一年使用:0次
名校
解题方法
2 . 为研究金属的电化学腐蚀机理,某小组同学采用传感器设计如图所示装置。下列说法不正确的是
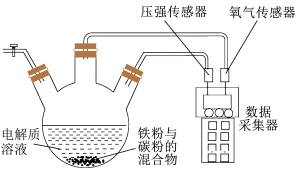
| A.碳粉作正极 | B.负极电极反应式: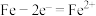 |
| C.若压强传感器显示压强升高,则以吸氧腐蚀为主 | D.若将碳粉换成锌粉,则 可被保护 可被保护 |
您最近一年使用:0次
2024-09-10更新
|
431次组卷
|
3卷引用:2025届广东省广州市高三上学期8月第一次调研考试化学试卷
3 . 四氧化三锰( )是一种可用于生产锂离子电池正极材料的原料。以天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)为原料制备高纯
)是一种可用于生产锂离子电池正极材料的原料。以天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)为原料制备高纯 的工艺流程如图所示。
的工艺流程如图所示。 ]形成氢氧化物沉淀的pH范围如下表,当离子浓度小于
]形成氢氧化物沉淀的pH范围如下表,当离子浓度小于 时,则认为该离子沉淀完全了。
时,则认为该离子沉淀完全了。
回答下列问题:
(1)“氧化”步骤的主要目的是_______ 。
(2)“调pH”时溶液的pH范围应调节为4.7~6.2之间,据此可以得知: 的
的
_______ 。
(3)“滤渣3”中主要有_______ 。
(4)写出“沉锰”时的离子方程式:_______ 。
(5)在“沉锰”时,可以额外添加适量氨水促进生成碳酸锰,请你从化学平衡移动的角度解释加入氨水的目的:_______ 。
(6)Mn和O可以组成多种氧化物,其中一种氧化物的晶胞如图所示。_______ 。
②已知阿伏加德罗常数的值为 ,该晶体的密度
,该晶体的密度
_______  (用含a、b的代数式表示)。
(用含a、b的代数式表示)。
 )是一种可用于生产锂离子电池正极材料的原料。以天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)为原料制备高纯
)是一种可用于生产锂离子电池正极材料的原料。以天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)为原料制备高纯 的工艺流程如图所示。
的工艺流程如图所示。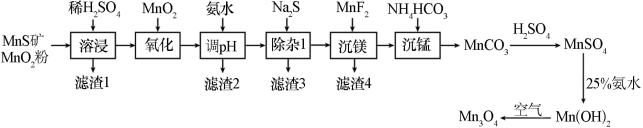
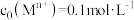 ]形成氢氧化物沉淀的pH范围如下表,当离子浓度小于
]形成氢氧化物沉淀的pH范围如下表,当离子浓度小于 时,则认为该离子沉淀完全了。
时,则认为该离子沉淀完全了。| 金属离子 |  |  |  |  |  |  |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 10.9 | 8.2 | 8.9 |
(1)“氧化”步骤的主要目的是
(2)“调pH”时溶液的pH范围应调节为4.7~6.2之间,据此可以得知:
 的
的
(3)“滤渣3”中主要有
(4)写出“沉锰”时的离子方程式:
(5)在“沉锰”时,可以额外添加适量氨水促进生成碳酸锰,请你从化学平衡移动的角度解释加入氨水的目的:
(6)Mn和O可以组成多种氧化物,其中一种氧化物的晶胞如图所示。
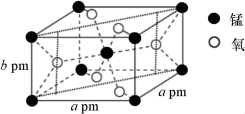
②已知阿伏加德罗常数的值为
 ,该晶体的密度
,该晶体的密度
 (用含a、b的代数式表示)。
(用含a、b的代数式表示)。
您最近一年使用:0次
4 . 西那卡塞 是一种治疗甲状旁腺功能亢进的药物,其合成路线如图:
是一种治疗甲状旁腺功能亢进的药物,其合成路线如图:
(1)A中官能团的名称为___________ 。根据A的结构特征,完成下表。
(2)B的结构简式为___________ 。
(3) 的反应类型为
的反应类型为___________ 。
(4)同时符合下列条件的化合物 的同分异构体有
的同分异构体有___________ 种。
①核磁共振氢谱显示三组峰面积之比为 ;
;
②能与 溶液作用显色。
溶液作用显色。
(5) 能与
能与 形成盐酸西那卡塞,从物质结构角度分析其原因
形成盐酸西那卡塞,从物质结构角度分析其原因___________ 。
(6)化合物 是一种含有七元杂环的生物碱,其合成路线如图(反应条件已省略):
是一种含有七元杂环的生物碱,其合成路线如图(反应条件已省略): 的结构简式为
的结构简式为___________ 。
② 的方程式为
的方程式为___________ 。
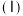 是一种治疗甲状旁腺功能亢进的药物,其合成路线如图:
是一种治疗甲状旁腺功能亢进的药物,其合成路线如图: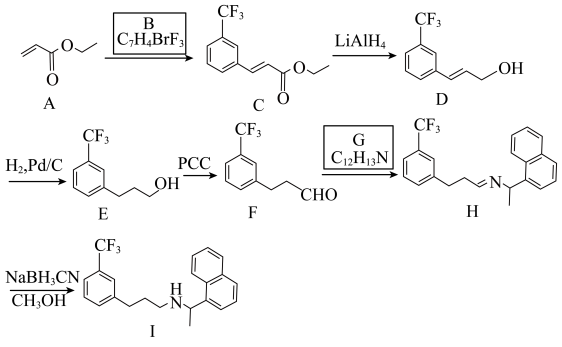
(1)A中官能团的名称为
| 序号 | 反应试剂、条件 | 生成物结构简式 | 反应类型 |
 | 催化剂、加热 | 加聚反应 | |
 |  、 、 | 水解反应 |
(2)B的结构简式为
(3)
 的反应类型为
的反应类型为(4)同时符合下列条件的化合物
 的同分异构体有
的同分异构体有①核磁共振氢谱显示三组峰面积之比为
 ;
;②能与
 溶液作用显色。
溶液作用显色。(5)
 能与
能与 形成盐酸西那卡塞,从物质结构角度分析其原因
形成盐酸西那卡塞,从物质结构角度分析其原因(6)化合物
 是一种含有七元杂环的生物碱,其合成路线如图(反应条件已省略):
是一种含有七元杂环的生物碱,其合成路线如图(反应条件已省略):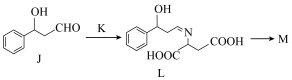
 的结构简式为
的结构简式为②
 的方程式为
的方程式为
您最近一年使用:0次
2024-09-04更新
|
491次组卷
|
2卷引用:2025届广东省广州市高三上学期8月第一次调研考试化学试卷
解题方法
5 . 将羧酸的碱金属盐溶液用惰性电极电解可得到烃类化合物,例如:2CH3COOK+2H2O CH3CH3↑+2CO2↑+H2↑+2KOH。现有下列衍变关系(A、B、C、D、E、F、G均为有机物):
CH3CH3↑+2CO2↑+H2↑+2KOH。现有下列衍变关系(A、B、C、D、E、F、G均为有机物):
(1)电解ClCH2COOK溶液时阳极的电极反应式是___________(填选项)。
(2)操作I的名称是___________ ,G的结构简式是___________ 。
(3)写出B与银氨溶液按物质的量1:4反应的化学方程式:___________ 。
(4)写出下列化学方程式并指出其反应类型:
①A→B:___________ ,反应类型:___________ 。
②E→F___________ ,反应类型:___________ 。
 CH3CH3↑+2CO2↑+H2↑+2KOH。现有下列衍变关系(A、B、C、D、E、F、G均为有机物):
CH3CH3↑+2CO2↑+H2↑+2KOH。现有下列衍变关系(A、B、C、D、E、F、G均为有机物):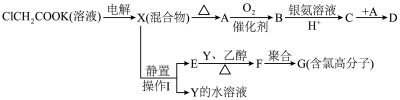
(1)电解ClCH2COOK溶液时阳极的电极反应式是___________(填选项)。
| A.2ClCH2COO-﹣2e-=ClCH2CH2Cl+2CO2↑ |
| B.2H++2e-=H2↑ |
| C.2H2O+2e-=2OH﹣+H2↑ |
| D.4OH--4e-=2H2O+O2↑ |
(2)操作I的名称是
(3)写出B与银氨溶液按物质的量1:4反应的化学方程式:
(4)写出下列化学方程式并指出其反应类型:
①A→B:
②E→F
您最近一年使用:0次
名校
6 . 苯乙烯是生产塑料与合成橡胶的重要原料。 氧化乙苯脱氢制苯乙烯的反应为:
氧化乙苯脱氢制苯乙烯的反应为:
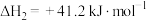
回答下列问题:
(1)反应Ⅰ的
___________ 。
(2)下列关于反应Ⅰ~Ⅲ的说法正确的是___________(填字母)。
(3)在高温催化剂 作用下,
作用下, 氧化乙苯脱氢制苯乙烯可能存在如下图所示反应机理:
氧化乙苯脱氢制苯乙烯可能存在如下图所示反应机理: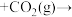 ___________
___________ ,
,___________
(4)常压下,乙苯和 经催化剂吸附后才能发生上述反应Ⅰ。控制投料比[
经催化剂吸附后才能发生上述反应Ⅰ。控制投料比[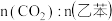 ]分别为1∶1、5∶1和10∶1,并在催化剂作用下发生反应,乙苯平衡转化率与反应温度的关系如图所示:
]分别为1∶1、5∶1和10∶1,并在催化剂作用下发生反应,乙苯平衡转化率与反应温度的关系如图所示:___________ ,Q点平衡常数___________ P点平衡常数(填“>”、“<”或“=”)。
②相同温度下,投料比远大于10∶1时,乙苯的消耗速率明显下降,可能的原因是:
ⅰ.乙苯的浓度过低;
ⅱ.___________ 。
③850K时,若初始乙苯的物质的量为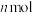 ,反应经
,反应经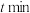 达到图中P点所示状态,则
达到图中P点所示状态,则
___________  。
。
 氧化乙苯脱氢制苯乙烯的反应为:
氧化乙苯脱氢制苯乙烯的反应为:反应Ⅰ: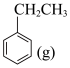 +CO2(g)
+CO2(g)
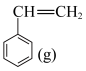
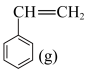 + H2O(g) +CO(g)
+ H2O(g) +CO(g) 
已知:反应Ⅱ: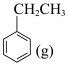

 + H2(g)
+ H2(g) 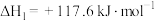

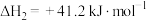
回答下列问题:
(1)反应Ⅰ的

(2)下列关于反应Ⅰ~Ⅲ的说法正确的是___________(填字母)。
| A.及时分离出水蒸气,有利于提高平衡混合物中苯乙烯的含量 |
B.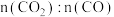 保持恒定时,说明反应Ⅰ达到化学平衡状态 保持恒定时,说明反应Ⅰ达到化学平衡状态 |
| C.其他条件相同,反应Ⅱ分别在恒容和恒压条件下进行,前者乙苯的平衡转化率更高 |
| D.反应Ⅲ正反应的活化能小于逆反应的活化能 |
(3)在高温催化剂
 作用下,
作用下, 氧化乙苯脱氢制苯乙烯可能存在如下图所示反应机理:
氧化乙苯脱氢制苯乙烯可能存在如下图所示反应机理: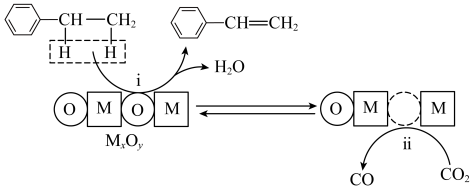
ⅰ: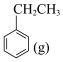
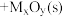

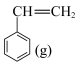 +___________+___________,
+___________+___________,
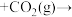 ___________
___________ ,
,(4)常压下,乙苯和
 经催化剂吸附后才能发生上述反应Ⅰ。控制投料比[
经催化剂吸附后才能发生上述反应Ⅰ。控制投料比[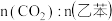 ]分别为1∶1、5∶1和10∶1,并在催化剂作用下发生反应,乙苯平衡转化率与反应温度的关系如图所示:
]分别为1∶1、5∶1和10∶1,并在催化剂作用下发生反应,乙苯平衡转化率与反应温度的关系如图所示: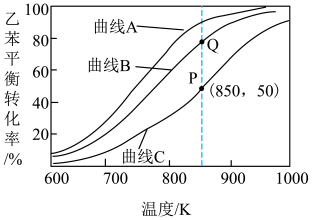
②相同温度下,投料比远大于10∶1时,乙苯的消耗速率明显下降,可能的原因是:
ⅰ.乙苯的浓度过低;
ⅱ.
③850K时,若初始乙苯的物质的量为
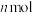 ,反应经
,反应经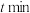 达到图中P点所示状态,则
达到图中P点所示状态,则
 。
。
您最近一年使用:0次
2024-08-08更新
|
443次组卷
|
3卷引用:广东省2025届高三一调模拟卷化学试题
7 . 使用废炭再生的“绿色甲醇”作为燃料,实现了循环内的零排放。
I.将工业废气中的 。加氢制甲醇是“碳中和”的一个重要研究方向。在催化剂作用下主要发生如下反应:
。加氢制甲醇是“碳中和”的一个重要研究方向。在催化剂作用下主要发生如下反应:
①
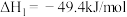
②
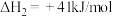
③

已知甲醇的选择性 。
。
(1)
___________ kJ/mol,反应③的自发进行的条件是___________ (填“低温”或“高温”)。
(2)恒温恒容条件下,原料气 、
、 与物质的量浓度之比1:3投料时,已知初始压强为4MPa,
与物质的量浓度之比1:3投料时,已知初始压强为4MPa, ,控制合适的条件(不考虑反应③)。
,控制合适的条件(不考虑反应③)。
i.下列有关说法正确的是___________ 。
A.反应过程中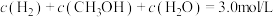
B.容器的压强不再变化时,两反应都达到平衡
C.加入反应①的催化剂,可提高平衡时甲醇的选择性
D.降低反应温度,反应①②的正、逆反应的速率都减小
ii.若平衡时甲醇的选择性为60%, 平衡转化率为50%,该条件下反应②的
平衡转化率为50%,该条件下反应②的
___________ (保留三位小数)。
II.恒压时,将3mol 和1mol
和1mol 充入密闭溶器中进行上述反应。
充入密闭溶器中进行上述反应。
(3)平衡时 转化率
转化率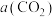 、
、 选择性
选择性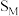 、CO选择性
、CO选择性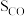 ,随温度T变化如图甲所示:
,随温度T变化如图甲所示: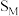 的是曲线
的是曲线___________ 。
(4)为了探究原料气中混入CO气体对反应的影响,测得平衡时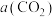 、平衡时
、平衡时 物质的量与初始
物质的量与初始 物质的量之比γ随原料气中
物质的量之比γ随原料气中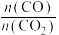 的变化如图乙所示。
的变化如图乙所示。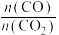 的增大,
的增大,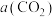 降低而γ升高的原因是
降低而γ升高的原因是___________ 。当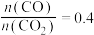 时,若平衡时
时,若平衡时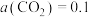 ,
, ,则
,则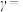
___________ 。
III.新能源的利用对实现碳中和也有重要意义。第二代钠离子电池是以硬碳(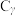 )为基底材料的嵌钠硬碳(
)为基底材料的嵌钠硬碳(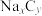 )和锰基高锰普鲁士白
)和锰基高锰普鲁士白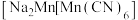 为电极的一种新型二次电池。在充放电过程中,
为电极的一种新型二次电池。在充放电过程中, 在两个电极之间往返嵌入和脱嵌。其工作原理如图所示。
在两个电极之间往返嵌入和脱嵌。其工作原理如图所示。___________ (填“Pb”或“ ”)。钠离子电池负极的电极反应式为
”)。钠离子电池负极的电极反应式为___________ 。
I.将工业废气中的
 。加氢制甲醇是“碳中和”的一个重要研究方向。在催化剂作用下主要发生如下反应:
。加氢制甲醇是“碳中和”的一个重要研究方向。在催化剂作用下主要发生如下反应:①

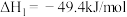
②

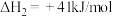
③


已知甲醇的选择性
 。
。(1)

(2)恒温恒容条件下,原料气
 、
、 与物质的量浓度之比1:3投料时,已知初始压强为4MPa,
与物质的量浓度之比1:3投料时,已知初始压强为4MPa, ,控制合适的条件(不考虑反应③)。
,控制合适的条件(不考虑反应③)。i.下列有关说法正确的是
A.反应过程中
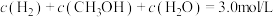
B.容器的压强不再变化时,两反应都达到平衡
C.加入反应①的催化剂,可提高平衡时甲醇的选择性
D.降低反应温度,反应①②的正、逆反应的速率都减小
ii.若平衡时甲醇的选择性为60%,
 平衡转化率为50%,该条件下反应②的
平衡转化率为50%,该条件下反应②的
II.恒压时,将3mol
 和1mol
和1mol 充入密闭溶器中进行上述反应。
充入密闭溶器中进行上述反应。(3)平衡时
 转化率
转化率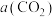 、
、 选择性
选择性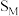 、CO选择性
、CO选择性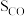 ,随温度T变化如图甲所示:
,随温度T变化如图甲所示: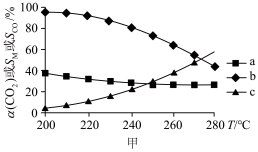
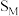 的是曲线
的是曲线(4)为了探究原料气中混入CO气体对反应的影响,测得平衡时
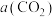 、平衡时
、平衡时 物质的量与初始
物质的量与初始 物质的量之比γ随原料气中
物质的量之比γ随原料气中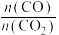 的变化如图乙所示。
的变化如图乙所示。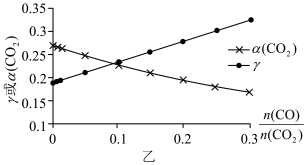
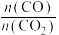 的增大,
的增大,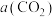 降低而γ升高的原因是
降低而γ升高的原因是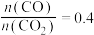 时,若平衡时
时,若平衡时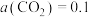 ,
, ,则
,则
III.新能源的利用对实现碳中和也有重要意义。第二代钠离子电池是以硬碳(
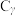 )为基底材料的嵌钠硬碳(
)为基底材料的嵌钠硬碳(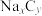 )和锰基高锰普鲁士白
)和锰基高锰普鲁士白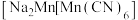 为电极的一种新型二次电池。在充放电过程中,
为电极的一种新型二次电池。在充放电过程中, 在两个电极之间往返嵌入和脱嵌。其工作原理如图所示。
在两个电极之间往返嵌入和脱嵌。其工作原理如图所示。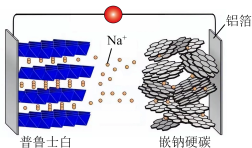
 ”)。钠离子电池负极的电极反应式为
”)。钠离子电池负极的电极反应式为
您最近一年使用:0次
解题方法
8 . 亚磷酸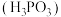 常温下电离平衡常数
常温下电离平衡常数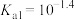 ,
, 。常温下,向
。常温下,向
 溶液中滴加
溶液中滴加 盐酸,利用电位滴定法(在化学计量点附近,指示电极电位发生突跃)得到电极电位
盐酸,利用电位滴定法(在化学计量点附近,指示电极电位发生突跃)得到电极电位 和溶液
和溶液 随盐酸体积变化曲线如下图所示。下列说法正确的是
随盐酸体积变化曲线如下图所示。下列说法正确的是
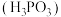 常温下电离平衡常数
常温下电离平衡常数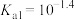 ,
, 。常温下,向
。常温下,向
 溶液中滴加
溶液中滴加 盐酸,利用电位滴定法(在化学计量点附近,指示电极电位发生突跃)得到电极电位
盐酸,利用电位滴定法(在化学计量点附近,指示电极电位发生突跃)得到电极电位 和溶液
和溶液 随盐酸体积变化曲线如下图所示。下列说法正确的是
随盐酸体积变化曲线如下图所示。下列说法正确的是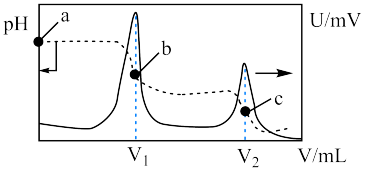
| A.滴定过程需要加入酚酞做指示剂 |
B.水的电离程度: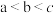 |
C. 点对应的溶液中: 点对应的溶液中: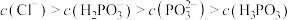 |
D. 点溶液中存在 点溶液中存在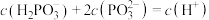 |
您最近一年使用:0次
名校
9 . 氰化物是指含有氰基或氰根离子的一类化合物,广泛应用于工业与农业中。
(1)工业上以甲烷和氨气为原料在高温和催化剂的作用下发生反应Ⅲ制备HCN。
反应Ⅰ: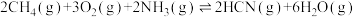
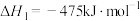
反应Ⅱ: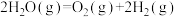
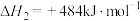
则反应Ⅲ: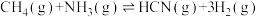

________
(2)在一定温度条件下,向1L恒容密闭容器中加入2mol 和2mol
和2mol 发生反应Ⅲ,10min时反应达到平衡, 此时
发生反应Ⅲ,10min时反应达到平衡, 此时 体积分数为30%。
体积分数为30%。
①0~10min内用 表示的平均反应速率为
表示的平均反应速率为________  。若保持温度不变,再向容器中加入
。若保持温度不变,再向容器中加入 和
和 各1mol,则此时
各1mol,则此时
________  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
②由实验得到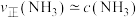 的关系可用如图甲表示。当x点升高到某一温度后,反应重新达到平衡,则x点将移动到图甲中的
的关系可用如图甲表示。当x点升高到某一温度后,反应重新达到平衡,则x点将移动到图甲中的________ 点(填字母标号)。
(3) 可做
可做 氧化废水中
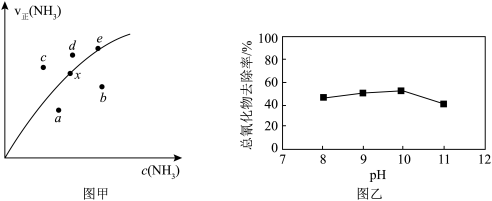
氧化废水中 的催化剂,氧化过程中总氰化物(
的催化剂,氧化过程中总氰化物( 、HCN等)去除率随溶液初始pH变化如图乙所示。当溶液初始pH>10时,在一段时间内总氰化物去除率下降的原因可能是
、HCN等)去除率随溶液初始pH变化如图乙所示。当溶液初始pH>10时,在一段时间内总氰化物去除率下降的原因可能是________ 。
(4)常温下( -
- 溶液体系中存在平衡关系:
溶液体系中存在平衡关系: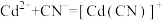 ;
;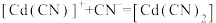 ;
;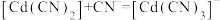 ;
;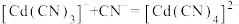 ,平衡常数依次为
,平衡常数依次为 、
、 、
、 、
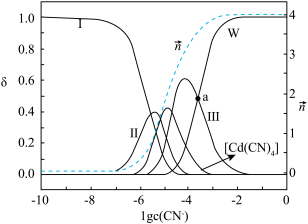
、 。含Cd物种的组分分布分数δ、平均配位数
。含Cd物种的组分分布分数δ、平均配位数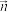 与
与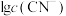 的关系如图所示。
的关系如图所示。
已知: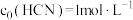 (过程中HCN浓度几乎不变),
(过程中HCN浓度几乎不变), ;
;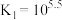 ,
,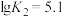 ,
, ,
,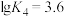 ;平均配位数
;平均配位数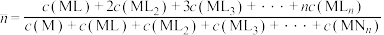 ,其中M代表中心离子,L代表配体。
,其中M代表中心离子,L代表配体。
①曲线Ⅱ代表的含Cd微粒为________ 。
②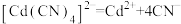 的平衡常数为
的平衡常数为________ 。
③下列有关说法中,正确的是________ 。
A.降低pH,有利于生成
B.pH=7时,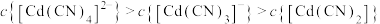
C.平衡后加水稀释,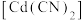 与
与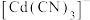 的浓度之比增大
的浓度之比增大
④a点时,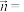
________ 。(写出计算过程,结果保留2位有效数字)。
(1)工业上以甲烷和氨气为原料在高温和催化剂的作用下发生反应Ⅲ制备HCN。
反应Ⅰ:
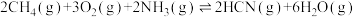
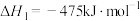
反应Ⅱ:
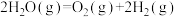
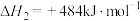
则反应Ⅲ:
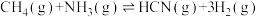

(2)在一定温度条件下,向1L恒容密闭容器中加入2mol
 和2mol
和2mol 发生反应Ⅲ,10min时反应达到平衡, 此时
发生反应Ⅲ,10min时反应达到平衡, 此时 体积分数为30%。
体积分数为30%。①0~10min内用
 表示的平均反应速率为
表示的平均反应速率为 。若保持温度不变,再向容器中加入
。若保持温度不变,再向容器中加入 和
和 各1mol,则此时
各1mol,则此时
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。②由实验得到
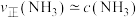 的关系可用如图甲表示。当x点升高到某一温度后,反应重新达到平衡,则x点将移动到图甲中的
的关系可用如图甲表示。当x点升高到某一温度后,反应重新达到平衡,则x点将移动到图甲中的(3)
 可做
可做 氧化废水中
氧化废水中 的催化剂,氧化过程中总氰化物(
的催化剂,氧化过程中总氰化物( 、HCN等)去除率随溶液初始pH变化如图乙所示。当溶液初始pH>10时,在一段时间内总氰化物去除率下降的原因可能是
、HCN等)去除率随溶液初始pH变化如图乙所示。当溶液初始pH>10时,在一段时间内总氰化物去除率下降的原因可能是
(4)常温下(
 -
- 溶液体系中存在平衡关系:
溶液体系中存在平衡关系: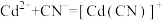 ;
;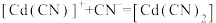 ;
;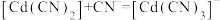 ;
;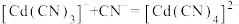 ,平衡常数依次为
,平衡常数依次为 、
、 、
、 、
、 。含Cd物种的组分分布分数δ、平均配位数
。含Cd物种的组分分布分数δ、平均配位数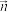 与
与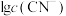 的关系如图所示。
的关系如图所示。
已知:
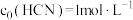 (过程中HCN浓度几乎不变),
(过程中HCN浓度几乎不变), ;
;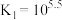 ,
,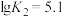 ,
, ,
,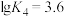 ;平均配位数
;平均配位数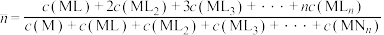 ,其中M代表中心离子,L代表配体。
,其中M代表中心离子,L代表配体。①曲线Ⅱ代表的含Cd微粒为
②
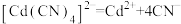 的平衡常数为
的平衡常数为③下列有关说法中,正确的是
A.降低pH,有利于生成

B.pH=7时,
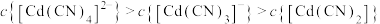
C.平衡后加水稀释,
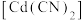 与
与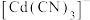 的浓度之比增大
的浓度之比增大④a点时,
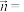
您最近一年使用:0次
名校
10 . 铜及其化合物是高中化学的重要组成部分,在工农业生产中具有重要的应用。
(1)在农业上可用含铜的波尔多液作为农药,配制波尔多液需要___________ (填化学式)。
(2)已知CuCl在氨水中络合后极易被空气中的 氧化。
氧化。
①补齐下列离子方程式:__________ 。
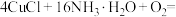 ___________
___________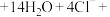 ___________
___________
②现将Cu置于 溶液中,通入
溶液中,通入 ,反应1小时,测得体系中铜离子总浓度为160mg/L,Cu的溶解速率为
,反应1小时,测得体系中铜离子总浓度为160mg/L,Cu的溶解速率为___________ 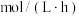 。
。
(3)查阅文献:在无氧条件下CuCl在氨水溶液中存下如下平衡(含足量CuCl固体)
ⅰ:

ⅱ: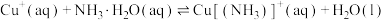

ⅲ: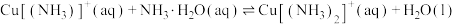
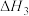
①反应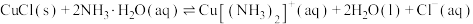
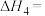
___________ (用 、
、 、
、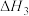 来表示);在上述反应中,配原子是
来表示);在上述反应中,配原子是___________ (填元素符号)。
②对于上述相关平衡体系,下列说法不正确的是:___________ (填编号)
A.加水稀释,平衡后溶液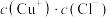 不变
不变
B.向体系中通入 ,有利于提高
,有利于提高 平衡转化率
平衡转化率
C.升高温度,有利于生成
D.溶液中存在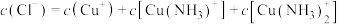
③向一定浓度的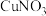 溶液中通入足量
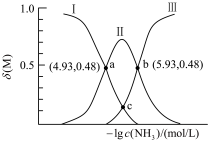
溶液中通入足量 得到澄清溶液(设溶液体积不变),测得平衡体系中含铜微粒分布系数
得到澄清溶液(设溶液体积不变),测得平衡体系中含铜微粒分布系数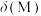 与
与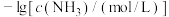 关系如下图所示(其中M代表体系中含铜微粒)。如
关系如下图所示(其中M代表体系中含铜微粒)。如 的分布系数
的分布系数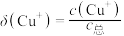 ,
, 。
。___________ 分布系数(填离子符号)。
(b)反应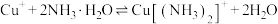 的
的
___________ 。(已知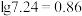 )
)
(c)c点的坐标为___________ 。(已知 )
)
(1)在农业上可用含铜的波尔多液作为农药,配制波尔多液需要
(2)已知CuCl在氨水中络合后极易被空气中的
 氧化。
氧化。①补齐下列离子方程式:
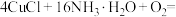 ___________
___________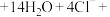 ___________
___________②现将Cu置于
 溶液中,通入
溶液中,通入 ,反应1小时,测得体系中铜离子总浓度为160mg/L,Cu的溶解速率为
,反应1小时,测得体系中铜离子总浓度为160mg/L,Cu的溶解速率为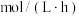 。
。(3)查阅文献:在无氧条件下CuCl在氨水溶液中存下如下平衡(含足量CuCl固体)
ⅰ:


ⅱ:
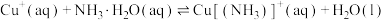

ⅲ:
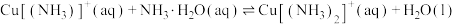
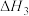
①反应
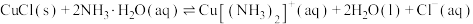
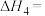
 、
、 、
、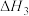 来表示);在上述反应中,配原子是
来表示);在上述反应中,配原子是②对于上述相关平衡体系,下列说法不正确的是:
A.加水稀释,平衡后溶液
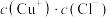 不变
不变B.向体系中通入
 ,有利于提高
,有利于提高 平衡转化率
平衡转化率C.升高温度,有利于生成

D.溶液中存在
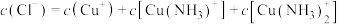
③向一定浓度的
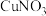 溶液中通入足量
溶液中通入足量 得到澄清溶液(设溶液体积不变),测得平衡体系中含铜微粒分布系数
得到澄清溶液(设溶液体积不变),测得平衡体系中含铜微粒分布系数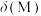 与
与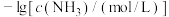 关系如下图所示(其中M代表体系中含铜微粒)。如
关系如下图所示(其中M代表体系中含铜微粒)。如 的分布系数
的分布系数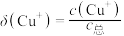 ,
, 。
。
(b)反应
 的
的
 )
)(c)c点的坐标为
 )
)
您最近一年使用:0次



