解题方法
1 . 我国承诺 2030年前做到“碳达峰和碳中和”,这里的碳主要指CO2, CO2与我们生活和生产息息相关。请回答:
(1)工业上常用CO和CO2与氢气反应制备甲醇,涉及的反应有:
主反应:
I . CO(g)+2H2(g) CH3OH(g) △H1= -90.7 kJ·mol-1
CH3OH(g) △H1= -90.7 kJ·mol-1
II. CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2= -49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H2= -49.0 kJ·mol-1
副反应:
III. CO(g)+H2O(g) CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3
IV. 2CH3OH(g) CH3OCH3(g)+H2O(g) △H4= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H4= -23.5 kJ·mol-1
请回答:
①△H3=________ kJ·mol-1。
②现利用I和II两个反应合成CH3OH,已知CO可使反应的催化剂寿命降低。若氢碳比表示为x= ,则理论上x=
,则理论上x=_______ 时,原料气的利用率最高。但生产中往往采用略高于该值的氢碳比,理由是___________ 。
(2)CO2甲烷化技术是碳中和理念的落脚点之一,反应为CO2(g)+ 4H2(g) CH4(g)+2H2O(g) △H= -165kJ·mol-1,其核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示。
CH4(g)+2H2O(g) △H= -165kJ·mol-1,其核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示。
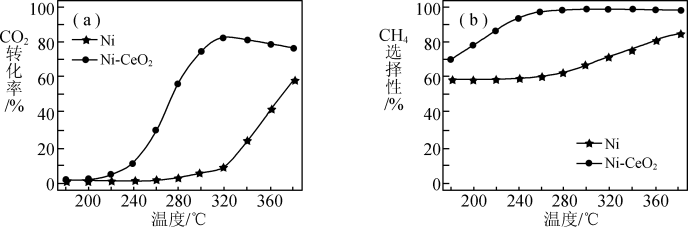
下列说法正确的是 。
(3)CO2可以与环氧丙烷反应合成碳酸丙烯酯:
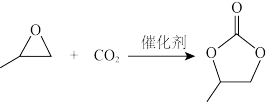 △H= - 110.5kJ·mol-1
△H= - 110.5kJ·mol-1
通过模型假设和理论计算,推测其反应历程如下图所示(*表示某催化剂的活化中心或活性基团):
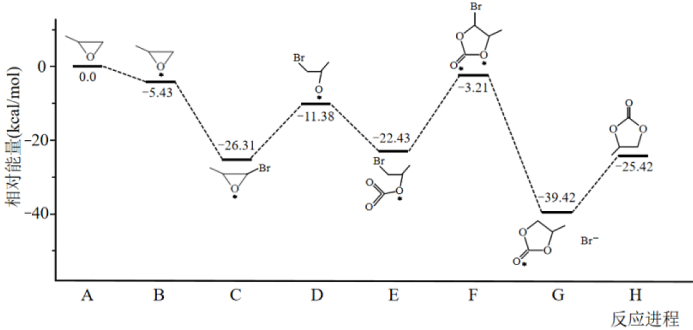
①决定总反应速率大小的步骤是______ (用图中字母表示), 该步骤的能垒(活化能)为_________ 。
②下列说法正确的是__________ 。
A.A →B能量降低,所以该过程必定自发
B.总反应为加成反应,D、F为过渡态,C、E为中间产物
C. D分子中氧原子带负电荷,强烈吸引CO2分子中的碳原子生成E,使体系能量降低
D.反应热的理论值(-25.42)与某次实测值(-110.5)相差太大,说明理论值几乎没有参考价值
(4)用CO2催化加氢可以合成低碳烯烃。反应开始时在0.1MPa 条件下,以n(H2) :n(CO2)=3:1的投料比充入体积固定的密闭容器中,发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g),不同温度下平衡时的四种气态物质的物质的量百分数如下图甲所示:
C2H4(g)+4H2O(g),不同温度下平衡时的四种气态物质的物质的量百分数如下图甲所示:
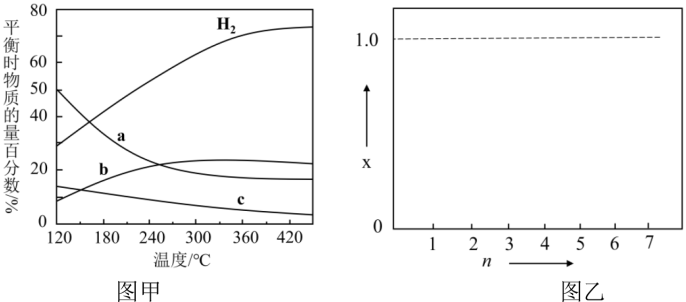
在120°C达到平衡时,CO2的转化率为________ ;若H2和CO2的物质的量之比为 n:1 (n≥3)进行投料,温度控制为120°C,相应平衡体系中CO2的转化率为x,在图乙中绘制x随n (n≥3 )变化的示意图________ (标出曲线的起点坐标)。
(1)工业上常用CO和CO2与氢气反应制备甲醇,涉及的反应有:
主反应:
I . CO(g)+2H2(g)
 CH3OH(g) △H1= -90.7 kJ·mol-1
CH3OH(g) △H1= -90.7 kJ·mol-1II. CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2= -49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H2= -49.0 kJ·mol-1副反应:
III. CO(g)+H2O(g)
 CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3IV. 2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H4= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H4= -23.5 kJ·mol-1请回答:
①△H3=
②现利用I和II两个反应合成CH3OH,已知CO可使反应的催化剂寿命降低。若氢碳比表示为x=
 ,则理论上x=
,则理论上x=(2)CO2甲烷化技术是碳中和理念的落脚点之一,反应为CO2(g)+ 4H2(g)
 CH4(g)+2H2O(g) △H= -165kJ·mol-1,其核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示。
CH4(g)+2H2O(g) △H= -165kJ·mol-1,其核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示。
下列说法正确的是 。
| A.高于320°C后,以Ni- CeO2为催化剂,CO2转化率略有下降的原因一定是CO2甲烷化反应已达平衡,升高温度平衡右移 |
| B.高于320°C后,以Ni为催化剂,CO2转化率上升的原因一定是CO2甲烷化反应速率较慢,升高温度反应速率加快,反应相同时间时CO2转化率增加 |
| C.工业上应选择的催化剂是Ni- CeO2 |
| D.工业上应使用的合适温度为360°C |
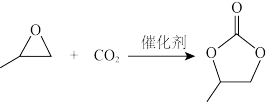 △H= - 110.5kJ·mol-1
△H= - 110.5kJ·mol-1通过模型假设和理论计算,推测其反应历程如下图所示(*表示某催化剂的活化中心或活性基团):

①决定总反应速率大小的步骤是
②下列说法正确的是
A.A →B能量降低,所以该过程必定自发
B.总反应为加成反应,D、F为过渡态,C、E为中间产物
C. D分子中氧原子带负电荷,强烈吸引CO2分子中的碳原子生成E,使体系能量降低
D.反应热的理论值(-25.42)与某次实测值(-110.5)相差太大,说明理论值几乎没有参考价值
(4)用CO2催化加氢可以合成低碳烯烃。反应开始时在0.1MPa 条件下,以n(H2) :n(CO2)=3:1的投料比充入体积固定的密闭容器中,发生反应:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g),不同温度下平衡时的四种气态物质的物质的量百分数如下图甲所示:
C2H4(g)+4H2O(g),不同温度下平衡时的四种气态物质的物质的量百分数如下图甲所示:
在120°C达到平衡时,CO2的转化率为
您最近一年使用:0次
2 . 甲醇是重要的化工原料,工业上可利用 生产甲醇,同时可减少温室气体二氧化碳,发生反应①:
生产甲醇,同时可减少温室气体二氧化碳,发生反应①:

(1)下列措施中,能提高 平衡转化率的是___________。
平衡转化率的是___________。
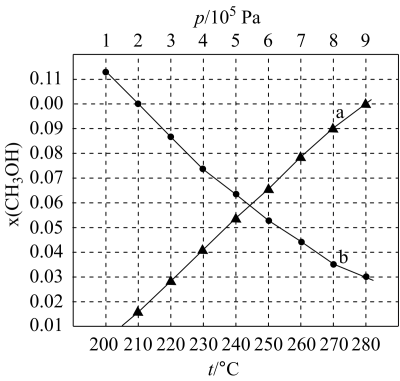
(2)当起始物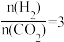 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为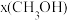 ,在
,在 下的
下的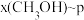 、在
、在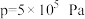 下的
下的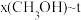 如图所示。当
如图所示。当 的平衡转化率为
的平衡转化率为 时,反应条件可能是
时,反应条件可能是___________ 。
(3)在某催化剂作用下, 和
和 除发生反应①外,还发生反应②:
除发生反应①外,还发生反应②:
 。维持压强不变,按固定初始投料比将
。维持压强不变,按固定初始投料比将 和
和 按一定流速通过该催化剂,经相同时间测得实验数据:
按一定流速通过该催化剂,经相同时间测得实验数据:
注:甲醇的选择性是指发生反应的 中转化为甲醇的百分比。
中转化为甲醇的百分比。
表中数据说明,升高温度, 的实际转化率提高而甲醇的选择性降低,其原因是
的实际转化率提高而甲醇的选择性降低,其原因是___________ 。
(4)甲醇催化制取丙烯的过程中发生反应: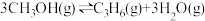 ,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为
,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为 (
( 为活化能,k为速率常数,R和C为常数)。
为活化能,k为速率常数,R和C为常数)。
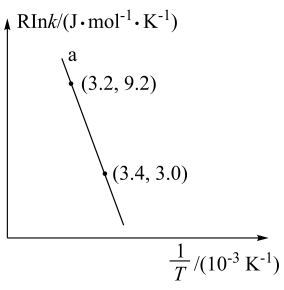
①反应的活化能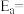
__  。
。
②当使用更高效催化剂时,在图中画出 与
与 关系的示意图
关系的示意图__ 。
 生产甲醇,同时可减少温室气体二氧化碳,发生反应①:
生产甲醇,同时可减少温室气体二氧化碳,发生反应①:

(1)下列措施中,能提高
 平衡转化率的是___________。
平衡转化率的是___________。A.在原料气中加入适量 | B.从体系中不断分离出甲醇 |
| C.循环利用原料气 | D.使用高效催化剂 |
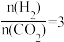 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为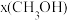 ,在
,在 下的
下的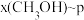 、在
、在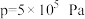 下的
下的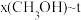 如图所示。当
如图所示。当 的平衡转化率为
的平衡转化率为 时,反应条件可能是
时,反应条件可能是
(3)在某催化剂作用下,
 和
和 除发生反应①外,还发生反应②:
除发生反应①外,还发生反应②:
 。维持压强不变,按固定初始投料比将
。维持压强不变,按固定初始投料比将 和
和 按一定流速通过该催化剂,经相同时间测得实验数据:
按一定流速通过该催化剂,经相同时间测得实验数据: |  实际转化率(%) 实际转化率(%) | 甲醇选择性(%) |
| 543 | 12.3 | 42.3 |
| 553 | 15.3 | 39.1 |
 中转化为甲醇的百分比。
中转化为甲醇的百分比。表中数据说明,升高温度,
 的实际转化率提高而甲醇的选择性降低,其原因是
的实际转化率提高而甲醇的选择性降低,其原因是(4)甲醇催化制取丙烯的过程中发生反应:
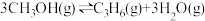 ,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为
,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为 (
( 为活化能,k为速率常数,R和C为常数)。
为活化能,k为速率常数,R和C为常数)。
①反应的活化能
 。
。②当使用更高效催化剂时,在图中画出
 与
与 关系的示意图
关系的示意图
您最近一年使用:0次
名校
解题方法
3 . X由4种元素组成的化合物,按如下流程进行实验。已知:液体X被H2O2氧化的过程中转移电子数为1.8NA。当加入适量Ba(OH)2溶液时,使溶液C成中性(不考虑盐类水解的影响),产生81.55g沉淀B,继续滴加过量Ba(OH)2溶液,沉淀B增加至93.2g;溶液C焰色反应透过蓝色钴玻璃观察火焰呈紫色。
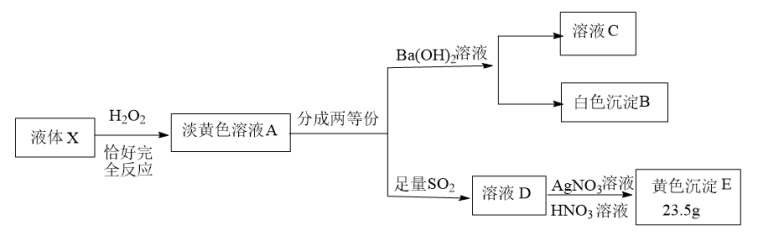
请回答:
(1)X组成元素:O和___________ (元素符号),化学式___________ ;
(2)写出X和双氧水反应的化学方程式___________ ;
(3)写出SO2和淡黄色溶液A反应的离子方程式___________ ;
(4)实验中溶液A呈淡黄色原因是含有某种物质,简述如何从溶液A中分离出该物质:___________ 。

请回答:
(1)X组成元素:O和
(2)写出X和双氧水反应的化学方程式
(3)写出SO2和淡黄色溶液A反应的离子方程式
(4)实验中溶液A呈淡黄色原因是含有某种物质,简述如何从溶液A中分离出该物质:
您最近一年使用:0次
2021-11-03更新
|
593次组卷
|
2卷引用:浙江省诸暨市2020-2021学年高二下学期期末考试化学试题
4 . 固体化合物 由4种元素组成,某学习小组开展如图探究实验:
由4种元素组成,某学习小组开展如图探究实验:
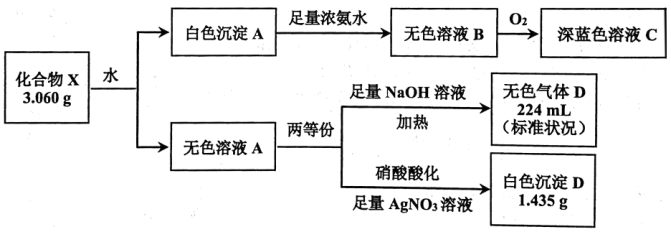
已知:白色沉淀 仅含两种元素。溶液
仅含两种元素。溶液 和溶液
和溶液 中阳离子由相同元素组成,且完全转化时,消耗标准状况下
中阳离子由相同元素组成,且完全转化时,消耗标准状况下 ,同时消耗
,同时消耗 。
。
请回答:
(1)无色气体 的电子式是
的电子式是_______ 。
(2)化合物 中的金属元素是
中的金属元素是_______ (填写元素符号),化学式是_______ 。
(3)写出无色溶液 转化为深蓝色溶液
转化为深蓝色溶液 的离子方程式
的离子方程式_______ 。
(4)白色沉淀 加水煮沸得到绿色溶液(溶质的元素组成与沉淀
加水煮沸得到绿色溶液(溶质的元素组成与沉淀 相同),并转化为红色固体,该红色固体由一种单质和一种氧化物组成。
相同),并转化为红色固体,该红色固体由一种单质和一种氧化物组成。
①写出上述反应的化学方程式_______ 。
②设计实验方案证明红色固体是混合物_______ 。
 由4种元素组成,某学习小组开展如图探究实验:
由4种元素组成,某学习小组开展如图探究实验:
已知:白色沉淀
 仅含两种元素。溶液
仅含两种元素。溶液 和溶液
和溶液 中阳离子由相同元素组成,且完全转化时,消耗标准状况下
中阳离子由相同元素组成,且完全转化时,消耗标准状况下 ,同时消耗
,同时消耗 。
。请回答:
(1)无色气体
 的电子式是
的电子式是(2)化合物
 中的金属元素是
中的金属元素是(3)写出无色溶液
 转化为深蓝色溶液
转化为深蓝色溶液 的离子方程式
的离子方程式(4)白色沉淀
 加水煮沸得到绿色溶液(溶质的元素组成与沉淀
加水煮沸得到绿色溶液(溶质的元素组成与沉淀 相同),并转化为红色固体,该红色固体由一种单质和一种氧化物组成。
相同),并转化为红色固体,该红色固体由一种单质和一种氧化物组成。①写出上述反应的化学方程式
②设计实验方案证明红色固体是混合物
您最近一年使用:0次
2021-09-02更新
|
902次组卷
|
2卷引用:浙江省“七彩阳光”2022届新高考研究联盟返校考试化学试题
5 . 利用皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管可以合成T-碳,T-碳的晶体结构可看成金刚石晶体中每个碳原子被正四面体结构单元(由四个碳原子组成)取代,如图所示。T-碳的密度非常小,约为金刚石的一半。下列说法正确的是


| A.T-碳与金刚石互为同素异形体 |
| B.一个T-碳晶胞中含有32个碳原子 |
| C.T-碳晶胞的边长和金刚石晶胞的边长之比为1:2 |
| D.T-碳的硬度比金刚石小 |
您最近一年使用:0次
2021-07-12更新
|
916次组卷
|
2卷引用:第34届(2021年)高中化学奥林匹克竞赛浙江省预赛试题
6 . 在6℃时Q在苯和水中的分配情况见表。表中cB和cw分别表示Q在苯和水中的平衡浓度,从表中数据计算发现 几乎是一个常数。假定Q在苯中的物种是唯一的。并与温度、浓度无关,进一步假定Q在水中是单体,Q在苯中的存在形式是
几乎是一个常数。假定Q在苯中的物种是唯一的。并与温度、浓度无关,进一步假定Q在水中是单体,Q在苯中的存在形式是
 几乎是一个常数。假定Q在苯中的物种是唯一的。并与温度、浓度无关,进一步假定Q在水中是单体,Q在苯中的存在形式是
几乎是一个常数。假定Q在苯中的物种是唯一的。并与温度、浓度无关,进一步假定Q在水中是单体,Q在苯中的存在形式是| cB(mol·L-1) | cW(mol·L-1) | cB (mol·L-1) | cw (mol·L-1) |
| 0.0118 | 0.00281 | 0.0981 | 0.00812 |
| 0.0478 | 0.00566 | 0.156 | 0.0102 |
| A.单体 | B.二聚体 | C.三聚体 | D.无法计算 |
您最近一年使用:0次
7 . 卡尔-费休法是测定有机溶剂中的微量水含量的经典方法。所用试剂由碘、二氧化硫、吡啶(C5H5N, 有机碱,与H+反应生成C5H5NH+)和无水甲醇按一定比例配制而成。该试剂与待测溶剂中的水反应后,产物的含量用库仑滴定法来测定。下列说法错误的是
A.该方法的基本原理是利用碘与二氧化硫反应,离子方程式为:I2+ SO2 + 2H2O =2H+ +SO + 2HI + 2HI |
| B.加入吡啶的作用是中和产生的酸,促进反应进行完全 |
| C.加入甲醇可以进一步稳定产物, 生成C5H5NHSO4CH3 |
| D.总反应可表示为:I2+SO2+H2O+3C5H5N+CH3OH=C5H5NHSO4CH3+2C5H5NHI |
您最近一年使用:0次
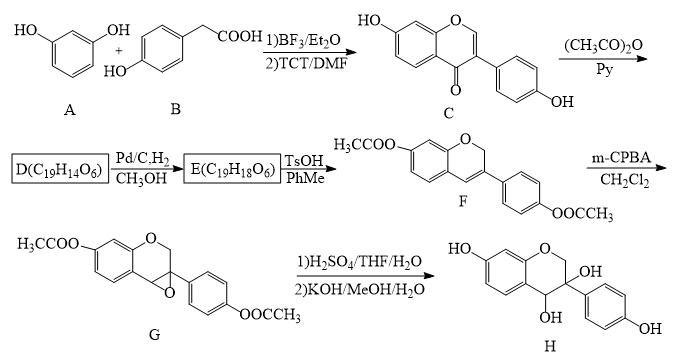
8 . 近年来,以大豆素(化合物C)为主要成分的大豆异黄酮及其衍生物,因其具有优良的生理活性而备受关注。大豆素的合成及其衍生化的一种工艺路线如下:
(1)A的化学名称为_______ 。
(2)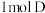 反应生成E至少需要
反应生成E至少需要_______  氢气。
氢气。
(3)写出E中任意两种含氧官能团的名称_______ 。
(4)由E生成F的化学方程式为_______ 。
(5)由G生成H分两步进行:反应1)是在酸催化下水与环氧化合物的加成反应,则反应2)的反应类型为_______ 。
(6)化合物B的同分异构体中能同时满足下列条件的有_______ (填标号)。
a.含苯环的醛、酮
b.不含过氧键(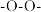 )
)
c.核磁共振氢谱显示四组峰,且峰面积比为3∶2∶2∶1
A.2个 B.3个 C.4个 D.5个
(7)根据上述路线中的相关知识,以丙烯为主要原料用不超过三步的反应设计合成下图有机物,写出合成路线_______ 。
(1)A的化学名称为
(2)
 反应生成E至少需要
反应生成E至少需要 氢气。
氢气。(3)写出E中任意两种含氧官能团的名称
(4)由E生成F的化学方程式为
(5)由G生成H分两步进行:反应1)是在酸催化下水与环氧化合物的加成反应,则反应2)的反应类型为
(6)化合物B的同分异构体中能同时满足下列条件的有
a.含苯环的醛、酮
b.不含过氧键(
 )
)c.核磁共振氢谱显示四组峰,且峰面积比为3∶2∶2∶1
A.2个 B.3个 C.4个 D.5个
(7)根据上述路线中的相关知识,以丙烯为主要原料用不超过三步的反应设计合成下图有机物,写出合成路线
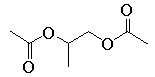
您最近一年使用:0次
2021-06-11更新
|
21691次组卷
|
24卷引用:考点41 合成高分子 有机合成-备战2022年高考化学一轮复习考点帮(浙江专用)
(已下线)考点41 合成高分子 有机合成-备战2022年高考化学一轮复习考点帮(浙江专用)2021年高考全国甲卷化学真题山东省新泰中学2020-2021学年高二下学期第二次阶段性考试化学试题(已下线)考点40 有机合成高分子-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)2021年高考全国甲卷化学试题变式题(已下线)专题15 有机化学基础-备战2022年高考化学学霸纠错(全国通用)(已下线)解密12 有机化学基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密12 有机化学基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题20 有机化学基础-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题14 有机化学基础—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)回归教材重难点12 有机化学基础(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)押全国卷理综第36题 有机化学基础-备战2022年高考化学临考题号押题(课标全国卷)(已下线)专题19有机化学基础(选修)-五年(2018~2022)高考真题汇编(全国卷)专题4 生活中常用的有机物——烃的含氧衍生物 第一~二单元综合拔高练第三~五节综合拔高练(已下线)微专题48 限定条件下的同分异构体的书写判断-备战2023年高考化学一轮复习考点微专题(已下线)专题04 有机化学专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)江苏省南京师范大学附属中学江宁分校2022-2023学年高二下学期期中考试化学试题(已下线)专题21 有机推断题(已下线)专题21 有机推断题(已下线)专题17 有机化学基础综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点40 有机合成(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第37讲有机合成及推断(已下线)考点5 有机合成及推断(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
20-21高二下·浙江·阶段练习
解题方法
9 . 按要求填空:
(1)(CH3)2CHCH2CH2OH的系统命名为_______
(2)松油醇(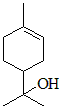 )的分子式为
)的分子式为_______
(3)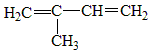 与Br2按1:1比例反应,所得产物有
与Br2按1:1比例反应,所得产物有_______ 种 (不考虑顺反异构)
(4)相对分子质量为58的某有机物,若该有机物lmol能与足量银氨溶液作用可析出4molAg,写出此反应的化学方程式:_______
(1)(CH3)2CHCH2CH2OH的系统命名为
(2)松油醇(
 )的分子式为
)的分子式为(3)
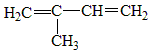 与Br2按1:1比例反应,所得产物有
与Br2按1:1比例反应,所得产物有(4)相对分子质量为58的某有机物,若该有机物lmol能与足量银氨溶液作用可析出4molAg,写出此反应的化学方程式:
您最近一年使用:0次
20-21高二下·浙江·阶段练习
10 . 某兴趣小组对化合物X开展实验探究。
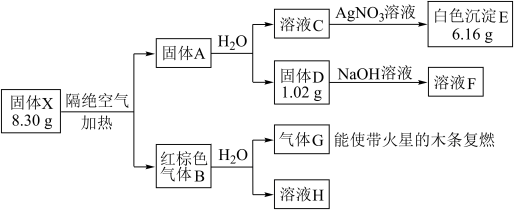
其中:X是易溶于水的强酸盐,由4种元素组成;D、E、G均为纯净物,B为混合物;溶液C、F、H均为单一溶质溶液,溶液H中含溶质0.06 mol,溶液C的焰色反应通过蓝色钴玻璃观察为紫色。
(1)组成X的4种元素是_______________ (填元素符号),E的化学式是______________ 。
(2)固体X隔绝空气加热分解的化学方程式____________________________ 。
(3)写出溶液F与少量溶液H反应的离子方程式____________________________ 。
(4)标况下,将红棕色气体B收集在一个大试管中,再倒插在水槽中,得到溶液的浓度为_______ mol/L (设溶质不扩散,)。
(5)写出红棕色气体B中的化合物气体(在答案中写出化学式)与溴蒸气的鉴别方法:______________ 。

其中:X是易溶于水的强酸盐,由4种元素组成;D、E、G均为纯净物,B为混合物;溶液C、F、H均为单一溶质溶液,溶液H中含溶质0.06 mol,溶液C的焰色反应通过蓝色钴玻璃观察为紫色。
(1)组成X的4种元素是
(2)固体X隔绝空气加热分解的化学方程式
(3)写出溶液F与少量溶液H反应的离子方程式
(4)标况下,将红棕色气体B收集在一个大试管中,再倒插在水槽中,得到溶液的浓度为
(5)写出红棕色气体B中的化合物气体(在答案中写出化学式)与溴蒸气的鉴别方法:
您最近一年使用:0次



