名校
解题方法
1 . 铜及其化合物在机械制造、国防建设中有着广泛的应用。回答下列问题:
(1)铜元素在元素周期表中的位置是___________ ,已知高温下 比CuO稳定,从核外电子排布角度解释高温下
比CuO稳定,从核外电子排布角度解释高温下 更稳定的原因
更稳定的原因___________ 。
(2)一个 晶胞(见下图)中,晶胞中
晶胞(见下图)中,晶胞中 离子的数目为
离子的数目为___________ 。 和
和 的熔点比较,熔点较高的是
的熔点比较,熔点较高的是___________ ,解释原因___________ 。
(4) 与
与 、
、 、
、 均可形成配位数为4的配离子:
均可形成配位数为4的配离子: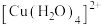 、
、 ,
,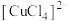 。其转化关系如图所示:
。其转化关系如图所示: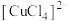 呈黄色,溶液Ⅰ加水稀释呈蓝色,其原因是
呈黄色,溶液Ⅰ加水稀释呈蓝色,其原因是___________ 。
② 与
与 的结合能力
的结合能力___________ (填“>”、“=”或“<”) 与
与 的结合能力。
的结合能力。
③若 中两个
中两个 分别被
分别被 取代,能得到(m)、(n)两种不同结构的
取代,能得到(m)、(n)两种不同结构的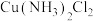 ;
; 的空间构型是
的空间构型是___________ ;。
在有机溶剂的溶解度:(m)___________ (n)(填“>”、“=”或“<”)。
(5)Cu是叶绿素的必要成分,叶绿素的结构如下图,请回答相关问题: 与N原子之间形成的化学键称为
与N原子之间形成的化学键称为___________ 。
②构成叶绿素的非金属元素中,N和O第一电离能较大的为___________ ,请从原子结构角度解释原因___________ 。
(1)铜元素在元素周期表中的位置是
 比CuO稳定,从核外电子排布角度解释高温下
比CuO稳定,从核外电子排布角度解释高温下 更稳定的原因
更稳定的原因(2)一个
 晶胞(见下图)中,晶胞中
晶胞(见下图)中,晶胞中 离子的数目为
离子的数目为
 和
和 的熔点比较,熔点较高的是
的熔点比较,熔点较高的是(4)
 与
与 、
、 、
、 均可形成配位数为4的配离子:
均可形成配位数为4的配离子: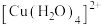 、
、 ,
,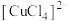 。其转化关系如图所示:
。其转化关系如图所示: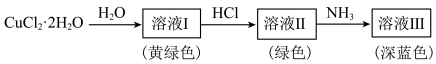
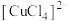 呈黄色,溶液Ⅰ加水稀释呈蓝色,其原因是
呈黄色,溶液Ⅰ加水稀释呈蓝色,其原因是②
 与
与 的结合能力
的结合能力 与
与 的结合能力。
的结合能力。③若
 中两个
中两个 分别被
分别被 取代,能得到(m)、(n)两种不同结构的
取代,能得到(m)、(n)两种不同结构的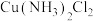 ;
;
 的空间构型是
的空间构型是在有机溶剂的溶解度:(m)
(5)Cu是叶绿素的必要成分,叶绿素的结构如下图,请回答相关问题:

 与N原子之间形成的化学键称为
与N原子之间形成的化学键称为②构成叶绿素的非金属元素中,N和O第一电离能较大的为
您最近一年使用:0次
2 . 上海有机化学研究所施世良课题组以Ni(cod)2为催化剂实现了叔醇的手性合成。
(1)Ni在元素周期表中的位置是___________ ,写出其基态原子的最外层电子排布图:___________ 。
(2)Ni(cod)2是指双-(1,5-环辛二烯)镍,其结构如图所示。___________ 种。
②Ni(cod)2分子内存在的作用力有___________ (填序号)。
a.配位键 b.金属键 c.极性键 d.非极性键 e.氢键
(3)葡萄糖(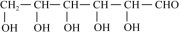 )分子中,手性碳原子个数为
)分子中,手性碳原子个数为 ___________ 。
(4)红银矿NiAs晶体结构如图所示:___________ 。
②两个As原子的原子分数坐标依次为( ,
, ,
, )和
)和___________ 。
③已知晶体密度为pg·cm-3,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则阿伏加德罗常数NA可表示为___________ mol-1(用含m、n和p的代数式表示)。
(1)Ni在元素周期表中的位置是
(2)Ni(cod)2是指双-(1,5-环辛二烯)镍,其结构如图所示。
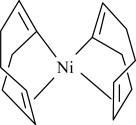
②Ni(cod)2分子内存在的作用力有
a.配位键 b.金属键 c.极性键 d.非极性键 e.氢键
(3)葡萄糖(
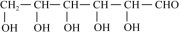 )分子中,手性碳原子个数为
)分子中,手性碳原子个数为 (4)红银矿NiAs晶体结构如图所示:
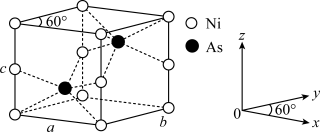
②两个As原子的原子分数坐标依次为(
 ,
, ,
, )和
)和③已知晶体密度为pg·cm-3,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则阿伏加德罗常数NA可表示为
您最近一年使用:0次
名校
3 . 化合物K有抗高血压活性,其合成路线如下。___________ 。
(2)B→D的化学方程式是___________ 。
(3)G的结构简式是___________ 。
(4)E属于酯,E的结构简式是___________ 。
(5)K中能与 溶液反应的官能团有
溶液反应的官能团有___________ 。
a.碳碳双键 b.酯基 c.酰胺基
(6)D也可由间硝基甲苯通过电解法制得,主要物质转化关系如下。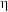 的定义:
的定义: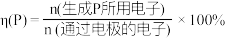
①Ⅱ中,生成Q的离子方程式是___________ 。
②若电解产生的 使间硝基甲苯通过两步氧化完全转化为D,当电极通过
使间硝基甲苯通过两步氧化完全转化为D,当电极通过 ,生成amol D时,
,生成amol D时,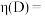
___________ 。
(7)以D、F和 为原料,“一锅法”合成G的转化过程如下。
为原料,“一锅法”合成G的转化过程如下。___________ ,M→N的反应类型是___________ 。
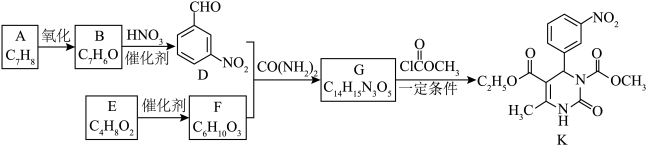
已知:
(2)B→D的化学方程式是
(3)G的结构简式是
(4)E属于酯,E的结构简式是
(5)K中能与
 溶液反应的官能团有
溶液反应的官能团有a.碳碳双键 b.酯基 c.酰胺基
(6)D也可由间硝基甲苯通过电解法制得,主要物质转化关系如下。
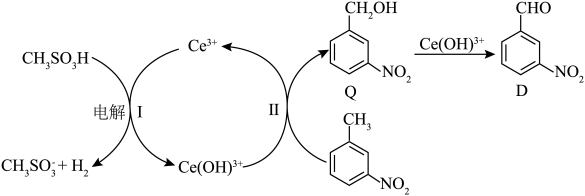
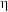 的定义:
的定义: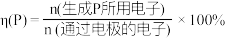
①Ⅱ中,生成Q的离子方程式是
②若电解产生的
 使间硝基甲苯通过两步氧化完全转化为D,当电极通过
使间硝基甲苯通过两步氧化完全转化为D,当电极通过 ,生成amol D时,
,生成amol D时,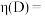
(7)以D、F和
 为原料,“一锅法”合成G的转化过程如下。
为原料,“一锅法”合成G的转化过程如下。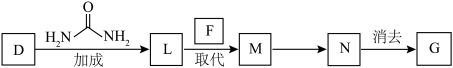
您最近一年使用:0次
2024-04-10更新
|
492次组卷
|
2卷引用:北京市西城区2024届高三统一测试(一模)化学试题
名校
解题方法
4 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
(1)元素 在元素周期表中的位置为第
在元素周期表中的位置为第______ 周期第______ 族。
(2) 的最高化合价为
的最高化合价为______ , 的最高价氧化物对应的水化物的化学式为
的最高价氧化物对应的水化物的化学式为______ , 的最高价氧化物为
的最高价氧化物为______ 。
(3)根据元素周期律,推断:
①阴影部分元素简单气态氢化物热稳定性最强的是______ 元素(填元素符号)。
②酸性:
______ (填“>”“<”或“=”,下同) 。
。
③氢化物的还原性:
______  。
。
④原子半径:
______  。
。
(4)可在图中分界线(虚线)附近寻找______ (填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料
(5)从下列试剂中选择最佳试剂组合,比较 、
、 的非金属性强弱:
的非金属性强弱:______ 。(可供选择的药品有 固体、稀硫酸、盐酸、饱和
固体、稀硫酸、盐酸、饱和 溶液、饱和
溶液、饱和 溶液、硅酸钠溶液)
溶液、硅酸钠溶液)

(1)元素
 在元素周期表中的位置为第
在元素周期表中的位置为第(2)
 的最高化合价为
的最高化合价为 的最高价氧化物对应的水化物的化学式为
的最高价氧化物对应的水化物的化学式为 的最高价氧化物为
的最高价氧化物为(3)根据元素周期律,推断:
①阴影部分元素简单气态氢化物热稳定性最强的是
②酸性:

 。
。③氢化物的还原性:

 。
。④原子半径:

 。
。(4)可在图中分界线(虚线)附近寻找
A.优良的催化剂 B.半导体材料 C.合金材料
(5)从下列试剂中选择最佳试剂组合,比较
 、
、 的非金属性强弱:
的非金属性强弱: 固体、稀硫酸、盐酸、饱和
固体、稀硫酸、盐酸、饱和 溶液、饱和
溶液、饱和 溶液、硅酸钠溶液)
溶液、硅酸钠溶液)
您最近一年使用:0次
2020-09-08更新
|
1586次组卷
|
6卷引用:2024届高考化学考点剖析精创专题卷——专题七 物质结构 元素周期律
名校
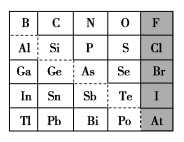
5 . 已知 A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物。其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1 mol 丁分子中不同原子的数目比为1 :2,且含有18 mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用。各物质间的转化关系如下图所示(某些条件已略去)。
(1)单质B的组成元素在周期表中的位置是___________ 。
(2)写出戊与强碱反应的离子方程式:___________ 。
(3)丁中所包含的化学键类型有___________ (填字母序号)。
a.离子键 b.极性共价键 c.非极性共价键
(4)反应①的化学方程式为___________ 。
(5)反应②中,0.5molNaClO参加反应时,转移1mol电子,其化学方程式为___________ 。
(6)—定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知该反应生成1mol乙时放出536kJ热量,其热化学方程式为___________ 。
(1)单质B的组成元素在周期表中的位置是
(2)写出戊与强碱反应的离子方程式:
(3)丁中所包含的化学键类型有
a.离子键 b.极性共价键 c.非极性共价键
(4)反应①的化学方程式为
(5)反应②中,0.5molNaClO参加反应时,转移1mol电子,其化学方程式为
(6)—定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知该反应生成1mol乙时放出536kJ热量,其热化学方程式为
您最近一年使用:0次
2021-12-30更新
|
219次组卷
|
2卷引用:安徽省芜湖市第一中学2021-2022学年高三上学期12月教学中期诊断模拟考试化学试题
名校
解题方法
6 . 以钛铁矿(主要成分为FeTiO3,还含有MgO、CaO、SiO2等杂质)为原料合成锂离子电池的电极材料钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)的工艺流程如图: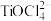 ;富铁液中铁元素主要以Fe2+形式存在;富钛渣中钛元素主要以
;富铁液中铁元素主要以Fe2+形式存在;富钛渣中钛元素主要以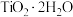 形式存在。
形式存在。
回答下列问题:
(1)“溶浸”时为加快浸取速率,可以采取的措施是_______ (答1条即可);“溶浸”过程 发生反应的离子方程式为
发生反应的离子方程式为______________ 。
(2)若在实验室模拟分离富钛渣和富铁液,则检验富钛渣洗涤干净的操作为______________ 。
(3)“沉铁”过程发生反应的离子方程式为______________ 。
(4)“溶钛”过程中Ti元素的浸出率与反应温度的关系如图所示,试分析40℃后Ti元素浸出率呈图像所示变化的原因:_____________________ 。 为阿伏加德罗常数的值。Ti的价电子排布式为
为阿伏加德罗常数的值。Ti的价电子排布式为______________ ,该晶体的密度
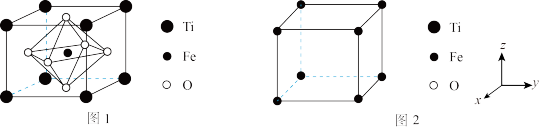
_______ (填含a的计算式)g·cm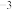 ;FeTiO3的结构的另一种表示如图2(晶胞中未标出Ti、O原子),画出沿z轴向xy平面投影时氧原子在xy平面的位置:
;FeTiO3的结构的另一种表示如图2(晶胞中未标出Ti、O原子),画出沿z轴向xy平面投影时氧原子在xy平面的位置:______________  。
。

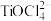 ;富铁液中铁元素主要以Fe2+形式存在;富钛渣中钛元素主要以
;富铁液中铁元素主要以Fe2+形式存在;富钛渣中钛元素主要以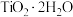 形式存在。
形式存在。回答下列问题:
(1)“溶浸”时为加快浸取速率,可以采取的措施是
 发生反应的离子方程式为
发生反应的离子方程式为(2)若在实验室模拟分离富钛渣和富铁液,则检验富钛渣洗涤干净的操作为
(3)“沉铁”过程发生反应的离子方程式为
(4)“溶钛”过程中Ti元素的浸出率与反应温度的关系如图所示,试分析40℃后Ti元素浸出率呈图像所示变化的原因:
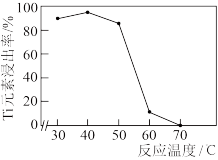
 为阿伏加德罗常数的值。Ti的价电子排布式为
为阿伏加德罗常数的值。Ti的价电子排布式为
 ;FeTiO3的结构的另一种表示如图2(晶胞中未标出Ti、O原子),画出沿z轴向xy平面投影时氧原子在xy平面的位置:
;FeTiO3的结构的另一种表示如图2(晶胞中未标出Ti、O原子),画出沿z轴向xy平面投影时氧原子在xy平面的位置: 。
。
您最近一年使用:0次
2023-05-18更新
|
95次组卷
|
2卷引用:湖南省部分学校2023届高三下学期5月联考化学试题
名校
解题方法
7 . 芳香族化合物A(C9H12O)常用于药物及香料的合成,A有如下转化关系:
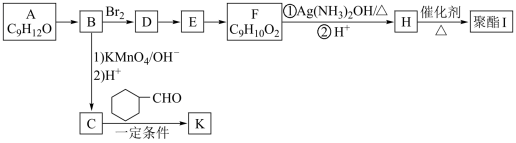
已知:
①A的苯环上只有一个支链,支链上有两种不同环境的氢原子
②
③RCOCH3+R'CHO RCOCH=CHR'+H2O
RCOCH=CHR'+H2O
回答下列问题:
(1)A生成B的反应类型为__________ ,由D生成E的反应条件为_______________ 。
(2)H中含有的官能团名称为______________ 。
(3)I的结构简式为__________________________ 。
(4)由E生成F的化学方程式为____________________________________________ 。
(5)F有多种同分异构体,写出一种符合下列条件的同分异构体的结构简式为:___________________ 。
①能发生水解反应和银镜反应
②属于芳香族化合物且分子中只有一个甲基
③具有5组核磁共振氢谱峰
(6)糠叉丙酮(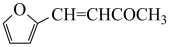 )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(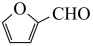 )为原料制备糠叉丙酮的合成路线(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):
)为原料制备糠叉丙酮的合成路线(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):___________________ 。

已知:
①A的苯环上只有一个支链,支链上有两种不同环境的氢原子
②

③RCOCH3+R'CHO
 RCOCH=CHR'+H2O
RCOCH=CHR'+H2O回答下列问题:
(1)A生成B的反应类型为
(2)H中含有的官能团名称为
(3)I的结构简式为
(4)由E生成F的化学方程式为
(5)F有多种同分异构体,写出一种符合下列条件的同分异构体的结构简式为:
①能发生水解反应和银镜反应
②属于芳香族化合物且分子中只有一个甲基
③具有5组核磁共振氢谱峰
(6)糠叉丙酮(
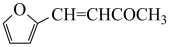 )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(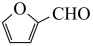 )为原料制备糠叉丙酮的合成路线(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):
)为原料制备糠叉丙酮的合成路线(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):
您最近一年使用:0次
2018-04-03更新
|
1061次组卷
|
13卷引用:江西省南昌市2018届高三第一次模拟考试理科综合化学试题
江西省南昌市2018届高三第一次模拟考试理科综合化学试题吉林省实验中学2018届高三第八次月考(第四次模拟)理科综合化学试题【全国市级联考】山西省太原市2018届高三模拟考试理综化学试题备考突破2020高三化学专题强化集训——化学有机推断题2019年四川省内江市高三上学期第一次模拟考试化学试题【全国百强校】安徽省六安市第一中学2020届高三下学期自测(二)化学试题四川省成都市树德中学 2020届高三三诊模拟考试理科综合化学试题湖北省麻城市实验高级中学2021-2022学年高三下学期第一次联考化学试题四川省内江市高中2020届高三上学期第一次模拟考试 理综化学河南省洛阳市第一高级中学2019-2020学年高二下学期5月月考化学试题河南省南阳市六校2021-2022学年高二下学期5月份联考化学试题黑龙江省牡丹江市第二高级中学2022-2023学年高二下学期7月期末化学试题河南省济源一中2022-2023学年高二下学期6月月考化学试题
名校
8 . 通过对石油的综合利用,可以获得多种有机物。石油分馏产品饱和烃X分子中碳氢质量比为24:5。A、D分别是X通过两种不同裂解方式得到的产物之一,都能使溴水褪色。C与饱和NaHCO3溶液反应产生气体,F是有芳香气味的酯。在一定条件下,物质转化关系如下:
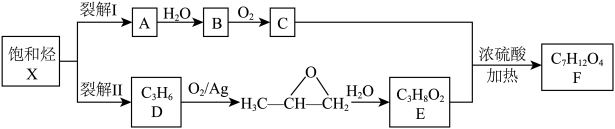
请回答:
(1)化合物X的分子式是_______________ ;E的化学名称是___________________ 。
(2)A→B的反应类型是_____________ 。
(3)C和E生成F的化学方程式是__________________ 。
(4)下列说法正确的是____________ 。
A.有机物B和E具有相同的官能团,所以它们具有相似的化学性质
B.将铜丝在空气中灼烧后迅速插入B中,反复多次,可得到能发生银镜反应的物质
C.有机物D可以使溴水褪色,也能使酸性高锰酸钾褪色,两者原理相同
D.可以用饱和碳酸钠溶液洗去C、E和F混合物中的C、E
(5)G与F互为同分异构体,具有完全相同的官能团,且核磁共振氢谱只有两种峰,则G的结构简式为_______ (任写一种)。H也与F互为同分异构体,主链上具有两条支链,16 g H与足量NaHCO3反应生成CO2 4.48 L(标准状况下)。满足上述条件的H共有______ 种。
(6)以X的裂解产物之一为原料,设计制备乙二醇的合成路线(要求原子利用率为100%)
_______________________

请回答:
(1)化合物X的分子式是
(2)A→B的反应类型是
(3)C和E生成F的化学方程式是
(4)下列说法正确的是
A.有机物B和E具有相同的官能团,所以它们具有相似的化学性质
B.将铜丝在空气中灼烧后迅速插入B中,反复多次,可得到能发生银镜反应的物质
C.有机物D可以使溴水褪色,也能使酸性高锰酸钾褪色,两者原理相同
D.可以用饱和碳酸钠溶液洗去C、E和F混合物中的C、E
(5)G与F互为同分异构体,具有完全相同的官能团,且核磁共振氢谱只有两种峰,则G的结构简式为
(6)以X的裂解产物之一为原料,设计制备乙二醇的合成路线(要求原子利用率为100%)
您最近一年使用:0次
2019-04-30更新
|
365次组卷
|
3卷引用:【校级联考】湖北省龙泉中学、随州一中、天门中学三校2019届高三下学期4月联考理科综合化学试题
名校
解题方法
9 . 现有部分短周期元素的信息如表所示:
A、B、D三种单质(分别由X、Y、Z元素组成)和甲、乙、丙、丁、戊五种化合物之间的转化关系如图所示(某些条件已略去)。其中丁是一种筒能燃料,分子中含有18个电子,其组成元素与丙相同。
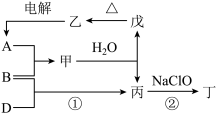
(1)元素X在周期表中的位置是______ ,其简单离子的结构示意图为______ 。
(2)单质B的电子式为______ 。
(3)丙中所含的化学键类型是______ (填序号)。
a.离子键 b.极性共价键 c.非极性共价键
(4)反应②中,0.5 mol 参加反应时转移1 mol电子,该反应的化学方程式为
参加反应时转移1 mol电子,该反应的化学方程式为______ 。
(5)一定条件下,A与 、C(石墨)反应只生成乙和碳化钛(
、C(石墨)反应只生成乙和碳化钛( ),二者均为某些高温结构陶瓷的主要成分,该反应的化学方程式为
),二者均为某些高温结构陶瓷的主要成分,该反应的化学方程式为______ 。
| 元素编号 | 元素性质或原子结构信息 |
| X | 第三周期元素中简单离子半径最小的元素 |
| Y | 其最简单氢化物丙的水溶液呈碱性 |
| Z | 原子核外电子数和所在周期数相等 |

(1)元素X在周期表中的位置是
(2)单质B的电子式为
(3)丙中所含的化学键类型是
a.离子键 b.极性共价键 c.非极性共价键
(4)反应②中,0.5 mol
 参加反应时转移1 mol电子,该反应的化学方程式为
参加反应时转移1 mol电子,该反应的化学方程式为(5)一定条件下,A与
 、C(石墨)反应只生成乙和碳化钛(
、C(石墨)反应只生成乙和碳化钛( ),二者均为某些高温结构陶瓷的主要成分,该反应的化学方程式为
),二者均为某些高温结构陶瓷的主要成分,该反应的化学方程式为
您最近一年使用:0次
2020-03-02更新
|
1108次组卷
|
7卷引用:2016届吉林省东北师范大学附属中学高三上第三次模拟化学试卷
10 . 功能高分子P的合成路线如下:
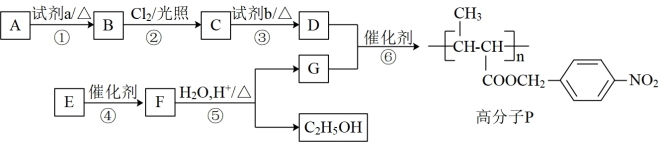
(1)A的分子式是C7H8,其结构简式是___________________ 。
(2)试剂a是_______________ 。
(3)反应③的化学方程式:_______________ 。
(4)E的分子式是C6H10O2。E中含有的官能团:_______________ 。
(5)反应④的反应类型是_______________ 。
(6)反应⑤的化学方程式:_______________ 。
(5)已知:2CH3CHO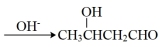
以乙烯为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)。_______________ 。

(1)A的分子式是C7H8,其结构简式是
(2)试剂a是
(3)反应③的化学方程式:
(4)E的分子式是C6H10O2。E中含有的官能团:
(5)反应④的反应类型是
(6)反应⑤的化学方程式:
(5)已知:2CH3CHO
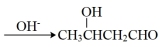
以乙烯为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)。
您最近一年使用:0次
2016-12-09更新
|
1679次组卷
|
15卷引用:2016年全国普通高等学校招生统一考试化学(北京卷精编版)
2016年全国普通高等学校招生统一考试化学(北京卷精编版)2018版化学(苏教版)高考总复习专题十二对接高考精练--基本营养物质 合成有机高分子【全国百强校】重庆市巴蜀中学2019届高三上学期期中复习化学试题【市级联考】吉林省东辽市2019届高三上学期期中考试化学试题四川省成都经济技术开发区实验中学校2019届高三上学期12月月考化学试题2016年全国普通高等学校招生统一考试化学(北京卷参考版)河北省石家庄市第二中学2020届高中毕业班四月份教学质量监测卷理科综合化学部分广东省广州市华南师范大学附属中学2020届高三教学质量监测卷理科综合化学试题(已下线)第34讲 生命中的基础有机化学物质 合成有机高分子(精讲)-2021年高考化学一轮复习讲练测步步为赢 高二化学暑假作业:作业十五 有机化学基础(选修5)第五章 进入合成有机高分子化合物的时代—— C 挑战区 模拟高考(人教版选修5)内蒙古自治区通辽实验中学2020-2021学年高二(特优班)上学期期末考试化学试题黑龙江省大庆市铁人中学2020-2021学年高二下学期期中考试化学试题河北省石家庄市藁城九中2020-2021学年高二下学期期中考试化学试题河北省石家庄市元氏县第四中学2021-2022学年高二下学期第一次月考化学试题



