解题方法
1 . 铜碘杂化团簇化合物具有优异的光学性能,可用于制备发光二极管、发光墨水、生物成像仪器等。一种铜碘杂化团簇的合成路线如下:
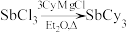 (
(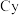 代表
代表 )
)

(1)已知 的原子序数为51,则它在元素周期表中的位置是
的原子序数为51,则它在元素周期表中的位置是______ ,属于______ (填“s”、“p”、“d”或“ ”)区元素。
”)区元素。
(2) 中
中 的价电子排布图为
的价电子排布图为______ ; 只能与一个
只能与一个 配位的原因是
配位的原因是_______ 。
(3)比较F和I的第一电离能大小,并说明理由:_______ 。
(4)已知 (三氯化锑)是易挥发的物质,由此判断
(三氯化锑)是易挥发的物质,由此判断 是
是_____ 晶体,预测 的
的 模型名称为
模型名称为______ 。
(5) (即
(即 ,乙醚)中氧原子以及
,乙醚)中氧原子以及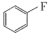 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是_____ 、_____ 。
(6)已知上述铜碘杂化团簇属四方晶系,晶胞参数分别为 ,棱间夹角为
,棱间夹角为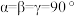 ,平均一个晶胞含有一个铜碘杂化团簇分子,该团簇的化学式为
,平均一个晶胞含有一个铜碘杂化团簇分子,该团簇的化学式为_______ ;设阿伏加德罗常数的值为 ,已知
,已知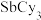 的相对分子质量是371,则该铜碘杂化团簇的密度是
的相对分子质量是371,则该铜碘杂化团簇的密度是_______  (列计算式)。
(列计算式)。
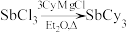 (
( 代表
代表 )
)
(1)已知
 的原子序数为51,则它在元素周期表中的位置是
的原子序数为51,则它在元素周期表中的位置是 ”)区元素。
”)区元素。(2)
 中
中 的价电子排布图为
的价电子排布图为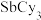 只能与一个
只能与一个 配位的原因是
配位的原因是(3)比较F和I的第一电离能大小,并说明理由:
(4)已知
 (三氯化锑)是易挥发的物质,由此判断
(三氯化锑)是易挥发的物质,由此判断 是
是 的
的 模型名称为
模型名称为(5)
 (即
(即 ,乙醚)中氧原子以及
,乙醚)中氧原子以及 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是(6)已知上述铜碘杂化团簇属四方晶系,晶胞参数分别为
 ,棱间夹角为
,棱间夹角为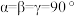 ,平均一个晶胞含有一个铜碘杂化团簇分子,该团簇的化学式为
,平均一个晶胞含有一个铜碘杂化团簇分子,该团簇的化学式为 ,已知
,已知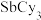 的相对分子质量是371,则该铜碘杂化团簇的密度是
的相对分子质量是371,则该铜碘杂化团簇的密度是 (列计算式)。
(列计算式)。
您最近一年使用:0次
2021-02-01更新
|
280次组卷
|
3卷引用:山西省太原市2021届高三上学期期末考试化学试题
2 . Ⅰ.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(22Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第四周期第___ 族;其基态原子的电子排布式为___ 。
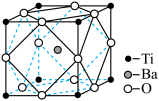
(2)在Ti的化合物中,Ti可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好、介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如图所示,则它的化学式是___ ,其中Ti4+的氧配位数为___ ,Ba2+的氧配位数为____ 。

(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4是___ 晶体。
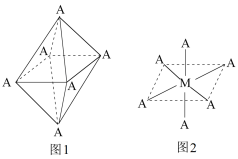
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如图a所示,我们通常可以用图b所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体形,它有___ 种同分异构体。

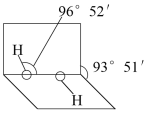
(5)已知过氧化氢分子的空间结构如图c所示,分子中氧原子采取___ 杂化。

(6)24Cr是1~36号元素中未成对电子数最多的原子,Cr3+在溶液中存在如下转化关系:Cr3+ Cr(OH)3
Cr(OH)3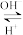 [Cr(OH)4]-。
[Cr(OH)4]-。
①基态Cr原子的价电子排布式为___ 。
②Cr(OH)3是分子晶体,[Cr(OH)4]-中存在的化学键是___ (填标号)。
A.离子键 B.极性键 C.非极性键 D.配位键
(1)Ti元素在元素周期表中的位置是第四周期第
(2)在Ti的化合物中,Ti可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好、介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如图所示,则它的化学式是

(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4是
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如图a所示,我们通常可以用图b所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体形,它有

(5)已知过氧化氢分子的空间结构如图c所示,分子中氧原子采取

(6)24Cr是1~36号元素中未成对电子数最多的原子,Cr3+在溶液中存在如下转化关系:Cr3+
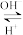 Cr(OH)3
Cr(OH)3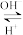 [Cr(OH)4]-。
[Cr(OH)4]-。①基态Cr原子的价电子排布式为
②Cr(OH)3是分子晶体,[Cr(OH)4]-中存在的化学键是
A.离子键 B.极性键 C.非极性键 D.配位键
您最近一年使用:0次
解题方法
3 . 甲、乙、丙是三种常见的单质,A、B、C是三种常见的二元无机化合物,它们之间的转化关系如右图所示。请回答下列有关问题:
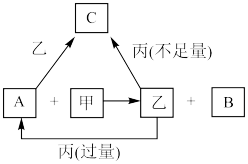
(1)若甲为常见气态非金属单质,丙为金属单质,三种单质中只有甲由短周期元素组成;甲与乙同主族、乙与丙同周期;它们的转化关系均在溶液中进行。则:
①甲物质的名称为___________ 。
②丙元素在元素周期表中的位置是___________ 。
③反应A+甲→乙+B的离子方程式为______________________ 。
④请简述B中阳离子的检验方法__________________________________ 。
(2)若甲为常见金属单质,乙为常见固态非金属单质,且所有物质组成元素均为短周期元素。则:
①乙的化学式为___________ 。
②A的电子式为___________ 。
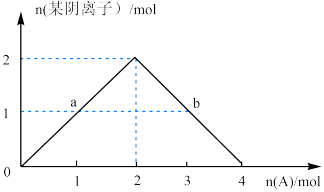
③将A缓慢通入氢氧化钠溶液中,所得溶液中的某种阴离子的物质的量随n(A)的通入转化关系如右图所示。图中a、b两点的溶液中水的电离程度的大小关系为a_______ b(填“>”、“=”或“<")。若溶液X为图中曲线上任意一点,则向溶液X中逐滴加入盐酸至反应完全,消耗盐酸的物质的量最大为___________ 。

(1)若甲为常见气态非金属单质,丙为金属单质,三种单质中只有甲由短周期元素组成;甲与乙同主族、乙与丙同周期;它们的转化关系均在溶液中进行。则:
①甲物质的名称为
②丙元素在元素周期表中的位置是
③反应A+甲→乙+B的离子方程式为
④请简述B中阳离子的检验方法
(2)若甲为常见金属单质,乙为常见固态非金属单质,且所有物质组成元素均为短周期元素。则:
①乙的化学式为
②A的电子式为
③将A缓慢通入氢氧化钠溶液中,所得溶液中的某种阴离子的物质的量随n(A)的通入转化关系如右图所示。图中a、b两点的溶液中水的电离程度的大小关系为a

您最近一年使用:0次
解题方法
4 . A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体。以上物质相互间的转化关系如下图所示:

请回答下列问题:
(1)元素A在元素周期表中的位置为__________ 。
(2)写出K的电子式_______ 。
(3)G中所含化学键的类型为_____________ 。
(4)写出D与氢氧化钠溶液反应的离子方程式__________________ 。
(5)写出A与G反应的化学方程式____________________________ 。
(6)写出H和D反应的化学方程式____________________________ 。
(7)已知F的燃烧热为akJ/mol,L的燃烧热为bkJ/mol,试写出F生成L的热化学方程式_______________________ 。

请回答下列问题:
(1)元素A在元素周期表中的位置为
(2)写出K的电子式
(3)G中所含化学键的类型为
(4)写出D与氢氧化钠溶液反应的离子方程式
(5)写出A与G反应的化学方程式
(6)写出H和D反应的化学方程式
(7)已知F的燃烧热为akJ/mol,L的燃烧热为bkJ/mol,试写出F生成L的热化学方程式
您最近一年使用:0次
11-12高三上·河北衡水·阶段练习
解题方法
5 . (I)多项选择题
下列说法中正确的是_______ 。
A.丙烯分子中有8个σ键,1个π键
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力
D.NCl3和BC13分子中,中心原子都采用sp3杂化
E.SO3与CO32-互为等电子体,SO3是极性分子
(II)人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第________ 周期第________ 族;其基态原子的电子排布式为________ 。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如右图所示,它的化学式是___________ ,其中Ti4+的氧配位数为________ ,Ba2+的氧配位数为_________ ,
(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4是_______ 晶体。
4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如下图1所示,我们通常可以用下图2所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有_______ 种同分异构体。
(Ⅲ)
(1)已知过氧化氢分子的空间结构如右图所示,分子中氧原子采取______ 杂化。
(2)R是1~36号元素中未成对电子数最多的原子。R3+在溶液中存在如下转化关系:
R3+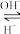 R(OH)3
R(OH)3 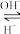 [R(OH)4]-
[R(OH)4]-
①基态R原子的价电子排布式为_______________________ ;
②[R(OH)4]-中存在的化学键是____________ 。
A.离子键 B.极性键 C.非极性键 D.配位键
下列说法中正确的是
A.丙烯分子中有8个σ键,1个π键
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力
D.NCl3和BC13分子中,中心原子都采用sp3杂化
E.SO3与CO32-互为等电子体,SO3是极性分子
(II)人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如右图所示,它的化学式是

(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4是
4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如下图1所示,我们通常可以用下图2所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有

(Ⅲ)
(1)已知过氧化氢分子的空间结构如右图所示,分子中氧原子采取
(2)R是1~36号元素中未成对电子数最多的原子。R3+在溶液中存在如下转化关系:

R3+
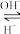 R(OH)3
R(OH)3 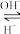 [R(OH)4]-
[R(OH)4]-①基态R原子的价电子排布式为
②[R(OH)4]-中存在的化学键是
A.离子键 B.极性键 C.非极性键 D.配位键
您最近一年使用:0次
解题方法
6 . 化合物H是一种抗失眠药物,其合成路线如下:
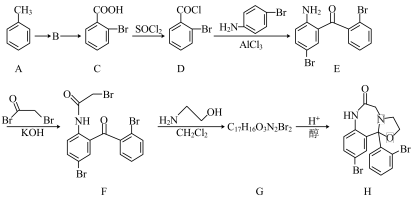
已知:一元取代苯进行二元取代反应时,已有基团会对其他基团进入苯环的位置产生影响。
如: 为邻、对位定位基,
为邻、对位定位基,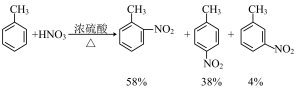 ,
, 为邻、对位定位基,
为邻、对位定位基,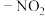 、
、 为间位定位基。
为间位定位基。
(1)B→C所需的试剂为___________ 。
(2)若用 代替
代替 ,D→E会生成一种与E互为同分异构体的有机物,该有机物的结构简式为
,D→E会生成一种与E互为同分异构体的有机物,该有机物的结构简式为___________ 。
(3)G→H转化过程中另一产物为____________ 。
(4)E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:____________ 。
①能发生银镜反应:②含有两个苯环,分子中有3种不同化学环境的氢原子。
(5)设计以乙二酸(HOOCCOOH)和苯为原料制备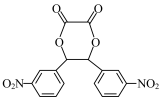 的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)
的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干) ____________ 。

已知:一元取代苯进行二元取代反应时,已有基团会对其他基团进入苯环的位置产生影响。
如:
 为邻、对位定位基,
为邻、对位定位基, ,
, 为邻、对位定位基,
为邻、对位定位基,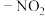 、
、 为间位定位基。
为间位定位基。(1)B→C所需的试剂为
(2)若用
 代替
代替 ,D→E会生成一种与E互为同分异构体的有机物,该有机物的结构简式为
,D→E会生成一种与E互为同分异构体的有机物,该有机物的结构简式为(3)G→H转化过程中另一产物为
(4)E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
①能发生银镜反应:②含有两个苯环,分子中有3种不同化学环境的氢原子。
(5)设计以乙二酸(HOOCCOOH)和苯为原料制备
 的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)
的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)
您最近一年使用:0次
2022高三·全国·专题练习
7 . 化合物F是制备某种改善睡眠药物的中间体,其合成路线如下:

回答下列问题:
(1) 的反应类型是
的反应类型是___________ 。
(2)化合物B核磁共振氢谱的吸收峰有___________ 组。
(3)化合物C的结构简式为___________ 。
(4) 的过程中,被还原的官能团是
的过程中,被还原的官能团是___________ ,被氧化的官能团是___________ 。
(5)若只考虑氟的位置异构,则化合物F的同分异构体有___________ 种。
(6)已知 、
、 和
和 的产率分别为70%、82%和80%,则
的产率分别为70%、82%和80%,则 的总产率为
的总产率为___________ 。
(7) 配合物可催化
配合物可催化 转化中
转化中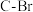 键断裂,也能催化反应①:
键断裂,也能催化反应①:
反应①: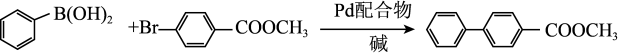
为探究有机小分子催化反应①的可能性,甲、乙两个研究小组分别合成了有机小分子 (结构如下图所示)。在合成
(结构如下图所示)。在合成 的过程中,甲组使用了
的过程中,甲组使用了 催化剂,并在纯化过程中用沉淀剂除
催化剂,并在纯化过程中用沉淀剂除 ;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
根据上述信息,甲、乙两组合成的 产品催化性能出现差异的原因是
产品催化性能出现差异的原因是___________ 。

回答下列问题:
(1)
 的反应类型是
的反应类型是(2)化合物B核磁共振氢谱的吸收峰有
(3)化合物C的结构简式为
(4)
 的过程中,被还原的官能团是
的过程中,被还原的官能团是(5)若只考虑氟的位置异构,则化合物F的同分异构体有
(6)已知
 、
、 和
和 的产率分别为70%、82%和80%,则
的产率分别为70%、82%和80%,则 的总产率为
的总产率为(7)
 配合物可催化
配合物可催化 转化中
转化中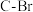 键断裂,也能催化反应①:
键断裂,也能催化反应①:反应①:
为探究有机小分子催化反应①的可能性,甲、乙两个研究小组分别合成了有机小分子
 (结构如下图所示)。在合成
(结构如下图所示)。在合成 的过程中,甲组使用了
的过程中,甲组使用了 催化剂,并在纯化过程中用沉淀剂除
催化剂,并在纯化过程中用沉淀剂除 ;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
根据上述信息,甲、乙两组合成的
 产品催化性能出现差异的原因是
产品催化性能出现差异的原因是
您最近一年使用:0次
2022-07-12更新
|
9068次组卷
|
15卷引用:专题18 有机化学基础(综合题)-2022年高考真题模拟题分项汇编
(已下线)专题18 有机化学基础(综合题)-2022年高考真题模拟题分项汇编2022年湖北省高考真题化学试题(已下线)2022年湖北省高考真题变式题16-19(已下线)考点45 有机化合物的合成-备战2023年高考化学一轮复习考点帮(全国通用)湖北省武汉市第一中学2022-2023学年高三上学期9月开学考试化学试题陕西师范大学附属中学、渭北中学等2022-2023学年高三上学期期初检测化学联考试题陕西师范大学附属中学、渭北中学等2023届高三上学期期初检测联考化学试题(已下线)第35讲 生物大分子与合成高分子(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)热点情景汇编-专题十一 有机推断中的新发展(已下线)第一部分 二轮专题突破 大题突破5 有机综合推断(选考)(已下线)专题21 有机推断题(已下线)专题21 有机推断题(已下线)专题16 有机合成与推断-2023年高考化学真题题源解密(新高考专用)(已下线)考点39 有机推断(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)新疆乌鲁木齐市第四十中学2023-2024学年高三上学期11月月考化学试题
解题方法
8 .  (简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、
(简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、 、LiCl和
、LiCl和 等)为原料制备
等)为原料制备 的工艺流程如图。
的工艺流程如图。
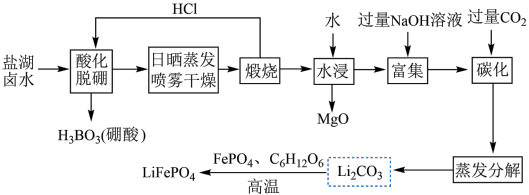
注:日晒蒸发、喷雾干燥后固体含NaCl、LiCl、 等。
等。
(1) 中Li在元素周期表中的位置为第
中Li在元素周期表中的位置为第___________ 周期___________ 族。
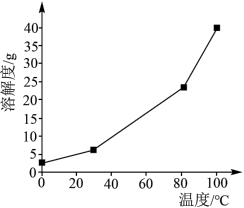
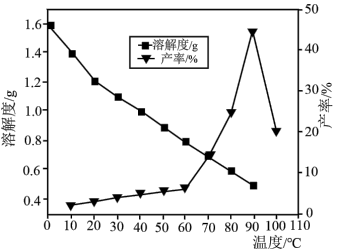
(2)硼酸在水中的溶解度随温度的变化关系如图所示。
已知: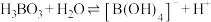
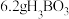 最多与
最多与___________  溶液完全反应。“酸化脱硼”中采用
溶液完全反应。“酸化脱硼”中采用___________ (填“加热”或“冷却”),采用该操作的目的是___________ 。
(3)“煅烧”过程中,常需要搅拌,搅拌的目的是___________ 。
(4)“蒸发分解”的化学方程式为___________ 。
(5)已知不同温度下蒸发分解得到 的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是
的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是___________ ,制得 后需要洗涤,具体操作为
后需要洗涤,具体操作为___________ 。
(6)用 、
、 、
、 制备
制备 时,有
时,有 产生,则参与反应的
产生,则参与反应的 和
和 的物质的量之比为
的物质的量之比为___________ 。
 (简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、
(简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、 、LiCl和
、LiCl和 等)为原料制备
等)为原料制备 的工艺流程如图。
的工艺流程如图。
注:日晒蒸发、喷雾干燥后固体含NaCl、LiCl、
 等。
等。(1)
 中Li在元素周期表中的位置为第
中Li在元素周期表中的位置为第(2)硼酸在水中的溶解度随温度的变化关系如图所示。

已知:
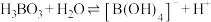
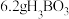 最多与
最多与 溶液完全反应。“酸化脱硼”中采用
溶液完全反应。“酸化脱硼”中采用(3)“煅烧”过程中,常需要搅拌,搅拌的目的是
(4)“蒸发分解”的化学方程式为
(5)已知不同温度下蒸发分解得到
 的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是
的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是 后需要洗涤,具体操作为
后需要洗涤,具体操作为
(6)用
 、
、 、
、 制备
制备 时,有
时,有 产生,则参与反应的
产生,则参与反应的 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
9 . 2023年7月3日,商务部与海关总署发布公告,宣布对镓、锗相关物项实施出口管制。金属镓被称为“电子工业脊梁”,氮化镓是5G技术中广泛应用的新型半导体材料。利用粉煤灰(主要成分为 、
、 、
、 还有少量
还有少量 等杂质)制备镓和氮化镓的流程如下:
等杂质)制备镓和氮化镓的流程如下:

已知:①镓与铝同族,其化合物性质相似。
②“碱浸”后溶液的主要成分为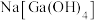 、
、 、
、 。
。
③常温下,相关元素可溶性组分的物质的量浓度的对数与pH的关系如下图所示,当溶液中可溶性组分浓度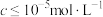 时,可认为已除尽。
时,可认为已除尽。

回答下列问题:
(1)基态Ga原子的核外电子排布式为___________ ,Br在元素周期表中的位置为___________ 。
(2)已知“焙烧”后铝、镓、硅元素均转化为可溶性钠盐,写出 所发生反应的化学方程式为
所发生反应的化学方程式为___________ 。
(3)“沉淀”步骤中加入过量稀硫酸至生成的沉淀不再溶解,则滤渣2的主要成分是___________ (写化学式)。
(4)步骤①和②中通入过量气体A发生反应的离子方程式为___________ 。
(5)常温下,反应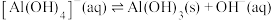 的平衡常数
的平衡常数
___________ 。
(6)以纯镓为原料可制得另一种半导体材料 ,其晶体结构如图所示,已知晶胞密度为
,其晶体结构如图所示,已知晶胞密度为 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,晶胞边长a为
,晶胞边长a为___________ pm(列出计算式即可)。

 、
、 、
、 还有少量
还有少量 等杂质)制备镓和氮化镓的流程如下:
等杂质)制备镓和氮化镓的流程如下:
已知:①镓与铝同族,其化合物性质相似。
②“碱浸”后溶液的主要成分为
 、
、 、
、 。
。③常温下,相关元素可溶性组分的物质的量浓度的对数与pH的关系如下图所示,当溶液中可溶性组分浓度
 时,可认为已除尽。
时,可认为已除尽。
回答下列问题:
(1)基态Ga原子的核外电子排布式为
(2)已知“焙烧”后铝、镓、硅元素均转化为可溶性钠盐,写出
 所发生反应的化学方程式为
所发生反应的化学方程式为(3)“沉淀”步骤中加入过量稀硫酸至生成的沉淀不再溶解,则滤渣2的主要成分是
(4)步骤①和②中通入过量气体A发生反应的离子方程式为
(5)常温下,反应
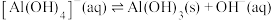 的平衡常数
的平衡常数
(6)以纯镓为原料可制得另一种半导体材料
 ,其晶体结构如图所示,已知晶胞密度为
,其晶体结构如图所示,已知晶胞密度为 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,晶胞边长a为
,晶胞边长a为
您最近一年使用:0次
2024-01-07更新
|
249次组卷
|
2卷引用:2024届湖南省湘东九校联盟高三上学期第一次联考化学试题
10 . 已知一个碳原子上连有两个羟基时,易发生下列转化:

请根据下图回答:
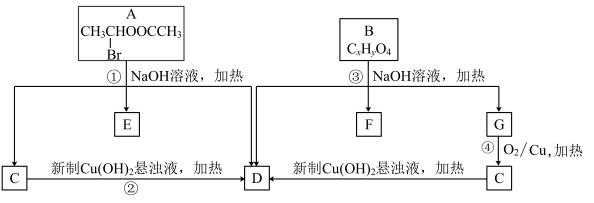
(1)A中所含官能团的名称为________ 。
(2)质谱分析发现B的最大质荷比为208;红外光谱显示B分子中含有苯环结构和两个酯基;核磁共振氢谱中有五个吸收峰,峰面积之比为2∶2∶2∶3∶3,其中苯环上的一氯代物只有两种。则B的结构简式为________________ 。
(3)写出下列反应的方程式:
①_____________________________________________________________ ;
④_____________________________________________________________ 。
(4)符合下列条件的B的同分异构体共有________ 种。
①属于芳香族化合物;
②含有三个取代基,其中只有一个烃基,另两个取代基相同且处于相同的位置;
③能发生水解反应和银镜反应。
(5)已知:2RCH2COOC2H5
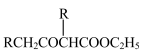 +C2H5OH
+C2H5OH
请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选)。
合成路线流程图示例:CH3CH2Cl CH3CH2OH
CH3CH2OH CH3COOC2H5
CH3COOC2H5
_____________________________________________ 。

请根据下图回答:

(1)A中所含官能团的名称为
(2)质谱分析发现B的最大质荷比为208;红外光谱显示B分子中含有苯环结构和两个酯基;核磁共振氢谱中有五个吸收峰,峰面积之比为2∶2∶2∶3∶3,其中苯环上的一氯代物只有两种。则B的结构简式为
(3)写出下列反应的方程式:
①
④
(4)符合下列条件的B的同分异构体共有
①属于芳香族化合物;
②含有三个取代基,其中只有一个烃基,另两个取代基相同且处于相同的位置;
③能发生水解反应和银镜反应。
(5)已知:2RCH2COOC2H5

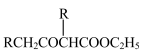 +C2H5OH
+C2H5OH请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选)。
合成路线流程图示例:CH3CH2Cl
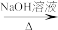 CH3CH2OH
CH3CH2OH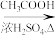 CH3COOC2H5
CH3COOC2H5
您最近一年使用:0次



