真题
解题方法
1 . 氯化铁是重要的化工原料。针对氯化铁的实验室制备方法,回答下列问题:
Ⅰ.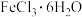 的制备
的制备
制备流程图如下:
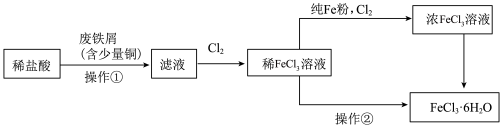
(1)将废铁屑分批加入稀盐酸中,至盐酸反应完全。判断反应完全的现象为___________ 。含有少量铜的废铁屑比纯铁屑反应快,原因为___________ 。
(2)操作①所必需的玻璃仪器中,除烧杯外还有___________ 。
(3)检验 溶液中是否残留
溶液中是否残留 的试剂是
的试剂是___________ 。
(4)为增大 溶液的浓度,向稀
溶液的浓度,向稀 溶液中加入纯Fe粉后通入
溶液中加入纯Fe粉后通入 。此过程中发生的主要反应的离子方程式为
。此过程中发生的主要反应的离子方程式为___________ 。
(5)操作②为___________ 。
Ⅱ.由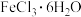 制备无水
制备无水
将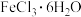 与液体
与液体 混合并加热,制得无水
混合并加热,制得无水 。已知
。已知 沸点为77℃,反应方程式为:
沸点为77℃,反应方程式为: ,装置如下图所示(夹持和加热装置略)。
,装置如下图所示(夹持和加热装置略)。
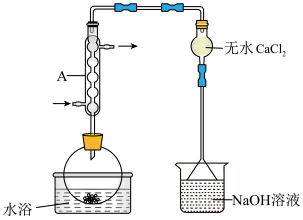
(6)仪器A的名称为___________ ,其作用为___________ 。NaOH溶液的作用是___________ 。
(7)干燥管中无水 不能换成碱石灰,原因是
不能换成碱石灰,原因是___________ 。
(8)由下列结晶水合物制备无水盐,适宜使用上述方法的是___________ (填序号)。
a.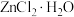 b.
b.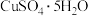 c.
c.
Ⅰ.
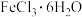 的制备
的制备制备流程图如下:

(1)将废铁屑分批加入稀盐酸中,至盐酸反应完全。判断反应完全的现象为
(2)操作①所必需的玻璃仪器中,除烧杯外还有
(3)检验
 溶液中是否残留
溶液中是否残留 的试剂是
的试剂是(4)为增大
 溶液的浓度,向稀
溶液的浓度,向稀 溶液中加入纯Fe粉后通入
溶液中加入纯Fe粉后通入 。此过程中发生的主要反应的离子方程式为
。此过程中发生的主要反应的离子方程式为(5)操作②为
Ⅱ.由
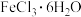 制备无水
制备无水
将
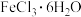 与液体
与液体 混合并加热,制得无水
混合并加热,制得无水 。已知
。已知 沸点为77℃,反应方程式为:
沸点为77℃,反应方程式为: ,装置如下图所示(夹持和加热装置略)。
,装置如下图所示(夹持和加热装置略)。
(6)仪器A的名称为
(7)干燥管中无水
 不能换成碱石灰,原因是
不能换成碱石灰,原因是(8)由下列结晶水合物制备无水盐,适宜使用上述方法的是
a.
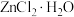 b.
b.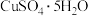 c.
c.
您最近一年使用:0次
2023-03-16更新
|
7040次组卷
|
11卷引用:2022年天津市普通高中学业水平等级性考试化学试题
2022年天津市普通高中学业水平等级性考试化学试题2022年天津高考化学真题(已下线)2022年天津市普通高中学业水平等级性考试化学试题变式题(实验综合题)(已下线)2023年高考山东卷化学真题变式题(实验综合题)(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点10 铁及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)实验综合题(已下线)第16讲物质的制备(已下线)第31讲盐类的水解
2 . 某化学小组同学利用一定浓度的H2O2溶液制备O2,再用O2氧化C2H5OH,并检验氧化产物。
Ⅰ.制备O2
该小组同学设计了如下气体发生装置(夹持装置省略)

(1)甲装置中主要仪器的名称为___________ 。
(2)乙装置中,用粘合剂将MnO2制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞K1,经长颈漏斗向试管中缓慢加入3% H2O2溶液至___________ 。欲使反应停止,关闭活塞K1即可,此时装置中的现象是___________ 。
(3)丙装置可用于制备较多O2,催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是___________ ,此时可以将铂丝抽离H2O2溶液,还可以采取的安全措施是___________ 。
(4)丙装置的特点是___________ (填序号)。
a.可以控制制备反应的开始和结束
b.可通过调节催化剂与液体接触的面积来控制反应的速率
c.与乙装置相比,产物中的O2含量高、杂质种类少
Ⅱ.氧化C2H5OH
该小组同学设计的氧化C2H5OH的装置如图(夹持装置省略)
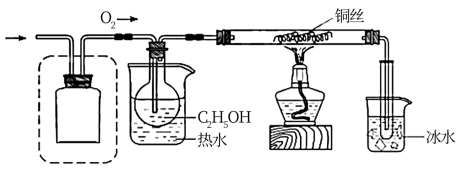
(5)在图中方框内补全干燥装置和干燥剂。___________
Ⅲ.检验产物
(6)为检验上述实验收集到的产物,该小组同学进行了如下实验并得出相应结论。
实验①~③中的结论不合理的是___________ (填序号),原因是___________ 。
Ⅰ.制备O2
该小组同学设计了如下气体发生装置(夹持装置省略)

(1)甲装置中主要仪器的名称为
(2)乙装置中,用粘合剂将MnO2制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞K1,经长颈漏斗向试管中缓慢加入3% H2O2溶液至
(3)丙装置可用于制备较多O2,催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是
(4)丙装置的特点是
a.可以控制制备反应的开始和结束
b.可通过调节催化剂与液体接触的面积来控制反应的速率
c.与乙装置相比,产物中的O2含量高、杂质种类少
Ⅱ.氧化C2H5OH
该小组同学设计的氧化C2H5OH的装置如图(夹持装置省略)

(5)在图中方框内补全干燥装置和干燥剂。
Ⅲ.检验产物
(6)为检验上述实验收集到的产物,该小组同学进行了如下实验并得出相应结论。
| 实验序号 | 检验试剂和反应条件 | 现象 | 结论 |
| ① | 酸性KMnO4溶液 | 紫红色褪去 | 产物含有乙醛 |
| ② | 新制Cu(OH)2,加热 | 生成砖红色沉淀 | 产物含有乙醛 |
| ③ | 微红色含酚酞的NaOH溶液 | 微红色褪去 | 产物可能含有乙酸 |
您最近一年使用:0次
2021-09-07更新
|
8671次组卷
|
14卷引用:2021年新高考天津化学高考真题
2021年新高考天津化学高考真题2021年天津高考化学试题变式题13-16天津市南开中学2022-2023学年高三下学期第四次月考化学试题(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题10 化学实验综合—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)回归教材重难点10 综合实验方案的设计与评价-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)微专题44 以气体制备为主体的实验-备战2023年高考化学一轮复习考点微专题(已下线)专题28 性质探究类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型182 综合实验突破(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)微专题 仪器的组合与创新使用
真题
名校
3 . 环己烯是重要的化工原料。其实验室制备流程如下:
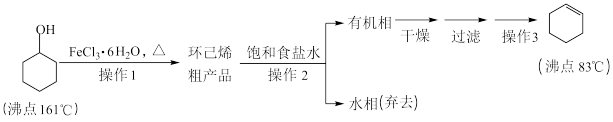
回答下列问题:
Ⅰ.环己烯的制备与提纯
(1)原料环己醇中若含苯酚杂质,检验试剂为____________ ,现象为__________________ 。
(2)操作1的装置如图所示(加热和夹持装置已略去)。
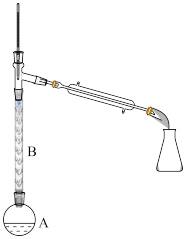
①烧瓶A中进行的可逆反应化学方程式为________________________ ,浓硫酸也可作该反应的催化剂,选择 而不用浓硫酸的原因为
而不用浓硫酸的原因为________________________ (填序号)。
a.浓硫酸易使原料碳化并产生
b. 污染小、可循环使用,符合绿色化学理念
污染小、可循环使用,符合绿色化学理念
c.同等条件下,用 比浓硫酸的平衡转化率高
比浓硫酸的平衡转化率高
②仪器B的作用为____________ 。
(3)操作2用到的玻璃仪器是____________ 。
(4)将操作3(蒸馏)的步骤补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,____________ ,弃去前馏分,收集83℃的馏分。
Ⅱ.环己烯含量的测定
在一定条件下,向 环己烯样品中加入定量制得的
环己烯样品中加入定量制得的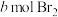 ,与环己烯充分反应后,剩余的
,与环己烯充分反应后,剩余的 与足量
与足量 作用生成
作用生成 ,用
,用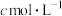 的
的 标准溶液滴定,终点时消耗
标准溶液滴定,终点时消耗 标准溶液
标准溶液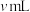 (以上数据均已扣除干扰因素)。
(以上数据均已扣除干扰因素)。
测定过程中,发生的反应如下:
①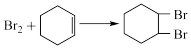
②
③
(5)滴定所用指示剂为____________ 。样品中环己烯的质量分数为____________ (用字母表示)。
(6)下列情况会导致测定结果偏低的是____________ (填序号)。
a.样品中含有苯酚杂质
b.在测定过程中部分环己烯挥发
c. 标准溶液部分被氧化
标准溶液部分被氧化

回答下列问题:
Ⅰ.环己烯的制备与提纯
(1)原料环己醇中若含苯酚杂质,检验试剂为
(2)操作1的装置如图所示(加热和夹持装置已略去)。

①烧瓶A中进行的可逆反应化学方程式为
 而不用浓硫酸的原因为
而不用浓硫酸的原因为a.浓硫酸易使原料碳化并产生

b.
 污染小、可循环使用,符合绿色化学理念
污染小、可循环使用,符合绿色化学理念c.同等条件下,用
 比浓硫酸的平衡转化率高
比浓硫酸的平衡转化率高②仪器B的作用为
(3)操作2用到的玻璃仪器是
(4)将操作3(蒸馏)的步骤补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,
Ⅱ.环己烯含量的测定
在一定条件下,向
 环己烯样品中加入定量制得的
环己烯样品中加入定量制得的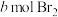 ,与环己烯充分反应后,剩余的
,与环己烯充分反应后,剩余的 与足量
与足量 作用生成
作用生成 ,用
,用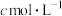 的
的 标准溶液滴定,终点时消耗
标准溶液滴定,终点时消耗 标准溶液
标准溶液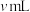 (以上数据均已扣除干扰因素)。
(以上数据均已扣除干扰因素)。测定过程中,发生的反应如下:
①

②

③

(5)滴定所用指示剂为
(6)下列情况会导致测定结果偏低的是
a.样品中含有苯酚杂质
b.在测定过程中部分环己烯挥发
c.
 标准溶液部分被氧化
标准溶液部分被氧化
您最近一年使用:0次
2019-06-09更新
|
7172次组卷
|
20卷引用:2019年天津高考化学试题
2019年天津高考化学试题天津市第一中学2022届高三第一次月考化学试题(已下线)T9-实验题(已下线)专题10.3 化学实验方案的设计与评价 (讲)-《2020年高考一轮复习讲练测》(已下线)专题10.3 化学实验方案的设计与评价 (练)-《2020年高考一轮复习讲练测》2020届高考化学二轮复习大题精准训练——定量分析化学实验中物质含量的测定专题5.2 化学实验的设计与评价(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升(已下线)《2020年新高考政策解读与配套资源》模拟试题11-2020年北京新高考化学模拟试题(已下线)专题6.2 实验综合题(必考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升山东省聊城市2019-2020学年高二下学期期末考试化学试题湖南省长沙市第一中学2020-2021学年高二上学期期末考试化学试题(已下线)小题24 有机物的制备中的操作、分离与提纯——备战2021年高考化学经典小题考前必刷(全国通用)江西省南昌市新建一中2020-2021学年高二下学期第一次月考化学试题(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点34 物质的制备与合成-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题讲座(十)化学实验设计与探究(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点27 认识有机化合物-备战2023年高考化学考试易错题(已下线)专题十六实验设计与探究实验(已下线)专题19 实验综合题湖北省武汉市武钢三中2022-2023学年高二下学期5月月考化学试题
4 . 为达到预期的实验目的,下列操作正确的是
| A.欲配制质量分数为10%的ZnSO4溶液,将l0 g ZnSO4·7H2O溶解在90 g水中 |
| B.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 |
| C.为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量 |
| D.为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用 |
您最近一年使用:0次
2019-01-30更新
|
1304次组卷
|
6卷引用:2007年普通高等学校招生全国统一考试(天津卷)理综化学部分
2007年普通高等学校招生全国统一考试(天津卷)理综化学部分(已下线)2012届黑龙江省双鸭山一中高三上学期期中考试化学试卷(已下线)2011-2012学年山东省临沂市高二上学期期末模块质量调研化学试卷(已下线)2012-2013学年山东省临沂市重点高中高二上学期期末考试化学试卷苏教版2017届高三单元精练检测九化学试题【全国百强校】安徽省六安市第一中学2017-2018学年高二下学期期末考试化学试题
5 . 以下实验设计能达到实验目的的是
| 选项 | 实验目的 | 实验设计 |
| A | 除去NaHCO3固体中的Na2CO3 | 将固体加热至恒重 |
| B | 制备无水AlCl3 | 蒸发Al与稀盐酸反应后的溶液 |
| C | 重结晶提纯苯甲酸 | 将粗品水溶、过滤、蒸发、结晶 |
| D | 鉴别NaBr和KI溶液 | 分别加新制氯水后,用CCl4萃取 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2017-08-08更新
|
4184次组卷
|
15卷引用:2017年全国普通高等学校招生统一考试理综化学(天津卷精编版)
2017年全国普通高等学校招生统一考试理综化学(天津卷精编版)(已下线)【中等生百日捷进提升系列-基础练测】专题2.14 物质的检验、分离与提纯(已下线)【中等生百日捷进提升系列-技能方法】专题15 物质的鉴别、分离、提纯类选择题解题方法和策略(已下线)狂刷04 研究有机化合物的一般步骤和方法—《小题狂刷》2017-2018学年高二化学人教选修5重庆市第二中学2018届高三3月测试化学试题【全国百强校】陕西省西安中学2017-2018学年高二(实验班)下学期期末考试化学试题湖北省安陆市第一高级中学2019届高三上学期8月月考化学试题(已下线)考点20 化学基础实验——《备战2020年高考精选考点专项突破题集》河北衡水中学2020届高三下学期三月份教学质量监测理科综合化学试题广东省惠州市惠城区2021--2022学年高三上学期8月开学摸底化学试题(已下线)考点30 物质的分离、提纯和检验-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点30 物质的分离、提纯和检验-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时52 物质的分离、提纯和检验-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第8周 晚练题-备战2022年高考化学周测与晚练(新高考专用)(已下线)第15讲物质的检验、分离和提纯
6 . [2016天津]下列选用的仪器和药品能达到实验目的的是
| A | B | C | D |
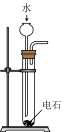 |  |  |  |
| 制乙炔的发生装置 | 蒸馏时的接收装置 | 除去SO2中的少量HCl | 准确量取一定体积K2Cr2O7标准溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2016-12-09更新
|
1003次组卷
|
13卷引用:2016年全国普通高等学校招生统一考试化学(天津卷精编版)
2016年全国普通高等学校招生统一考试化学(天津卷精编版)(已下线)2016年全国普通高等学校招生统一考试化学(天津卷参考版)2015-2016学年青海乐都一中高二下期末化学试卷2015-2016学年贵州省凯里一中高二下期末化学试卷2017届河北省冀州中学高三(高复班)上学期一轮检测(二)化学试卷黑龙江省大庆实验中学2017届高三仿真模拟理科综合化学试题辽宁省庄河市高级中学2017届高三第四次模拟考试理综化学试题河南省新乡市延津县高级中学2016-2017学年高二(卫星班)下学期期末考试理综化学试题(已下线)解密16 化学实验基础(教师版)——备战2018年高考化学之高频考点解密湖南省邵东县创新实验学校2019届高三上学期第五次月考化学试题重庆第七中学2021-2022学年高三上学期半期考试化学试题湖北省武汉市华中师范大学第一附属中学2020届高三3月份网络教学质量监测卷理综化学试题天域全国名校协作体2023-2024学年高三上学期10月联考化学试题
7 . 实验室制备和收集相应气体可使用下图装置的是

| A.Fe与稀硝酸反应制NO |
| B.MnO2与浓盐酸共热制备Cl2 |
| C.NaOH与浓氨水制备NH3 |
| D.Na2SO3与浓硫酸制备SO2 |
您最近一年使用:0次
2024-04-07更新
|
1329次组卷
|
3卷引用:2023年天津市高考化学试卷
真题
名校
8 . FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:

①检查装置的气密性;②通入干燥的Cl2,赶尽装置中的空气;③用酒精灯在铁屑下方加热至反应完成;④…… ⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为___________ 。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A的右端。要使沉积得FeCl3进入收集器,第④步操作是___________ 。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)___________ 。
(4)装置B中的冷水作用为___________ ;装置C的名称为___________ ;装置D中FeCl2全部反应完后,因为失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:___________ 。
(5)在虚线框内画出尾气吸收装置E并注明试剂______
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为___________ 。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应为___________ 。
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率100%;②___________ 。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:

①检查装置的气密性;②通入干燥的Cl2,赶尽装置中的空气;③用酒精灯在铁屑下方加热至反应完成;④…… ⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A的右端。要使沉积得FeCl3进入收集器,第④步操作是
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)
(4)装置B中的冷水作用为
(5)在虚线框内画出尾气吸收装置E并注明试剂
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为
(7)电解池中H+在阴极放电产生H2,阳极的电极反应为
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率100%;②
您最近一年使用:0次
2019-01-30更新
|
2070次组卷
|
7卷引用:2013年全国普通高等学校招生统一考试理科综合能力测试化学(天津卷)
2013年全国普通高等学校招生统一考试理科综合能力测试化学(天津卷)天津市耀华中学2022届高三下学期一模化学试题天津市耀华中学2022届高三下学期第一次校模拟考化学试题(已下线)2014届广东省揭阳一中高三上学期第二次段考理综化学试卷(已下线)2014届高考化学二轮复习必做训练 元素及其化合物练习卷(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第3讲 铁及其化合物 (题型专练)(已下线)2022年湖南卷高考真题变式题(15-19)
9 . 氢能是发展中的新能源,它的利用包括氢的制备、保存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是______________ (至少答出两点)。但是氢气直接燃烧的能量及转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:_____________________________ 。
(2)氢气可用于制备H2O2。已知:H2(g)+A(l)=B(l) ΔH1O2(g)+B(l)=A(l)+H2O2(l) ΔH2,其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)=H2O2(l)的ΔH____ 0(填“>”、“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)=MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________ 。
a.容器内气体压强保持不变b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______ 。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH−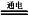 FeO42−+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42−+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
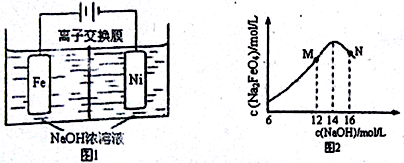
①电解一段时间后,c(OH-)降低的区域在_______ (填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是________________ 。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_______________________________________________ 。
(1)与汽油相比,氢气作为燃料的优点是
(2)氢气可用于制备H2O2。已知:H2(g)+A(l)=B(l) ΔH1O2(g)+B(l)=A(l)+H2O2(l) ΔH2,其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)=H2O2(l)的ΔH
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)=MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是
a.容器内气体压强保持不变b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH−
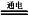 FeO42−+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42−+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
①电解一段时间后,c(OH-)降低的区域在
②电解过程中,须将阴极产生的气体及时排出,其原因是
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:
您最近一年使用:0次
2016-12-09更新
|
1158次组卷
|
4卷引用:2016年全国普通高等学校招生统一考试化学(天津卷精编版)
2016年全国普通高等学校招生统一考试化学(天津卷精编版)(已下线)2016年全国普通高等学校招生统一考试化学(天津卷参考版)江西省抚州市临川区第一中学2017-2018学年高二12月月考化学试题湖南省长沙市雅礼中学2020届高三5月高考化学模拟试卷
真题
10 . 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
CH3CH=CH+CO+H2 CH3CH2CH2CHO
CH3CH2CH2CHO CH3CH2CH2CH2OH
CH3CH2CH2CH2OH
CO的制备原理:HCOOH CO↑+H2O,并设计出原料气的制备装置如图:
CO↑+H2O,并设计出原料气的制备装置如图:
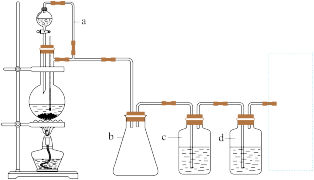
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气,丙烯。写出化学方程式:______ ,______ 。
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是______ ,______ ;
c和d中盛装的试剂分别是______ ,______ 。若用以上装置制备H2, 气体发生装置中必需的玻璃仪器名称是 ______ ;在虚线框内画出收集H2干燥的装置图_____ 。
(3)制丙烯时,还产生少量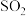 ,
, 及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是
及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是______ (填序号)
①饱和 溶液 ②酸性
溶液 ②酸性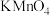 溶液 ③石灰水
溶液 ③石灰水
④无水 ⑤品红溶液
⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是______ 。
a. 低温、高压、催化剂 b. 适当的温度、高压、催化剂
c. 常温、常压、催化剂 d. 适当的温度、常压、催化剂
(5)正丁醛经催化剂加氢得到含少量正丁醛的1-丁醇粗品,为纯化10-丁醇,该小组查阅文献得知:①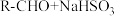 (饱和)→
(饱和)→ ↓;②沸点:乙醚34°C,1-丁醇118°C,并设计出如下提纯路线:
↓;②沸点:乙醚34°C,1-丁醇118°C,并设计出如下提纯路线:

试剂1为______ ,操作1为______ ,操作2为______ ,操作3为______ 。
CH3CH=CH+CO+H2
 CH3CH2CH2CHO
CH3CH2CH2CHO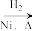 CH3CH2CH2CH2OH
CH3CH2CH2CH2OHCO的制备原理:HCOOH
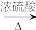 CO↑+H2O,并设计出原料气的制备装置如图:
CO↑+H2O,并设计出原料气的制备装置如图:
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气,丙烯。写出化学方程式:
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是
c和d中盛装的试剂分别是
(3)制丙烯时,还产生少量
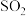 ,
, 及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是
及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是①饱和
 溶液 ②酸性
溶液 ②酸性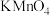 溶液 ③石灰水
溶液 ③石灰水④无水
 ⑤品红溶液
⑤品红溶液(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是
a. 低温、高压、催化剂 b. 适当的温度、高压、催化剂
c. 常温、常压、催化剂 d. 适当的温度、常压、催化剂
(5)正丁醛经催化剂加氢得到含少量正丁醛的1-丁醇粗品,为纯化10-丁醇,该小组查阅文献得知:①
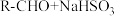 (饱和)→
(饱和)→ ↓;②沸点:乙醚34°C,1-丁醇118°C,并设计出如下提纯路线:
↓;②沸点:乙醚34°C,1-丁醇118°C,并设计出如下提纯路线:
试剂1为
您最近一年使用:0次



