真题
解题方法
1 . 某兴趣小组在定量分析了镁渣[含有MgCO3、Mg(OH)2、CaCO3、Al2O3、Fe2O3和SiO2]中Mg含量的基础上,按如下流程制备六水合氯化镁(MgCl2·6H2O)。

相关信息如下:
①700℃只发生MgCO3和Mg(OH)2的分解反应。
②NH4Cl溶液仅与体系中的MgO反应,且反应程度不大。
③“蒸氨”是将氨从固液混合物中蒸出来,且须控制合适的蒸出量。
请回答:
(1) 下列说法正确的是________ 。
A.步骤Ⅰ,煅烧样品的容器可以用坩埚,不能用烧杯和锥形瓶
B.步骤Ⅲ,蒸氨促进平衡正向移动,提高MgO的溶解量
C.步骤Ⅲ,可以将固液混合物C先过滤,再蒸氨
D.步骤Ⅳ,固液分离操作可采用常压过滤,也可采用减压过滤
(2) 步骤Ⅲ,需要搭建合适的装置,实现蒸氨、吸收和指示于一体(用硫酸溶液吸收氨气)。
①选择必须的仪器,并按连接顺序排列(填写代表仪器的字母,不考虑夹持和橡皮管连接):热源→________ 。

②为了指示蒸氨操作完成,在一定量硫酸溶液中加指示剂。请给出并说明蒸氨可以停止时的现象________ 。
(3) 溶液F经盐酸酸化、蒸发、结晶、过滤、洗涤和低温干燥得到产品。取少量产品溶于水后发现溶液呈碱性。
①含有的杂质是________ 。
②从操作上分析引入杂质的原因是________ 。
(4) 有同学采用盐酸代替步骤Ⅱ中的NH4Cl溶液处理固体B,然后除杂,制备MgCl2溶液。已知金属离子形成氢氧化物沉淀的pH范围:
请给出合理的操作排序(从下列操作中选取,按先后次序列出字母,操作可重复使用):固体B→a→( ) →( ) →( ) →( ) →( ) →( ) →MgCl2溶液→产品。
a.用盐酸溶解 b.调pH=3.0 c.调pH=5.0 d.调pH=8.5
e.调pH=11.0 f.过滤 g.洗涤

相关信息如下:
①700℃只发生MgCO3和Mg(OH)2的分解反应。
②NH4Cl溶液仅与体系中的MgO反应,且反应程度不大。
③“蒸氨”是将氨从固液混合物中蒸出来,且须控制合适的蒸出量。
请回答:
(1) 下列说法正确的是
A.步骤Ⅰ,煅烧样品的容器可以用坩埚,不能用烧杯和锥形瓶
B.步骤Ⅲ,蒸氨促进平衡正向移动,提高MgO的溶解量
C.步骤Ⅲ,可以将固液混合物C先过滤,再蒸氨
D.步骤Ⅳ,固液分离操作可采用常压过滤,也可采用减压过滤
(2) 步骤Ⅲ,需要搭建合适的装置,实现蒸氨、吸收和指示于一体(用硫酸溶液吸收氨气)。
①选择必须的仪器,并按连接顺序排列(填写代表仪器的字母,不考虑夹持和橡皮管连接):热源→

②为了指示蒸氨操作完成,在一定量硫酸溶液中加指示剂。请给出并说明蒸氨可以停止时的现象
(3) 溶液F经盐酸酸化、蒸发、结晶、过滤、洗涤和低温干燥得到产品。取少量产品溶于水后发现溶液呈碱性。
①含有的杂质是
②从操作上分析引入杂质的原因是
(4) 有同学采用盐酸代替步骤Ⅱ中的NH4Cl溶液处理固体B,然后除杂,制备MgCl2溶液。已知金属离子形成氢氧化物沉淀的pH范围:
| 金属离子 | pH | |
| 开始沉淀 | 完全沉淀 | |
| Al3+ | 3.0 | 4.7 |
| Fe3+ | 1.1 | 2.8 |
| Ca2+ | 11.3 | - |
| Mg2+ | 8.4 | 10.9 |
a.用盐酸溶解 b.调pH=3.0 c.调pH=5.0 d.调pH=8.5
e.调pH=11.0 f.过滤 g.洗涤
您最近一年使用:0次
2019-04-12更新
|
3948次组卷
|
6卷引用:2019年4月浙江省普通高校招生选考科目考试化学试题
2019年4月浙江省普通高校招生选考科目考试化学试题(已下线)专题21.化学工艺流程分析-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)2019年高考浙江卷化学试题变式题(实验题)(已下线)专题10.3 化学实验方案的设计与评价 (讲)-《2020年高考一轮复习讲练测》(已下线)专题10.3 化学实验方案的设计与评价 (练)-《2020年高考一轮复习讲练测》(已下线)2021年高考化学押题预测卷(湖南卷)02(含考试版、答题卡、参考答案、全解全析)
2 . 根据实验目的设计方案并进行实验,观察到相关现象,其中方案设计或结论不正确 的是
| 实验目的 | 方案设计 | 现象 | 结论 | |
| A | 探究 和浓 和浓 反应后溶液呈绿色的原因 反应后溶液呈绿色的原因 | 将 通入下列溶液至饱和: 通入下列溶液至饱和:①浓  ②  和HNO3,混合溶液 和HNO3,混合溶液 | ①无色变黄色 ②蓝色变绿色 |  和浓 和浓 反应后溶液呈绿色的主要原因是溶有 反应后溶液呈绿色的主要原因是溶有 |
| B | 比较 与 与 结合 结合 的能力 的能力 | 向等物质的量浓度的 和 和 混合溶液中滴加几滴 混合溶液中滴加几滴 溶液,振荡 溶液,振荡 | 溶液颜色无明显变化 | 结合 的能力: 的能力: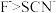 |
| C | 比较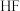 与 与 的酸性 的酸性 | 分别测定等物质的量浓度的 与 与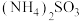 溶液的 溶液的 | 前者 小 小 | 酸性: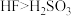 |
| D | 探究温度对反应速率的影响 | 等体积、等物质的量浓度的 与 与 溶液在不同温度下反应 溶液在不同温度下反应 | 温度高的溶液中先出现浑浊 | 温度升高,该反应速率加快 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-02更新
|
3378次组卷
|
6卷引用:2024年浙江高考真题化学(1月)
2024年浙江高考真题化学(1月)浙江省余姚中学2023-2024学年高二下学期3月质量检测化学试题(已下线)选择题11-16(已下线)2024年高考化学真题完全解读(浙江1月卷)(讲义+课件)(已下线)通关练03 常考化学实验基础知识-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)山东省青岛一中2023-2024学年高二下学期第二次月考化学试卷
3 . 通过电化学、热化学等方法,将 转化为
转化为 等化学品,是实现“双碳”目标的途径之一。请回答:
等化学品,是实现“双碳”目标的途径之一。请回答:
(1)某研究小组采用电化学方法将 转化为
转化为 ,装置如图。电极B上的电极反应式是
,装置如图。电极B上的电极反应式是_______ 。
 :
: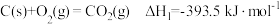
Ⅱ:
Ⅲ: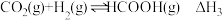
①
_______  。
。
②反应Ⅲ在恒温、恒容的密闭容器中进行, 和
和 的投料浓度均为
的投料浓度均为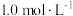 ,平衡常数
,平衡常数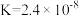 ,则
,则 的平衡转化率为
的平衡转化率为_______ 。
③用氨水吸收 ,得到
,得到 氨水和
氨水和 甲酸铵的混合溶液,
甲酸铵的混合溶液, 时该混合溶液的
时该混合溶液的
_______ 。[已知: 时,电离常数
时,电离常数 、
、 ]
]
(3)为提高效率,该研究小组参考文献优化热化学方法,在如图密闭装置中充分搅拌催化剂M的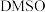 (有机溶剂)溶液,
(有机溶剂)溶液, 和
和 在溶液中反应制备
在溶液中反应制备 ,反应过程中保持
,反应过程中保持 和
和 的压强不变,总反应
的压强不变,总反应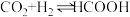 的反应速率为v,反应机理如下列三个基元反应,各反应的活化能
的反应速率为v,反应机理如下列三个基元反应,各反应的活化能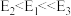 (不考虑催化剂活性降低或丧失)。
(不考虑催化剂活性降低或丧失)。
Ⅳ:

V: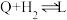

VI: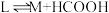

_______ 。
A.v与 的压强无关 B.v与溶液中溶解
的压强无关 B.v与溶液中溶解 的浓度无关
的浓度无关
C.温度升高,v不一定增大 D.在溶液中加入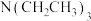 ,可提高
,可提高 转化率
转化率
②实验测得: ,
, 下,v随催化剂M浓度c变化如图。
下,v随催化剂M浓度c变化如图。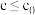 时,v随c增大而增大:
时,v随c增大而增大: 时,v不再显著增大。请解释原因
时,v不再显著增大。请解释原因_______ 。
 转化为
转化为 等化学品,是实现“双碳”目标的途径之一。请回答:
等化学品,是实现“双碳”目标的途径之一。请回答:(1)某研究小组采用电化学方法将
 转化为
转化为 ,装置如图。电极B上的电极反应式是
,装置如图。电极B上的电极反应式是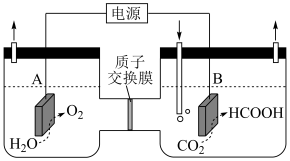
 :
: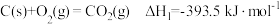
Ⅱ:

Ⅲ:
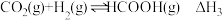
①

 。
。②反应Ⅲ在恒温、恒容的密闭容器中进行,
 和
和 的投料浓度均为
的投料浓度均为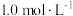 ,平衡常数
,平衡常数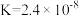 ,则
,则 的平衡转化率为
的平衡转化率为③用氨水吸收
 ,得到
,得到 氨水和
氨水和 甲酸铵的混合溶液,
甲酸铵的混合溶液, 时该混合溶液的
时该混合溶液的
 时,电离常数
时,电离常数 、
、 ]
](3)为提高效率,该研究小组参考文献优化热化学方法,在如图密闭装置中充分搅拌催化剂M的
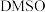 (有机溶剂)溶液,
(有机溶剂)溶液, 和
和 在溶液中反应制备
在溶液中反应制备 ,反应过程中保持
,反应过程中保持 和
和 的压强不变,总反应
的压强不变,总反应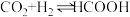 的反应速率为v,反应机理如下列三个基元反应,各反应的活化能
的反应速率为v,反应机理如下列三个基元反应,各反应的活化能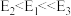 (不考虑催化剂活性降低或丧失)。
(不考虑催化剂活性降低或丧失)。Ⅳ:


V:
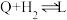

VI:
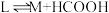

A.v与
 的压强无关 B.v与溶液中溶解
的压强无关 B.v与溶液中溶解 的浓度无关
的浓度无关C.温度升高,v不一定增大 D.在溶液中加入
 ,可提高
,可提高 转化率
转化率②实验测得:
 ,
, 下,v随催化剂M浓度c变化如图。
下,v随催化剂M浓度c变化如图。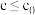 时,v随c增大而增大:
时,v随c增大而增大: 时,v不再显著增大。请解释原因
时,v不再显著增大。请解释原因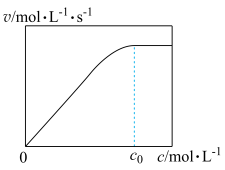
您最近一年使用:0次
2024-02-02更新
|
2616次组卷
|
4卷引用:2024年浙江高考真题化学(1月)
4 . 二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,反应的化学方程式及装置图(部分装置省略)如下:
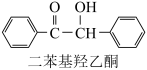 +2FeCl3
+2FeCl3
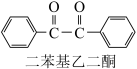 +2FeCl2+2HCl
+2FeCl2+2HCl
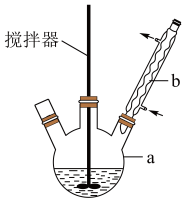
在反应装置中,加入原料及溶剂,搅拌下加热回流。反应结束后加水煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶液重结晶提纯。重结晶过程。
加热溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
请回答以下问题:
(1)写出装置图中下班仪器的名称:a__________ .b___________
(2)趁势过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体:_________
A.缓慢冷却溶液 B.溶液深度较高
C.溶质溶解度较小 D.缓慢蒸发溶剂
如果溶液发生过饱和现象,可采用_______ 、_________ 等方法促进晶体析出。
(3)抽滤所用的滤纸应略_____ (填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。烧杯中的二苯基乙二酮晶体转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是_____ 。
A.无水乙醇 B.饱和氯化钠溶液
C.70%乙醇水溶液 D.滤液
(4)上述重结晶过程中的哪一步操作除去了不溶性杂质:________ 。
(5)某同学采用薄层色谱(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始,回流15 min、30 min、45 min和60 min时,用毛细管取样、点样,薄层色谱展开后的斑点如下图所示。该实验条件下比较合适的回流时间是________ 。
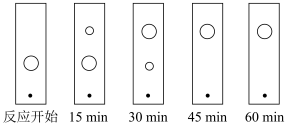
A. 15 min B.30 min C. 45 min D.60 min
 +2FeCl3
+2FeCl3
 +2FeCl2+2HCl
+2FeCl2+2HCl
在反应装置中,加入原料及溶剂,搅拌下加热回流。反应结束后加水煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶液重结晶提纯。重结晶过程。
加热溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
请回答以下问题:
(1)写出装置图中下班仪器的名称:a
(2)趁势过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体:
A.缓慢冷却溶液 B.溶液深度较高
C.溶质溶解度较小 D.缓慢蒸发溶剂
如果溶液发生过饱和现象,可采用
(3)抽滤所用的滤纸应略
A.无水乙醇 B.饱和氯化钠溶液
C.70%乙醇水溶液 D.滤液
(4)上述重结晶过程中的哪一步操作除去了不溶性杂质:
(5)某同学采用薄层色谱(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始,回流15 min、30 min、45 min和60 min时,用毛细管取样、点样,薄层色谱展开后的斑点如下图所示。该实验条件下比较合适的回流时间是

A. 15 min B.30 min C. 45 min D.60 min
您最近一年使用:0次
2019-01-30更新
|
1164次组卷
|
3卷引用:2011年普通高等学校招生全国统一考试化学卷(浙江)
真题
解题方法
5 . 某小组采用如下实验流程制备 :
: 是一种无色晶体,吸湿性极强,可溶于热的正己烷,在空气中受热易被氧化。
是一种无色晶体,吸湿性极强,可溶于热的正己烷,在空气中受热易被氧化。
请回答:
(1)如图为步骤I的实验装置图(夹持仪器和尾气处理装置已省略),图中仪器A的名称是_______ ,判断步骤I反应结束的实验现象是_______ 。不正确 的是_______。
(3)所得粗产品呈浅棕黄色,小组成员认为其中混有碘单质,请设计实验方案验证_______ 。
(4)纯化与分析:对粗产品纯化处理后得到产品,再采用银量法测定产品中 含量以确定纯度。滴定原理为:先用过量
含量以确定纯度。滴定原理为:先用过量 标准溶液沉淀
标准溶液沉淀 ,再以
,再以 标准溶液回滴剩余的
标准溶液回滴剩余的 。已知:
。已知:
①从下列选项中选择合适的操作补全测定步骤_______ 。
称取产品 ,用少量稀酸A溶解后转移至
,用少量稀酸A溶解后转移至 容量瓶,加水定容得待测溶液。取滴定管检漏、水洗→_______→装液、赶气泡、调液面、读数→用移液管准确移取
容量瓶,加水定容得待测溶液。取滴定管检漏、水洗→_______→装液、赶气泡、调液面、读数→用移液管准确移取 待测溶液加入锥形瓶→_______→_______→加入稀酸B→用
待测溶液加入锥形瓶→_______→_______→加入稀酸B→用 标准溶液滴定→_______→读数。
标准溶液滴定→_______→读数。
a.润洗,从滴定管尖嘴放出液体
b.润洗,从滴定管上口倒出液体
c.滴加指示剂 溶液
溶液
d.滴加指示剂硫酸铁铵 溶液
溶液
e.准确移取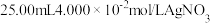 标准溶液加入锥形瓶
标准溶液加入锥形瓶
f.滴定至溶液呈浅红色
g.滴定至沉淀变白色
②加入稀酸B的作用是_______ 。
③三次滴定消耗 标准溶液的平均体积为
标准溶液的平均体积为 ,则产品纯度为
,则产品纯度为_______ 。
 :
:
 是一种无色晶体,吸湿性极强,可溶于热的正己烷,在空气中受热易被氧化。
是一种无色晶体,吸湿性极强,可溶于热的正己烷,在空气中受热易被氧化。请回答:
(1)如图为步骤I的实验装置图(夹持仪器和尾气处理装置已省略),图中仪器A的名称是

| A.步骤I中,反应物和溶剂在使用前除水 |
| B.步骤I中,若控温加热器发生故障,改用酒精灯(配石棉网)加热 |
| C.步骤Ⅲ中,在通风橱中浓缩至蒸发皿内出现晶膜 |
| D.步骤Ⅳ中,使用冷的正己烷洗涤 |
(4)纯化与分析:对粗产品纯化处理后得到产品,再采用银量法测定产品中
 含量以确定纯度。滴定原理为:先用过量
含量以确定纯度。滴定原理为:先用过量 标准溶液沉淀
标准溶液沉淀 ,再以
,再以 标准溶液回滴剩余的
标准溶液回滴剩余的 。已知:
。已知:| 难溶电解质 |  (黄色) (黄色) |  (白色) (白色) |  (红色) (红色) |
溶度积常数 | 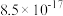 | 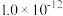 |  |
称取产品
 ,用少量稀酸A溶解后转移至
,用少量稀酸A溶解后转移至 容量瓶,加水定容得待测溶液。取滴定管检漏、水洗→_______→装液、赶气泡、调液面、读数→用移液管准确移取
容量瓶,加水定容得待测溶液。取滴定管检漏、水洗→_______→装液、赶气泡、调液面、读数→用移液管准确移取 待测溶液加入锥形瓶→_______→_______→加入稀酸B→用
待测溶液加入锥形瓶→_______→_______→加入稀酸B→用 标准溶液滴定→_______→读数。
标准溶液滴定→_______→读数。a.润洗,从滴定管尖嘴放出液体
b.润洗,从滴定管上口倒出液体
c.滴加指示剂
 溶液
溶液d.滴加指示剂硫酸铁铵
 溶液
溶液e.准确移取
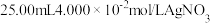 标准溶液加入锥形瓶
标准溶液加入锥形瓶f.滴定至溶液呈浅红色
g.滴定至沉淀变白色
②加入稀酸B的作用是
③三次滴定消耗
 标准溶液的平均体积为
标准溶液的平均体积为 ,则产品纯度为
,则产品纯度为
您最近一年使用:0次
真题
6 . 下列实验装置使用不正确 的是
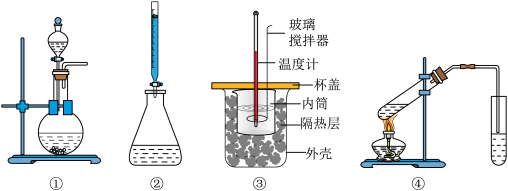
| A.图①装置用于二氧化锰和浓盐酸反应制氯气 |
| B.图②装置用于标准酸溶液滴定未知碱溶液 |
| C.图③装置用于测定中和反应的反应热 |
| D.图④装置用于制备乙酸乙酯 |
您最近一年使用:0次
真题
解题方法
7 .  可用于合成光电材料。某兴趣小组用
可用于合成光电材料。某兴趣小组用 与
与 反应制备液态
反应制备液态 ,实验装置如图,反应方程式为:
,实验装置如图,反应方程式为: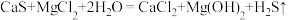 。
。 的沸点是
的沸点是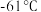 ,有毒:
,有毒:
②装置A内产生的 气体中含有酸性气体杂质。
气体中含有酸性气体杂质。
请回答:
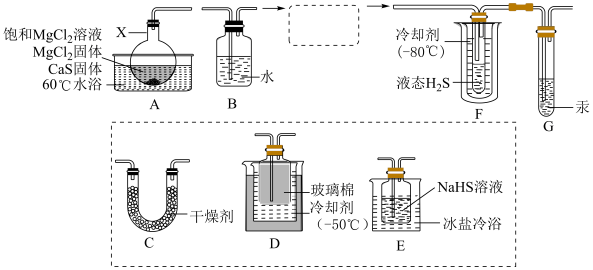
(1)仪器X的名称是_______ 。
(2)完善虚框内的装置排序:A→B→_______ →F+G
(3)下列干燥剂,可用于装置C中的是_______。
(4)装置G中汞的两个作用是:①平衡气压:②_______ 。
(5)下列说法正确的是_______。
(6)取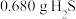 产品,与足量
产品,与足量 溶液充分反应后,将生成的
溶液充分反应后,将生成的 置于已恒重、质量为
置于已恒重、质量为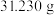 的坩埚中,煅烧生成
的坩埚中,煅烧生成 ,恒重后总质量为
,恒重后总质量为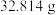 。产品的纯度为
。产品的纯度为_______ 。
 可用于合成光电材料。某兴趣小组用
可用于合成光电材料。某兴趣小组用 与
与 反应制备液态
反应制备液态 ,实验装置如图,反应方程式为:
,实验装置如图,反应方程式为: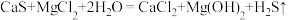 。
。
 的沸点是
的沸点是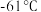 ,有毒:
,有毒:②装置A内产生的
 气体中含有酸性气体杂质。
气体中含有酸性气体杂质。请回答:
(1)仪器X的名称是
(2)完善虚框内的装置排序:A→B→
(3)下列干燥剂,可用于装置C中的是_______。
| A.氢氧化钾 | B.五氧化二磷 | C.氯化钙 | D.碱石灰 |
(4)装置G中汞的两个作用是:①平衡气压:②
(5)下列说法正确的是_______。
| A.该实验操作须在通风橱中进行 |
B.装置D的主要作用是预冷却 |
C.加入的 固体,可使 固体,可使 溶液保持饱和,有利于平稳持续产生 溶液保持饱和,有利于平稳持续产生 |
| D.该实验产生的尾气可用硝酸吸收 |
(6)取
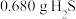 产品,与足量
产品,与足量 溶液充分反应后,将生成的
溶液充分反应后,将生成的 置于已恒重、质量为
置于已恒重、质量为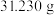 的坩埚中,煅烧生成
的坩埚中,煅烧生成 ,恒重后总质量为
,恒重后总质量为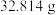 。产品的纯度为
。产品的纯度为
您最近一年使用:0次
真题
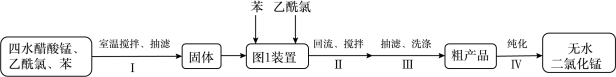
8 . 某兴趣小组用四水醋酸锰[(CH3COO)2Mn·4H2O]和乙酰氯(CH3COCl)为原料制备无水二氯化锰,按如图流程开展了实验(夹持仪器已省略):
②制备无水二氯化锰的主要反应:(CH3COO)2Mn+CH3COCl MnCl2↓+2(CH3COO)2O。
MnCl2↓+2(CH3COO)2O。
③乙酰氯遇水发生反应:CH3COCl+H2O→CH3COOH+HCl。
请回答:
(1)步骤Ⅰ:所获固体主要成分是_________ (用化学式表示)。
(2)步骤Ⅰ在室温下反应,步骤Ⅱ在加热回流下反应,目的分别是________ 。
(3)步骤Ⅲ:下列操作中正确的是_________ 。
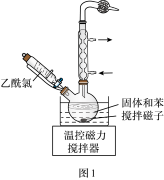
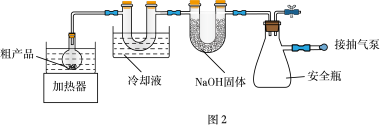
(4)步骤Ⅳ:①将装有粗产品的圆底烧瓶接到纯化装置(图2)上,打开安全瓶上旋塞,打开抽气泵,关闭安全瓶上旋塞,开启加热器,进行纯化。请给出纯化完成后的操作排序:________ 。
纯化完成→(_____)→(_____)→(_____)→(_____)→将产品转至干燥器中保存
a.拔出圆底烧瓶的瓶塞
b.关闭抽气泵
c.关闭加热器,待烧瓶冷却至室温
d.打开安全瓶上旋塞
②图2装置中U形管内NaOH固体的作用是________ 。
(5)用滴定分析法确定产品纯度。甲同学通过测定产品中锰元素的含量确定纯度;乙同学通过测定产品中氯元素的含量确定纯度。合理的是_________ (填“甲”或“乙”)同学的方法。
②制备无水二氯化锰的主要反应:(CH3COO)2Mn+CH3COCl
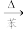 MnCl2↓+2(CH3COO)2O。
MnCl2↓+2(CH3COO)2O。③乙酰氯遇水发生反应:CH3COCl+H2O→CH3COOH+HCl。
请回答:
(1)步骤Ⅰ:所获固体主要成分是
(2)步骤Ⅰ在室温下反应,步骤Ⅱ在加热回流下反应,目的分别是
(3)步骤Ⅲ:下列操作中正确的是
| A.用蒸馏水润湿滤纸,微开水龙头,抽气使滤纸紧贴在漏斗瓷板上 |
| B.用倾析法转移溶液,开大水龙头,待溶液快流尽时再转移沉淀 |
| C.用乙醇作为洗涤剂,在洗涤沉淀时,应开大水龙头,使洗涤剂快速通过沉淀物 |
| D.洗涤结束后,将固体迅速转移至圆底烧瓶进行后续操作 |
纯化完成→(_____)→(_____)→(_____)→(_____)→将产品转至干燥器中保存
a.拔出圆底烧瓶的瓶塞
b.关闭抽气泵
c.关闭加热器,待烧瓶冷却至室温
d.打开安全瓶上旋塞
②图2装置中U形管内NaOH固体的作用是
(5)用滴定分析法确定产品纯度。甲同学通过测定产品中锰元素的含量确定纯度;乙同学通过测定产品中氯元素的含量确定纯度。合理的是
您最近一年使用:0次
2022-01-12更新
|
8098次组卷
|
11卷引用:2022 年1月浙江省普通高校招生选考科目考试化学试题
2022 年1月浙江省普通高校招生选考科目考试化学试题(已下线)2022年浙江1月高考真题变式题(26-31)(已下线)微专题43 常见物质的分离、提纯和鉴别-备战2023年高考化学考点微专题(全国版)(已下线)易错点34 化学实验方案的设计与评价-备战2023年高考化学考试易错题(已下线)热点情景汇编-专题十三 实验探究中的新思路(已下线)题型177 固液反应型制备实验(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
9 .  是很好的氯化剂,实验室用如图装置(夹持仪器已省略)制备高纯
是很好的氯化剂,实验室用如图装置(夹持仪器已省略)制备高纯 。已知:
。已知:
① ,合适反应温度为
,合适反应温度为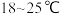 ;副反应:
;副反应: 。
。
②常压下, 沸点
沸点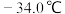 ,熔点
,熔点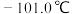 ;
; 沸点2.0℃,熔点
沸点2.0℃,熔点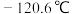 。
。
③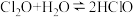 ,
, 在
在 中的溶解度远大于其在水中的溶解度。
中的溶解度远大于其在水中的溶解度。
请回答:

(1)①装置A的作用是去除原料气中的少量水分,可用的试剂是_______ 。
②将上图中装置组装完整,虚框D中应选用_______ 。

(2)有关反应柱B,须进行的操作是_______ 。
A.将HgO粉末热处理除水分、增加表面积后填入反应柱
B.调控进入反应柱的混合气中 和
和 的比例
的比例
C.调控混合气从下口进入反应柱的流速
D.将加热带缠绕于反应柱并加热
(3)装置C,冷却液的温度通常控制在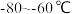 。反应停止后,温度保持不变,为减少产品中的
。反应停止后,温度保持不变,为减少产品中的 含量,可采用的方法是
含量,可采用的方法是_______ 。
(4)将纯化后的 产品气化,通入水中得到高纯度
产品气化,通入水中得到高纯度 的浓溶液,于阴凉暗处贮存。当需要
的浓溶液,于阴凉暗处贮存。当需要 时,可将
时,可将 浓溶液用
浓溶液用 萃取分液,经气化重新得到。
萃取分液,经气化重新得到。
针对萃取分液,从下列选项选择合适操作(操作不能重复使用)并排序:c→_______ →_______ →e→d→f→_______ 。
a.检查旋塞、玻璃塞处是否漏水
b.将溶液和 转入分液漏斗
转入分液漏斗
c.涂凡士林
d.旋开旋塞放气
e.倒转分液漏斗,小心振摇
f.经几次振摇并放气后,将分液漏斗置于铁架台上静置
g.打开旋塞,向锥形瓶放出下层液体
h.打开旋塞,待下层液体完全流出后,关闭旋塞,将上层液体倒入锥形瓶
(5)产品分析:取一定量 浓溶液的稀释液,加入适量
浓溶液的稀释液,加入适量 、过量
、过量 溶液及一定量的稀
溶液及一定量的稀 ,充分反应。用标准
,充分反应。用标准 溶液滴定(滴定Ⅰ);再以酚酞为指示剂,用标准
溶液滴定(滴定Ⅰ);再以酚酞为指示剂,用标准 溶液滴定(滴定Ⅱ)。已知产生
溶液滴定(滴定Ⅱ)。已知产生 的反应(不考虑
的反应(不考虑 与水反应):
与水反应):
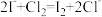
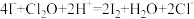

实验数据如下表:
①用标准 溶液滴定时,无需另加指示剂。判断
溶液滴定时,无需另加指示剂。判断滴定 Ⅰ 到达终点的实验现象是_______ 。
②高纯度 浓溶液中要求
浓溶液中要求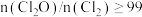 (
( 和
和 均以
均以 计)。
计)。结合数据 分析所制备的 浓溶液是否符合要求
浓溶液是否符合要求_______ 。
 是很好的氯化剂,实验室用如图装置(夹持仪器已省略)制备高纯
是很好的氯化剂,实验室用如图装置(夹持仪器已省略)制备高纯 。已知:
。已知:①
 ,合适反应温度为
,合适反应温度为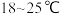 ;副反应:
;副反应: 。
。②常压下,
 沸点
沸点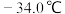 ,熔点
,熔点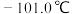 ;
; 沸点2.0℃,熔点
沸点2.0℃,熔点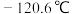 。
。③
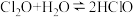 ,
, 在
在 中的溶解度远大于其在水中的溶解度。
中的溶解度远大于其在水中的溶解度。请回答:

(1)①装置A的作用是去除原料气中的少量水分,可用的试剂是
②将上图中装置组装完整,虚框D中应选用

(2)有关反应柱B,须进行的操作是
A.将HgO粉末热处理除水分、增加表面积后填入反应柱
B.调控进入反应柱的混合气中
 和
和 的比例
的比例C.调控混合气从下口进入反应柱的流速
D.将加热带缠绕于反应柱并加热
(3)装置C,冷却液的温度通常控制在
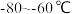 。反应停止后,温度保持不变,为减少产品中的
。反应停止后,温度保持不变,为减少产品中的 含量,可采用的方法是
含量,可采用的方法是(4)将纯化后的
 产品气化,通入水中得到高纯度
产品气化,通入水中得到高纯度 的浓溶液,于阴凉暗处贮存。当需要
的浓溶液,于阴凉暗处贮存。当需要 时,可将
时,可将 浓溶液用
浓溶液用 萃取分液,经气化重新得到。
萃取分液,经气化重新得到。针对萃取分液,从下列选项选择合适操作(操作不能重复使用)并排序:c→
a.检查旋塞、玻璃塞处是否漏水
b.将溶液和
 转入分液漏斗
转入分液漏斗c.涂凡士林
d.旋开旋塞放气
e.倒转分液漏斗,小心振摇
f.经几次振摇并放气后,将分液漏斗置于铁架台上静置
g.打开旋塞,向锥形瓶放出下层液体
h.打开旋塞,待下层液体完全流出后,关闭旋塞,将上层液体倒入锥形瓶
(5)产品分析:取一定量
 浓溶液的稀释液,加入适量
浓溶液的稀释液,加入适量 、过量
、过量 溶液及一定量的稀
溶液及一定量的稀 ,充分反应。用标准
,充分反应。用标准 溶液滴定(滴定Ⅰ);再以酚酞为指示剂,用标准
溶液滴定(滴定Ⅰ);再以酚酞为指示剂,用标准 溶液滴定(滴定Ⅱ)。已知产生
溶液滴定(滴定Ⅱ)。已知产生 的反应(不考虑
的反应(不考虑 与水反应):
与水反应):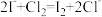
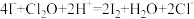

实验数据如下表:
加入量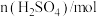 | 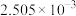 |
滴定Ⅰ测出量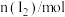 | 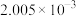 |
滴定Ⅱ测出量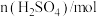 | 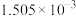 |
 溶液滴定时,无需另加指示剂。判断
溶液滴定时,无需另加指示剂。判断②高纯度
 浓溶液中要求
浓溶液中要求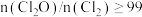 (
( 和
和 均以
均以 计)。
计)。 浓溶液是否符合要求
浓溶液是否符合要求
您最近一年使用:0次
2021-06-15更新
|
8351次组卷
|
17卷引用:2021年6月新高考浙江化学高考真题
2021年6月新高考浙江化学高考真题(已下线)考点34 物质的制备与合成-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题22.综合实验设计与评价-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)2021年6月浙江高考化学试题变式题26-31(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密13 实验化学(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)专题13 化学实验-备战2022年高考化学学霸纠错(全国通用)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)辽宁省东北育才学校高中部高三2021-2022下学期开学初第六次模拟考试化学试题(已下线)专题10 化学实验综合—2022年高考化学二轮复习讲练测(全国版)-练习福建省莆田第十五中学2022-2023学年高三上学期第一次月考化学试题(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)福建省宁德第一中学2023届高三上学期一模考试化学试题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
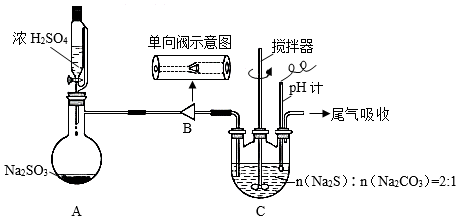
10 . 硫代硫酸钠在纺织业等领域有广泛应用。某兴趣小组用下图装置制备 。
。
合成反应: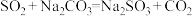

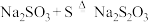
滴定反应:
已知: 易溶于水,难溶于乙醇,
易溶于水,难溶于乙醇, 开始失结晶水。
开始失结晶水。
实验步骤:
Ⅰ. 制备:装置A制备的
制备:装置A制备的 经过单向阀通入装置C中的混合溶液,加热、搅拌,至溶液
经过单向阀通入装置C中的混合溶液,加热、搅拌,至溶液 约为7时,停止通入
约为7时,停止通入 气体,得产品混合溶液。
气体,得产品混合溶液。
Ⅱ.产品分离提纯:产品混合溶液经蒸发浓缩、冷却结晶、过滤洗涤、干燥,得到 产品。
产品。
Ⅲ.产品纯度测定:以淀粉作指示剂,用 产品配制的溶液滴定碘标准溶液至滴定终点,计算
产品配制的溶液滴定碘标准溶液至滴定终点,计算 含量。
含量。
请回答:
(1)步骤Ⅰ:单向阀的作用是______ ;装置C中的反应混合溶液 过高或过低将导致产率降低,原因是
过高或过低将导致产率降低,原因是_______ 。
(2)步骤Ⅱ:下列说法正确的是_____ 。
A 快速蒸发溶液中水分,可得较大晶体颗粒
B 蒸发浓缩至溶液表面出现品晶膜时,停止加热
C 冷却结晶后的固液混合物中加入乙醇可提高产率
D 可选用冷的 溶液作洗涤剂
溶液作洗涤剂
(3)步骤Ⅲ
①滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):
检漏→蒸馏水洗涤→( ) →( ) →( ) →( ) →( ) →开始滴定。
A 烘干 B 装入滴定液至零刻度以上 C 调整滴定液液面至零刻度或零刻度以下D 用洗耳球吹出润洗液 E 排除气泡 F 用滴定液润洗2至3次 G 记录起始读数
②装标准碘溶液的碘量瓶(带瓶塞的锥形瓶)在滴定前应盖上瓶塞,目的是______ 。
③滴定法测得产品中 含量为
含量为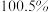 ,则
,则 产品中可能混有的物质是
产品中可能混有的物质是________ 。
 。
。
合成反应:
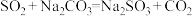

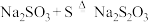
滴定反应:

已知:
 易溶于水,难溶于乙醇,
易溶于水,难溶于乙醇, 开始失结晶水。
开始失结晶水。实验步骤:
Ⅰ.
 制备:装置A制备的
制备:装置A制备的 经过单向阀通入装置C中的混合溶液,加热、搅拌,至溶液
经过单向阀通入装置C中的混合溶液,加热、搅拌,至溶液 约为7时,停止通入
约为7时,停止通入 气体,得产品混合溶液。
气体,得产品混合溶液。Ⅱ.产品分离提纯:产品混合溶液经蒸发浓缩、冷却结晶、过滤洗涤、干燥,得到
 产品。
产品。Ⅲ.产品纯度测定:以淀粉作指示剂,用
 产品配制的溶液滴定碘标准溶液至滴定终点,计算
产品配制的溶液滴定碘标准溶液至滴定终点,计算 含量。
含量。请回答:
(1)步骤Ⅰ:单向阀的作用是
 过高或过低将导致产率降低,原因是
过高或过低将导致产率降低,原因是(2)步骤Ⅱ:下列说法正确的是
A 快速蒸发溶液中水分,可得较大晶体颗粒
B 蒸发浓缩至溶液表面出现品晶膜时,停止加热
C 冷却结晶后的固液混合物中加入乙醇可提高产率
D 可选用冷的
 溶液作洗涤剂
溶液作洗涤剂(3)步骤Ⅲ
①滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):
检漏→蒸馏水洗涤→
A 烘干 B 装入滴定液至零刻度以上 C 调整滴定液液面至零刻度或零刻度以下D 用洗耳球吹出润洗液 E 排除气泡 F 用滴定液润洗2至3次 G 记录起始读数
②装标准碘溶液的碘量瓶(带瓶塞的锥形瓶)在滴定前应盖上瓶塞,目的是
③滴定法测得产品中
 含量为
含量为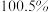 ,则
,则 产品中可能混有的物质是
产品中可能混有的物质是
您最近一年使用:0次
2020-07-11更新
|
5400次组卷
|
17卷引用:2020年浙江省高考化学试卷(7月选考)
2020年浙江省高考化学试卷(7月选考)(已下线)解密11 化学实验(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密12 实验化学(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)考点34 物质的制备与合成-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)解密11 化学实验基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密13 实验化学(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题16 化学实验综合题-2020年高考真题和模拟题化学分项汇编山东省济南市山东省实验中学西校2021届高三上学期10月份月考化学试题(已下线)专题讲座(九) 热点实验综合探究 (精讲)-2021年高考化学一轮复习讲练测(已下线)解密11 化学实验(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 硫及其化合物(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)辽宁省东北育才学校2021-2022学年高二上学期期中考试化学试题(已下线)解密11 化学实验(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)第11讲 硫及其化合物(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第一部分 化学综合实验 热点1 化学仪器与实验基本操作(已下线)专题19 实验综合题



