名校
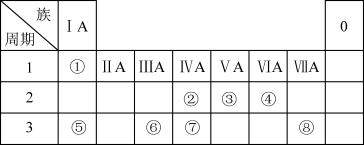
1 . 从1869年俄国化学家门捷列夫编制出第一张元素周期表到现在形成的周期表经过了众多化学家的艰辛努力。元素周期表体现了元素“位-构-性”的关系,揭示了元素间的内在联系。下表列出①~⑧八种元素在周期表中的位置,回答下列问题:
(1)②③④的原子半径由大到小的顺序是_______ (填元素符号)。
(2)⑧的元素符号是_______ ,它的最高价含氧酸的分子式是_______ 。
(3)④能形成多种同素异形体,如_______ 、_______ 等,它们之间的转化是_______ 变化(填“物理”或“化学”)。
(4)①与⑤形成的化合物可做野外生氢剂,写出该物质与水反应的化学方程式_______ ,其中氧化剂是_______ 。
(5)⑥与⑦的简单氢化物更稳定的是_______ (填化学式)。
(6)门捷列夫编制元素周期表时预言了几种当时还没有发现的元素,并在表中留了空位,其中铝元素正下方的“类铝”后来被发现并命名为“镓”,元素符号为 ,镓的金属性比铝
,镓的金属性比铝_______ (填“强”或“弱”),其氢氧化物与盐酸反应的化学方程式为_______ 。
族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)⑧的元素符号是
(3)④能形成多种同素异形体,如
(4)①与⑤形成的化合物可做野外生氢剂,写出该物质与水反应的化学方程式
(5)⑥与⑦的简单氢化物更稳定的是
(6)门捷列夫编制元素周期表时预言了几种当时还没有发现的元素,并在表中留了空位,其中铝元素正下方的“类铝”后来被发现并命名为“镓”,元素符号为
 ,镓的金属性比铝
,镓的金属性比铝
您最近一年使用:0次
2023-01-01更新
|
241次组卷
|
2卷引用:黑龙江省哈尔滨市2021-2022学年高一上学期期末学业质量检测化学试题
解题方法
2 . A、B、C、D、E、F、G均为常见短周期元素,原子序数依次递增。已知A、B、C能分别与D组成二元化合物K、L、M,甲、乙分别是B、D的单质,常温下分别是常见的固体和气体,化合物M是产生光化学烟雾的主要气体之一,丙是C的最高价氧化物对应的水化物,它们之间有如图所示转化关系。E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的主族元素。请回答下列问题:
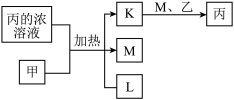
(1)C在元素周期表中的位置为_______ 。
(2)甲与丙的浓溶液反应的化学方程式为_______ 。
(3)化合物L的电子式为_______ ,M与水发生反应的化学方程式是_______ ,该反应的还原产物是_______ 。
(4)E、F、G形成的简单离子,半径由大到小顺序是_______ (用离子符号表示)。B、F、G元素的非金属性由强到弱的顺序_______ (用元素符号表示)。

(1)C在元素周期表中的位置为
(2)甲与丙的浓溶液反应的化学方程式为
(3)化合物L的电子式为
(4)E、F、G形成的简单离子,半径由大到小顺序是
您最近一年使用:0次
3 . 上海有机化学研究所施世良课题组以Ni(cod)2为催化剂实现了叔醇的手性合成。
(1)Ni在元素周期表中的位置是___________ ,写出其基态原子的最外层电子排布图:___________ 。
(2)Ni(cod)2是指双-(1,5-环辛二烯)镍,其结构如图所示。___________ 种。
②Ni(cod)2分子内存在的作用力有___________ (填序号)。
a.配位键 b.金属键 c.极性键 d.非极性键 e.氢键
(3)葡萄糖(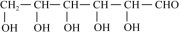 )分子中,手性碳原子个数为
)分子中,手性碳原子个数为 ___________ 。
(4)红银矿NiAs晶体结构如图所示:___________ 。
②两个As原子的原子分数坐标依次为( ,
, ,
, )和
)和___________ 。
③已知晶体密度为pg·cm-3,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则阿伏加德罗常数NA可表示为___________ mol-1(用含m、n和p的代数式表示)。
(1)Ni在元素周期表中的位置是
(2)Ni(cod)2是指双-(1,5-环辛二烯)镍,其结构如图所示。
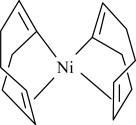
②Ni(cod)2分子内存在的作用力有
a.配位键 b.金属键 c.极性键 d.非极性键 e.氢键
(3)葡萄糖(
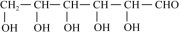 )分子中,手性碳原子个数为
)分子中,手性碳原子个数为 (4)红银矿NiAs晶体结构如图所示:
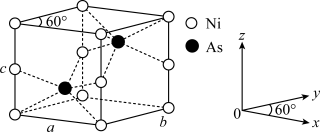
②两个As原子的原子分数坐标依次为(
 ,
, ,
, )和
)和③已知晶体密度为pg·cm-3,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则阿伏加德罗常数NA可表示为
您最近一年使用:0次
真题
名校
4 . 下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:
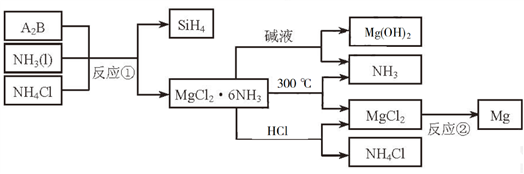
(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________ ,Mg在元素周期表中的位置:_____________________ ,Mg(OH)2的电子式:____________________ 。
(2)A2B的化学式为_______________ 。反应②的必备条件是_______________ 。上图中可以循环使用的物质有_______________ 。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_______________ (写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________ 。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:

依据上述信息,写出制备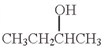 所需醛的可能结构简式:
所需醛的可能结构简式:_______________ 。

(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):
(2)A2B的化学式为
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:

依据上述信息,写出制备
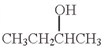 所需醛的可能结构简式:
所需醛的可能结构简式:
您最近一年使用:0次
2018-06-09更新
|
3025次组卷
|
13卷引用:【全国百强校】黑龙江省牡丹江市第一高级中学2017-2018学年高一下学期期末考试化学试题
【全国百强校】黑龙江省牡丹江市第一高级中学2017-2018学年高一下学期期末考试化学试题云南省西畴县第二中学2019-2020学年高三上学期期末考试化学试题贵州省镇远县二中2019-2020学年高三上学期期末考试化学试题2018年全国普通高等学校招生统一考试化学(天津卷)(已下线)2018年高考题及模拟题汇编 专题13 元素及其化合物知识的综合应用(已下线)高考母题题源15 物质结构与推断(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第2讲 铝及其化合物云南省玉溪元江民中2020届高三开学考试化学试题云南省弥勒市第四中学2019-2020学年高二上学期开学考试化学试题云南省石屏县第二中学2020届高三上学期开学考试化学试题云南省绿春县二中2019-2020学年高一上学期期中考试化学试题云南省玉溪市江川二中2019-2020学年高三上学期期中考试化学试题(已下线)专题08 常见无机物及其应用——备战2021年高考化学纠错笔记
名校
5 . 己二酸是一种重要的化工原料,科学家在现有工业路线基础上,提出了一条“绿色”合成路线;
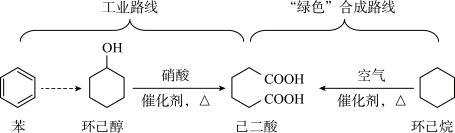
| A.环己烷分子的组成元素均位于元素周期表p区 |
| B.工业路线中涉及苯的取代反应,该反应需使用苯、浓溴水混合加热制得溴苯 |
C.由于环己醇分子之间存在氢键,环己醇的沸点比甲基环己烷(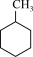 )高 )高 |
| D.己二酸分子中所含σ键个数与π键个数之比为11∶2 |
您最近一年使用:0次
名校
解题方法
6 . X、Y、Z、Q、W、R 六种短周期元素原子序数依次增大。化合物甲俗称苛性钠,由 X、Z、Q 三种元素 组成。医学中常用QR 溶液配制生理盐水。化合物乙由X、R 两种元素组成。请回答下列问题:
(1)Z 的离子结构示意图为___________ ,由X、Z、Q 三种元素组成的化合物与 R 单质反应的离子方程式___________ 。
(2)元素 Y 在元素周期表中的位置是第___________ 周期___________ 族
(3)与R 处于同一主族气态氢化物最稳定的元素是___________
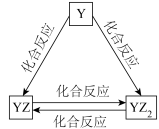
(4)Y元素的单质及其化合物能发生如图所示的转化,则 Y元素为___________ (填元素符号)。在甲溶液中通入少量YZ2气体,写出该反应的离子方程式:___________ 。
(5)W 的单质既能与甲溶液反应,又能与乙溶液反应。常温下,将 W 的单质和甲溶液混合,发生反应的离子方程式___________ 。
(1)Z 的离子结构示意图为
(2)元素 Y 在元素周期表中的位置是第
(3)与R 处于同一主族气态氢化物最稳定的元素是
(4)Y元素的单质及其化合物能发生如图所示的转化,则 Y元素为

(5)W 的单质既能与甲溶液反应,又能与乙溶液反应。常温下,将 W 的单质和甲溶液混合,发生反应的离子方程式
您最近一年使用:0次
名校
7 . 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答问题:
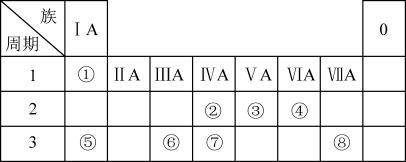
(1)地壳中含量居于第二位的元素在周期表中的位置是___________ 。
(2)⑦的最高价氧化物的水化物的分子式为___________ 。
(3)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是___________(填字母)。
(4)已知Cs元素位于元素周期表中第六周期第ⅠA族,请回答下列问题:
①铯的原子序数为___________ 。
②预测铯单质的还原性比钠单质的还原性___________ (填“弱”或“强”)。
③下列推断正确的是___________ (填字母)。
A.与铯处于同一主族的元素都是金属元素
B.铯单质发生反应时,铯原子易失去电子
C.碳酸铯是一种可溶性碱
D.铯离子的氧化性强于钾离子
(5)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,写出Y的原子序数b与a可能存在的所有的关系___________ 。

(1)地壳中含量居于第二位的元素在周期表中的位置是
(2)⑦的最高价氧化物的水化物的分子式为
(3)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是___________(填字母)。
| A.最高正化合价为+6 |
| B.气态氢化物比H2S稳定 |
| C.最高价氧化物对应水化物的酸性比硫酸弱 |
| D.单质在常温下可与氢气化合 |
①铯的原子序数为
②预测铯单质的还原性比钠单质的还原性
③下列推断正确的是
A.与铯处于同一主族的元素都是金属元素
B.铯单质发生反应时,铯原子易失去电子
C.碳酸铯是一种可溶性碱
D.铯离子的氧化性强于钾离子
(5)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,写出Y的原子序数b与a可能存在的所有的关系
您最近一年使用:0次
2022-01-03更新
|
410次组卷
|
2卷引用:黑龙江省鹤岗市第一中学2021-2022学年高一上学期期末考试化学试题
名校
解题方法
8 . Ⅰ.某气态烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,以A为原料的有机合成路线如下:

已知: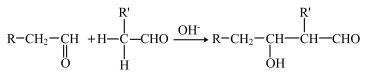
(1)D的核磁共振氢谱中有_______ 组峰,E中官能团名称_______ ,F的结构简式为_______ 。
(2)B→C的化学反应方程式为_______ 。
(3)F→G的反应类型为_______ 。
(4)H→I的化学反应方程式为_______ 。
Ⅱ.碳元素不仅可以形成大量的有机物,也可以形成无机物,例如金刚石。氮化硼晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被B原子代替。根据所学知识回答以下问题。
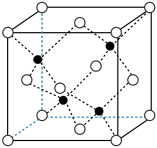
(5)BN晶体其晶胞参数为a pm,与同一个B原子相连的N原子构成的空间结构为_______ ,相邻的N与B之间的最近距离为_______ pm。BN的摩尔质量为M g·mol-1,阿伏加德罗常数的值为 ,则BN晶体的密度为
,则BN晶体的密度为_______ g·cm-3。
(6)晶体中距离同一个B原子最近的其他B原子个数为_______ 。
(7)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若沿y轴投影的晶胞中所有原子的分布图如图,1原子的分数坐标为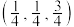 ,则4原子的分数坐标是
,则4原子的分数坐标是_______ 。


已知:

(1)D的核磁共振氢谱中有
(2)B→C的化学反应方程式为
(3)F→G的反应类型为
(4)H→I的化学反应方程式为
Ⅱ.碳元素不仅可以形成大量的有机物,也可以形成无机物,例如金刚石。氮化硼晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被B原子代替。根据所学知识回答以下问题。

(5)BN晶体其晶胞参数为a pm,与同一个B原子相连的N原子构成的空间结构为
 ,则BN晶体的密度为
,则BN晶体的密度为(6)晶体中距离同一个B原子最近的其他B原子个数为
(7)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若沿y轴投影的晶胞中所有原子的分布图如图,1原子的分数坐标为
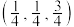 ,则4原子的分数坐标是
,则4原子的分数坐标是
您最近一年使用:0次
名校
9 . 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答问题:
(1)地壳中含量居于第二位的元素在周期表中的位置是___________ 。
(2)②的最高价氧化物的结构式为___________ ;⑦的最高价氧化物的水化物的分子式为___________ 。
(3)④、⑤元素可形成既含离子键又含非极性共价键的离子化合物,写出该化合物的电子式:___________ ;写出⑥的氧化物与⑤的最高价氧化物的水化物反应的离子方程式___________ 。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是___________ (填字母)。
A.最高正化合价为+6
B.气态氢化物比H2S稳定
C.最高价氧化物对应水化物的酸性比硫酸弱
D.单质在常温下可与氢气化合
(5)已知Cs元素位于元素周期表中第六周期第ⅠA族,请回答下列问题:
①铯的原子序数为___________ 。
②预测铯单质的还原性比钠单质的还原性___________ (填“弱”或“强”)。
③下列推断正确的是___________ (填字母)。
A.与铯处于同一主族的元素都是金属元素
B.铯单质发生反应时,铯原子易失去电子
C.碳酸铯是一种可溶性碱
D.铯离子的氧化性强于钾离子
(6)已知X为第ⅡA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,写出Y的原子序数b与a可能存在的所有的关系___________ 。

(1)地壳中含量居于第二位的元素在周期表中的位置是
(2)②的最高价氧化物的结构式为
(3)④、⑤元素可形成既含离子键又含非极性共价键的离子化合物,写出该化合物的电子式:
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是
A.最高正化合价为+6
B.气态氢化物比H2S稳定
C.最高价氧化物对应水化物的酸性比硫酸弱
D.单质在常温下可与氢气化合
(5)已知Cs元素位于元素周期表中第六周期第ⅠA族,请回答下列问题:
①铯的原子序数为
②预测铯单质的还原性比钠单质的还原性
③下列推断正确的是
A.与铯处于同一主族的元素都是金属元素
B.铯单质发生反应时,铯原子易失去电子
C.碳酸铯是一种可溶性碱
D.铯离子的氧化性强于钾离子
(6)已知X为第ⅡA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,写出Y的原子序数b与a可能存在的所有的关系
您最近一年使用:0次
10 . 乙烯和丙烯是工业生产中非常重要的化工基本原料。
I.丙烯(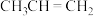 )是一种重要的化工原料,它存在如下转化关系:
)是一种重要的化工原料,它存在如下转化关系:_______ 。
(2)在120℃、 条件下时,取一定体积的丙烯和足量的氧气混合点燃,相同条件下测得反应前后气体体积将
条件下时,取一定体积的丙烯和足量的氧气混合点燃,相同条件下测得反应前后气体体积将_______ (填“变大”“变小”或“不变”)。
(3)丙烯能使溴水褪色,其反应的化学方程式为_______ ,反应类型为_______ 。
Ⅱ.以乙烯为原料制备一种工业增塑剂的合成路线如图:_______ 。
(5)有机物B与足量金属钠反应的化学方程式为_______ 。
(6)合成增塑剂的化学方程式为_______ ,反应类型是_______ 。
I.丙烯(
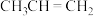 )是一种重要的化工原料,它存在如下转化关系:
)是一种重要的化工原料,它存在如下转化关系: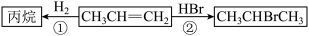
(2)在120℃、
 条件下时,取一定体积的丙烯和足量的氧气混合点燃,相同条件下测得反应前后气体体积将
条件下时,取一定体积的丙烯和足量的氧气混合点燃,相同条件下测得反应前后气体体积将(3)丙烯能使溴水褪色,其反应的化学方程式为
Ⅱ.以乙烯为原料制备一种工业增塑剂的合成路线如图:
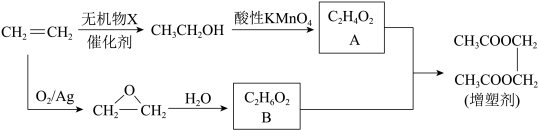
(5)有机物B与足量金属钠反应的化学方程式为
(6)合成增塑剂的化学方程式为
您最近一年使用:0次
2023-01-09更新
|
1271次组卷
|
4卷引用:黑龙江省哈尔滨市第一二二中学2021-2022学年高一下学期期末考试化学试题
黑龙江省哈尔滨市第一二二中学2021-2022学年高一下学期期末考试化学试题(已下线)专题06 乙醇、乙酸、糖、油、蛋白质(知识串讲+专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(沪科版2020必修第二册)名校期末好题汇编-有机化合物(非选择题)新疆塔城地区第一高级中学2023-2024学年高二下学期5月期中考试化学试题



