1 . Ⅰ.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(22Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第四周期第___ 族;其基态原子的电子排布式为___ 。
(2)在Ti的化合物中,Ti可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好、介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如图所示,则它的化学式是___ ,其中Ti4+的氧配位数为___ ,Ba2+的氧配位数为____ 。

(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4是___ 晶体。
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如图a所示,我们通常可以用图b所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体形,它有___ 种同分异构体。

(5)已知过氧化氢分子的空间结构如图c所示,分子中氧原子采取___ 杂化。

(6)24Cr是1~36号元素中未成对电子数最多的原子,Cr3+在溶液中存在如下转化关系:Cr3+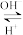 Cr(OH)3
Cr(OH)3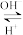 [Cr(OH)4]-。
[Cr(OH)4]-。
①基态Cr原子的价电子排布式为___ 。
②Cr(OH)3是分子晶体,[Cr(OH)4]-中存在的化学键是___ (填标号)。
A.离子键 B.极性键 C.非极性键 D.配位键
(1)Ti元素在元素周期表中的位置是第四周期第
(2)在Ti的化合物中,Ti可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好、介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如图所示,则它的化学式是

(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4是
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如图a所示,我们通常可以用图b所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体形,它有

(5)已知过氧化氢分子的空间结构如图c所示,分子中氧原子采取

(6)24Cr是1~36号元素中未成对电子数最多的原子,Cr3+在溶液中存在如下转化关系:Cr3+
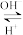 Cr(OH)3
Cr(OH)3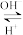 [Cr(OH)4]-。
[Cr(OH)4]-。①基态Cr原子的价电子排布式为
②Cr(OH)3是分子晶体,[Cr(OH)4]-中存在的化学键是
A.离子键 B.极性键 C.非极性键 D.配位键
您最近一年使用:0次
解题方法
2 . 以苯为原料合成F,转化关系如下:
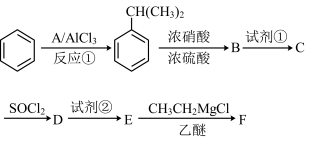
F是一种具有重要工业价值的芳香化合物,含有C、H、O、N四种元素,其蒸气密度是相同状况下氢气密度的74.5倍,分子中有两个互为对位的取代基。C能与碳酸氢钠溶液反应,试剂②为Fe/HCl。
已知:①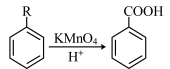 ;
;
② (苯胺:弱碱性,易被氧化)
(苯胺:弱碱性,易被氧化)
③RCOCl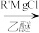 RCOR’
RCOR’
请回答下列问题:
(1)反应①为加成反应,写出A的化学式:_____________ 。
(2)B中所含官能团的名称为________ ;生成B时,常伴有副反应发生,反应所得产物除B外可能还含有____________________ (写出一种产物的结构简式)。
(3)试剂①是_____________ ;试剂①和试剂②的顺序能否互换:________ (填“能”或“不能”);为什么?_________________________________________________________ 。
(4)E生成F的化学方程式为__________________________________________________ 。
(5)参照上述合成路线,以(CH3)2CHCHO和CH3MgCl为原料(无机试剂任选),设计制备(CH3)2CHCOCH3的合成路线____________________________ 。

F是一种具有重要工业价值的芳香化合物,含有C、H、O、N四种元素,其蒸气密度是相同状况下氢气密度的74.5倍,分子中有两个互为对位的取代基。C能与碳酸氢钠溶液反应,试剂②为Fe/HCl。
已知:①
 ;
;②
 (苯胺:弱碱性,易被氧化)
(苯胺:弱碱性,易被氧化)③RCOCl
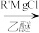 RCOR’
RCOR’ 请回答下列问题:
(1)反应①为加成反应,写出A的化学式:
(2)B中所含官能团的名称为
(3)试剂①是
(4)E生成F的化学方程式为
(5)参照上述合成路线,以(CH3)2CHCHO和CH3MgCl为原料(无机试剂任选),设计制备(CH3)2CHCOCH3的合成路线
您最近一年使用:0次
名校
解题方法
3 . I.氧化还原反应原理在研究物质性质及物质转化方面具有重要的价值。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式___________ 。
(2)火药是中国的四大发明之一,永远值得中华儿女骄傲。黑火药在发生爆炸时,发生如下反应2KNO3+3C+S=K2S+N2↑+3CO2↑,则生成1molN2反应过程中转移电子的数目为___________ 。
(3)中国古代著作中有“银针验毒”的记录,其原理为4Ag+2H2S+O2=2X+2H2O,则X的化学式是___________ ,其中 H2S在该反应中___________ (填序号)。
A.作氧化剂 B.作还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(4)砒霜(As2O3)与Zn可以发生如下反应As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O,其中氢元素的化合价未发生改变。在上述反应中As2O3,显示出来的性质是___________ (填“还原性”或“氧化性”)。
II.元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。下表是元素周期表的一部分,数字①~⑨代表九种常见的短周期元素,请按题目要求回答下列问题:___________ 。
(6)在①~⑨元素中,原子半径最大的元素,其某种氧化物可用于呼吸面具中氧气来源,请写出该物质与二氧化碳反应化学方程式___________ 。
(7)写出⑤、⑦两种元素所形成的最高价氧化物对应的水化物反应的离子方程式是___________ 。
(8)比较④与⑨的简单气态氢化物的稳定性___________ >___________ (填化学式)。
(9)由下列元素形成的化合物中含有离子键的是___________。
(10)写出⑤在空气中燃烧产物的电子式:___________ 。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式
(2)火药是中国的四大发明之一,永远值得中华儿女骄傲。黑火药在发生爆炸时,发生如下反应2KNO3+3C+S=K2S+N2↑+3CO2↑,则生成1molN2反应过程中转移电子的数目为
(3)中国古代著作中有“银针验毒”的记录,其原理为4Ag+2H2S+O2=2X+2H2O,则X的化学式是
A.作氧化剂 B.作还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(4)砒霜(As2O3)与Zn可以发生如下反应As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O,其中氢元素的化合价未发生改变。在上述反应中As2O3,显示出来的性质是
II.元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。下表是元素周期表的一部分,数字①~⑨代表九种常见的短周期元素,请按题目要求回答下列问题:

(6)在①~⑨元素中,原子半径最大的元素,其某种氧化物可用于呼吸面具中氧气来源,请写出该物质与二氧化碳反应化学方程式
(7)写出⑤、⑦两种元素所形成的最高价氧化物对应的水化物反应的离子方程式是
(8)比较④与⑨的简单气态氢化物的稳定性
(9)由下列元素形成的化合物中含有离子键的是___________。
| A.①③ | B.②③ | C.①④ | D.⑥⑨ |
您最近一年使用:0次
名校
解题方法
4 . 某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体( ):
):
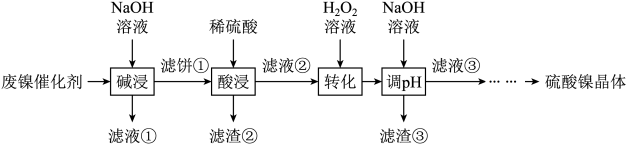
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)Ni在元素周期表中的位置___________ 。
(2)“碱浸”中NaOH的两个作用,一个是溶解铝及其氧化物,另一个是___________ 。为回收金属,用稀硫酸将“滤液①”中的铝元素恰好完全转化为沉淀的pH为___________ 。(通常认为溶液中离子浓度小于 为沉淀完全;
为沉淀完全; :
: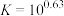 ,
,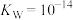 ,
, )
)
(3)“转化”中发生的离子反应为___________ ,可替代 的物质是
的物质是___________ 。
(4)利用上述表格数据,如果“转化”后的溶液中 浓度为
浓度为 ,则“调pH”应控制的pH范围是
,则“调pH”应控制的pH范围是___________ 。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式___________ 。
(6)由滤液③得到硫酸镍晶体的一系列操作为___________ 。
 ):
):
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
开始沉淀时( )的pH )的pH沉淀完全时(  )的pH )的pH | 7.2 8.7 | 3.7 4.7 | 2.2 3.2 | 7.5 9.0 |
回答下列问题:
(1)Ni在元素周期表中的位置
(2)“碱浸”中NaOH的两个作用,一个是溶解铝及其氧化物,另一个是
 为沉淀完全;
为沉淀完全; :
: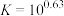 ,
,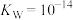 ,
, )
)(3)“转化”中发生的离子反应为
 的物质是
的物质是(4)利用上述表格数据,如果“转化”后的溶液中
 浓度为
浓度为 ,则“调pH”应控制的pH范围是
,则“调pH”应控制的pH范围是(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式
(6)由滤液③得到硫酸镍晶体的一系列操作为
您最近一年使用:0次
解题方法
5 . 海洋资源的利用具有非常广阔的研究价值。
Ⅰ.利用空气吹出法从海水(弱碱性)中提取溴的流程如图。
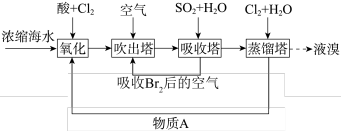
已知:溴单质的沸点为 。
。
(1)溴元素在元素周期表中的位置是___________ 。
(2)“氧化”中发生反应的离子方程式为___________ 。
(3)“蒸馏塔”中温度应控制在___________ (填字母序号)。
A.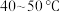 B.
B.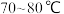 C.
C. 以上
以上
(4)物质A___________ (填化学式)可以循环利用,降低成本。
(5)探究“氧化”的适宜条件。下图为不同条件下海水中被氧化的 的百分含量。
的百分含量。
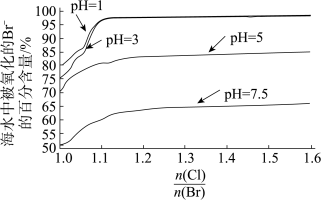
注: 表示加入氯元素与海水中溴元素物质的量之比。
表示加入氯元素与海水中溴元素物质的量之比。
①“氧化”的适宜条件为___________ 。
②若海水中溴的浓度为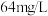 ,经该方法处理
,经该方法处理 海水后最终得到
海水后最终得到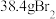 ,则溴的总提取率为
,则溴的总提取率为___________ 。
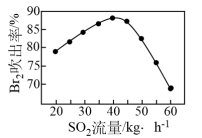
③吹出塔中, 吹出率与吸收塔中
吹出率与吸收塔中 流量的关系如图所示。由图可知,
流量的关系如图所示。由图可知, 流量过大,
流量过大, 吹出率反而下降,原因是
吹出率反而下降,原因是___________ 。
Ⅱ.离子交换法从海带中提取碘是一种较为先进的制碘工艺。使用离子交换树脂的“离子交换法”从海带中提取碘的主要流程如下:
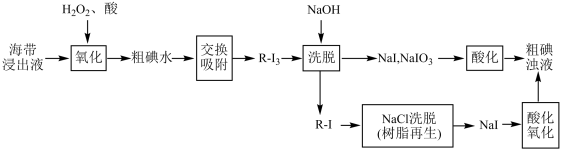
已知:① ;
;
②强碱性阴离子树脂(用 表示,
表示, 可被其它更易被吸附的阴离子替代)对多磺离子(
可被其它更易被吸附的阴离子替代)对多磺离子( )有很强的交换吸附能力;
)有很强的交换吸附能力;
③“交换吸附”发生的反应为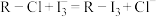 。
。
回答下列问题:
(6)下列各步反应中,不属于氧化还原反应的有___________(填字母序号)。
(7)“氧化”时发生的反应有①___________ ;②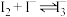 。
。
Ⅰ.利用空气吹出法从海水(弱碱性)中提取溴的流程如图。

已知:溴单质的沸点为
 。
。(1)溴元素在元素周期表中的位置是
(2)“氧化”中发生反应的离子方程式为
(3)“蒸馏塔”中温度应控制在
A.
 B.
B.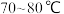 C.
C. 以上
以上(4)物质A
(5)探究“氧化”的适宜条件。下图为不同条件下海水中被氧化的
 的百分含量。
的百分含量。
注:
 表示加入氯元素与海水中溴元素物质的量之比。
表示加入氯元素与海水中溴元素物质的量之比。①“氧化”的适宜条件为
②若海水中溴的浓度为
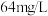 ,经该方法处理
,经该方法处理 海水后最终得到
海水后最终得到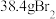 ,则溴的总提取率为
,则溴的总提取率为③吹出塔中,
 吹出率与吸收塔中
吹出率与吸收塔中 流量的关系如图所示。由图可知,
流量的关系如图所示。由图可知, 流量过大,
流量过大, 吹出率反而下降,原因是
吹出率反而下降,原因是
Ⅱ.离子交换法从海带中提取碘是一种较为先进的制碘工艺。使用离子交换树脂的“离子交换法”从海带中提取碘的主要流程如下:

已知:①
 ;
;②强碱性阴离子树脂(用
 表示,
表示, 可被其它更易被吸附的阴离子替代)对多磺离子(
可被其它更易被吸附的阴离子替代)对多磺离子( )有很强的交换吸附能力;
)有很强的交换吸附能力;③“交换吸附”发生的反应为
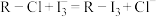 。
。回答下列问题:
(6)下列各步反应中,不属于氧化还原反应的有___________(填字母序号)。
| A.交换吸附 | B.洗脱 | C.酸化氧化 | D. 洗脱 洗脱 |
 。
。
您最近一年使用:0次
6 . A、B、C、D、E、F、G是元素周期表前四周期常见元素,有关信息如下:
①E、F同周期,其电离能数据如下(单位:kJ·mol-1):
②短周期元素A原子的价电子排布式为ns2np2,D的单质可在C的单质中燃烧;
③元素周期表中主族元素的一部分如图;
④元素G最大能层符号为N,有4个单电子。
试回答下列问题:
(1)A在周期表中的位置为_______ 。
(2)基态D原子的核外电子排布式为_______ ,其能量最高的轨道呈_______ 形。
(3)A、B、C三种元素的第一电离能由大到小的顺序为_______ (用元素符号表示)。
(4)元素B与元素M在周期表中的位置呈现对角线关系,已知元素B、M的电负性分别为3.0和1.8,则它们形成的化合物是_______ (填“离子化合物”或“共价化合物”)。
(5)化合价是元素的一种性质,由E、F的电离能数据判断下列说法正确的是_______ (填标号)。
aE通常显十1价,F通常显+4价
b.元素F的第一电离能较小,其活泼性比E强
c.E、F的单质分别与盐酸反应放出等量氢气时,消耗单质的物质的量之比为3:2
(6)元素G位于周期表的_______ 区,该元素可形成G2+、G3+,其中较稳定的是G3+,原因是_______ 。
(7)由A、B、C、D四种元素中的某种元素与氢元素组成的三角锥形分子R和由以上某种元素组成的分子P反应,生成一种V型分子L和一种分子Q,反应如图所示,该反应的化学方程式是_______ 。

①E、F同周期,其电离能数据如下(单位:kJ·mol-1):
| I1 | I2 | I3 | I4 | |
| E | 738 | 1451 | 7733 | 10540 |
| F | 578 | 1817 | 2745 | 11575 |
②短周期元素A原子的价电子排布式为ns2np2,D的单质可在C的单质中燃烧;
③元素周期表中主族元素的一部分如图;
| A | B | C |
| D |
④元素G最大能层符号为N,有4个单电子。
试回答下列问题:
(1)A在周期表中的位置为
(2)基态D原子的核外电子排布式为
(3)A、B、C三种元素的第一电离能由大到小的顺序为
(4)元素B与元素M在周期表中的位置呈现对角线关系,已知元素B、M的电负性分别为3.0和1.8,则它们形成的化合物是
(5)化合价是元素的一种性质,由E、F的电离能数据判断下列说法正确的是
aE通常显十1价,F通常显+4价
b.元素F的第一电离能较小,其活泼性比E强
c.E、F的单质分别与盐酸反应放出等量氢气时,消耗单质的物质的量之比为3:2
(6)元素G位于周期表的
(7)由A、B、C、D四种元素中的某种元素与氢元素组成的三角锥形分子R和由以上某种元素组成的分子P反应,生成一种V型分子L和一种分子Q,反应如图所示,该反应的化学方程式是

您最近一年使用:0次
7 . 下表是元素周期表的一部分。表中所列字母分别代表一种元素。
回答下列问题:
(1)j在元素周期表中的位置是______ 。
(2)e、h、m形成的简单离子其半径由大到小的顺序为________ 。(填写离子符号)
(3)n与g形成的化合物为______ (填写化学式,下同),将该化合物进行焰色反应,火焰呈______ 色。
(4)k、1形成的最高价氧化物的水化物,酸性由强到弱的顺序为______ 。
(5)g的最高价氧化物对应的水化物与i的最高价氧化物对应的水化物反应的离子方程式为______ 。
(6)某同学欲探究元素性质递变规律与原子结构的关系,进行如下实验:
(实验操作)取已除去氧化膜且面积相等的镁条和铝条,分别投入2mL1mol/L盐酸中;
(实验现象)镁与酸反应比铝更剧烈;
(实验结论)①金属性:Mg_____ Al(选填“>”或“<”);
(查阅资料)原子半径(nm)Mg:0.160 Al:0.143;
(思考)②利用元素周期律对上述实验结论进行解释______ 。
| a | b | |||||||
| c | d | e | f | |||||
| g | h | i | j | k | l | m | ||
| n |
(1)j在元素周期表中的位置是
(2)e、h、m形成的简单离子其半径由大到小的顺序为
(3)n与g形成的化合物为
(4)k、1形成的最高价氧化物的水化物,酸性由强到弱的顺序为
(5)g的最高价氧化物对应的水化物与i的最高价氧化物对应的水化物反应的离子方程式为
(6)某同学欲探究元素性质递变规律与原子结构的关系,进行如下实验:
(实验操作)取已除去氧化膜且面积相等的镁条和铝条,分别投入2mL1mol/L盐酸中;
(实验现象)镁与酸反应比铝更剧烈;
(实验结论)①金属性:Mg
(查阅资料)原子半径(nm)Mg:0.160 Al:0.143;
(思考)②利用元素周期律对上述实验结论进行解释
您最近一年使用:0次
2022-01-14更新
|
785次组卷
|
4卷引用:湖南省怀化市2021-2022学年高一上学期期末考试化学试题
湖南省怀化市2021-2022学年高一上学期期末考试化学试题(已下线)第四章 物质结构 元素周期律(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)湖北省孝感市新高考联考协作体2022-2023学年高二上学期9月联考化学试题(已下线)【2023】【高一下】【其他】【杭高卷四-期中复习卷】【高中化学】【刘尼尼收集】
8 . 部分短周期主族元素原子半径与原子序数的关系如图,根据所学知识回答下列问题。
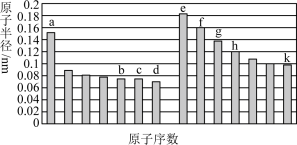
(1)a的原子结构示意图为___________ 。
(2)b、c、d、k四种元素的最简单氢化物中,最稳定的是___________ (填化学式)。
(3)上述9种元素中金属性最强的是___________ (填元素符号,下同),非金属性最强的是___________
(4)e与c能形成一种淡黄色的物质,其电子式为___________ 。
(5)g的最高价氧化物对应的水化物与NaOH溶液反应的离子方程式为___________ 。
(6)由a的单质制成的电池需要注意防水,其原因为___________ (用化学方程式表示)。
(7)门捷列夫在研究元素周期表时,科学地预言了11种当时尚未发现的元素,他认为g的下一周期存在一种“类g”元素,该元素多年后被法国化学家发现,命名为镓(Ga),镓在元素周期表中的位置为___________ 。预测g与Ga的最高价氧化物对应水化物的碱性较强的是___________ (填最高价氧化物对应水化物的化学式)。

(1)a的原子结构示意图为
(2)b、c、d、k四种元素的最简单氢化物中,最稳定的是
(3)上述9种元素中金属性最强的是
(4)e与c能形成一种淡黄色的物质,其电子式为
(5)g的最高价氧化物对应的水化物与NaOH溶液反应的离子方程式为
(6)由a的单质制成的电池需要注意防水,其原因为
(7)门捷列夫在研究元素周期表时,科学地预言了11种当时尚未发现的元素,他认为g的下一周期存在一种“类g”元素,该元素多年后被法国化学家发现,命名为镓(Ga),镓在元素周期表中的位置为
您最近一年使用:0次
名校
9 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,表中所列的字母分别代表某一化学元素。回答下列问题:

(1)元素B在元素周期表中的位置是第____ 周期第_____ 族,A、B、C三种元素原子半径从大到小的顺序是_________________ ;(填元素符号)
(2)D简单离子的结构示意图为_____________ ,用电子式表示D2C的形成过程_______ 。
(3)下列说法正确的是( ) (填序号)
①B的简单气态氢化物比C的稳定
②D元素的最高价氧化物对应的水化物的碱性比E的强
③D元素的单质与水反应比E元素的单质与水反应更剧烈
④B的简单阴离子比C的简单阴离子还原性强
(4)D单质在空气中燃烧可生成淡黄色粉末X(D2O2),X常用作呼吸面具和潜水艇中的供氧剂,可选用合适的化学试剂和下图所示实验装置证明X有提供氧气的作用。
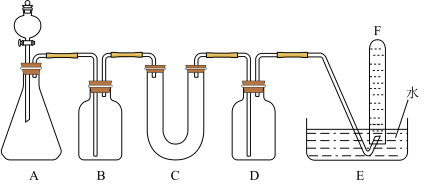
①装置A使用石灰石与浓盐酸反应制取CO2,装置B中饱和NaHCO3溶液的作用是除去_____________ ;(填化学式)
②装置C中X与CO2反应的化学方程式是_____________________ ,装置D盛放NaOH溶液的作用是除去____________ 。(填化学式)

(1)元素B在元素周期表中的位置是第
(2)D简单离子的结构示意图为
(3)下列说法正确的是
①B的简单气态氢化物比C的稳定
②D元素的最高价氧化物对应的水化物的碱性比E的强
③D元素的单质与水反应比E元素的单质与水反应更剧烈
④B的简单阴离子比C的简单阴离子还原性强
(4)D单质在空气中燃烧可生成淡黄色粉末X(D2O2),X常用作呼吸面具和潜水艇中的供氧剂,可选用合适的化学试剂和下图所示实验装置证明X有提供氧气的作用。

①装置A使用石灰石与浓盐酸反应制取CO2,装置B中饱和NaHCO3溶液的作用是除去
②装置C中X与CO2反应的化学方程式是
您最近一年使用:0次
名校
解题方法
10 . 聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景。PPG的一种合成路线如下:
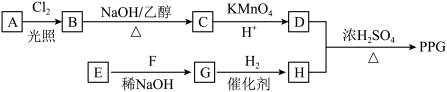
已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物B为单氯代烃,化合物C的分子式为C5H8;
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质;
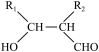
④R1CHO+R2CH2CHO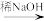
⑤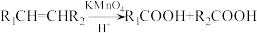
回答下列问题:
(1)A的结构简式为___________ ,E和F生成G的反应类型为___________ 。
(2)由B生成C的化学方程式为___________ 。
(3)由D和H生成PPG的化学方程式为___________ 。
(4)D的同分异构体中能同时满足下列条件的共有___________ 种(不含立体异构):
①能与饱和NaHCO3溶液反应产生气体 ②既能发生银镜反应,又能发生水解反应
其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是___________ (写结构简式)
(5)以乙醇为起始原料,选用必要的无机试剂合成1-丁烯,写出合成路线(用结构简式表示有机物)用箭头表示转化关系,箭头上注明试剂和反应条件。___________

已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物B为单氯代烃,化合物C的分子式为C5H8;
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质;
④R1CHO+R2CH2CHO
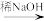

⑤
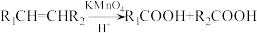
回答下列问题:
(1)A的结构简式为
(2)由B生成C的化学方程式为
(3)由D和H生成PPG的化学方程式为
(4)D的同分异构体中能同时满足下列条件的共有
①能与饱和NaHCO3溶液反应产生气体 ②既能发生银镜反应,又能发生水解反应
其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是
(5)以乙醇为起始原料,选用必要的无机试剂合成1-丁烯,写出合成路线(用结构简式表示有机物)用箭头表示转化关系,箭头上注明试剂和反应条件。
您最近一年使用:0次



