解题方法
1 . A、B、C、D、E五种元素中,A、B、C、D为原子序数依次增大的短周期主族元素,A的电子层数等于其最外层电子数且在同周期中A的原子半径最小,B、C、D元素的常见单质均为气体、其中B、C的单质是空气的主要成分,D与其他元素不在同一周期,E为常见使用量最大的金属,在一定条件下,A的单质可以分别与C、D的单质化合生成甲、乙。各物质间有如图转化关系,回答下列问题:.
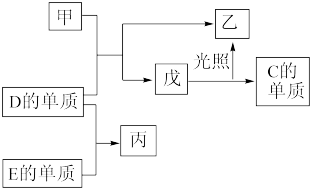
(1)D在元素周期表中的位置为____ 。
(2)写出B的单质的电子式:____ 。
(3)戊的分子中D元素的化合价为____ 。写出戊在光照条件下发生反应的化学方程式:____ 。
(4)A、B、C三种元素的原子半径从大到小的顺序为____ (用元素符号表示)。
(5)钠在C的气体中燃烧可以生成淡黄色固体,该物质中阳离子与阴离子的个数比为____ 。
(6)丙具有很强的氧化性,丙的饱和溶液可以将E的单质溶解,试写出丙与E反应的离子方程式:____ 。

(1)D在元素周期表中的位置为
(2)写出B的单质的电子式:
(3)戊的分子中D元素的化合价为
(4)A、B、C三种元素的原子半径从大到小的顺序为
(5)钠在C的气体中燃烧可以生成淡黄色固体,该物质中阳离子与阴离子的个数比为
(6)丙具有很强的氧化性,丙的饱和溶液可以将E的单质溶解,试写出丙与E反应的离子方程式:
您最近一年使用:0次
2 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系,如图是元素周期表的一部分,回答下列问题:

(1)元素B在周期表中的位置:___________ ;C元素的名称:___________ 。
(2)元素E最高价氧化物对应水化物的化学式:___________ ;其含有化学键的类型包括:___________ 。
(3)E与F的简单离子半径较大的是___________ (填离子符号),工业冶炼F单质的化学方程式为___________ 。
(4)高温条件下,金属铁可与C的氢化物反应,其化学方程式为:___________ 。

(1)元素B在周期表中的位置:
(2)元素E最高价氧化物对应水化物的化学式:
(3)E与F的简单离子半径较大的是
(4)高温条件下,金属铁可与C的氢化物反应,其化学方程式为:
您最近一年使用:0次
2024-01-25更新
|
63次组卷
|
2卷引用:陕西省安康市第二中学2023-2024学年高一上学期期末考试化学试卷
3 . 富硒酵母、二氧化硅、硫黄等食品添加剂用于食品生产中,丰富舌尖上的营养和美味。请回答下列问题:
(1)富硒酵母是一种新型添加剂,34Se在元素周期表中的位置为___________ 。
(2)下列说法正确的是___________(填字母)。
(3)短周期元素d、e、f、g、h都可能存在于某些食品添加剂中,其最高正化合价或最低负化合价与原子序数的关系如图所示:
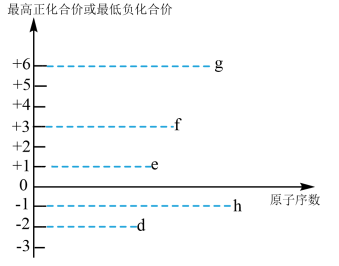
①g的最简单氢化物中含有的化学键类型为___________ (填字母)。
A.离子键 B.非极性共价键 C.极性共价键
②d、e、f、g、h元素形成的简单离子中,半径最大的离子结构示意图为___________ 。
③e和d组成的淡黄色固体的电子式为___________ 。
④写出一种比较e、f两种元素金属性的方法___________ 。
(1)富硒酵母是一种新型添加剂,34Se在元素周期表中的位置为
(2)下列说法正确的是___________(填字母)。
| A.稳定性:H2Se>H2S>H2O | B.36S与74Se的中子数之和为60 |
| C.酸性:H2SeO4>H2SO4>HClO4 | D.还原性:S2>Se2﹣ |
(3)短周期元素d、e、f、g、h都可能存在于某些食品添加剂中,其最高正化合价或最低负化合价与原子序数的关系如图所示:

①g的最简单氢化物中含有的化学键类型为
A.离子键 B.非极性共价键 C.极性共价键
②d、e、f、g、h元素形成的简单离子中,半径最大的离子结构示意图为
③e和d组成的淡黄色固体的电子式为
④写出一种比较e、f两种元素金属性的方法
您最近一年使用:0次
解题方法
4 . “变化是绝对的,不变是相对的”,看似情性的稀有气体在一定条件下也可发生化学变化。如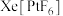 、
、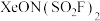 、
、 等均被合成出来。回答下列问题:
等均被合成出来。回答下列问题:
(1)基态F原子的外围电子排布图为___________ ,其中能量最高的电子所占据原子轨道的电子云轮廓图为___________ 形。
(2)Xe元素位于元素周期表___________ (填“s”、“d”或“p”)区。
(3)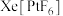 中提供空轨道的为
中提供空轨道的为___________ (填元素符号),阴离子的中心原子的配位数为___________ 。
(4)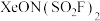 中
中 、
、 、
、 的第一电离能由小到大的顺序是
的第一电离能由小到大的顺序是___________ 。
(5)已知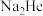 的晶胞结构如图所示,设晶胞边长为anm,阿伏加德罗常数为
的晶胞结构如图所示,设晶胞边长为anm,阿伏加德罗常数为 。
。
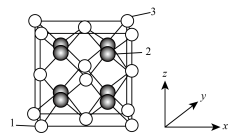
①以晶胞边长为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在晶胞坐标系中,1号原子的坐标为(0,0,0,),3号原子的坐标为(1,1,1),则2号原子的坐标为___________ 。
②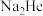 的晶胞中含有的He原子数是
的晶胞中含有的He原子数是___________ 。
③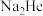 晶体的密度为
晶体的密度为___________  。
。
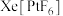 、
、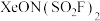 、
、 等均被合成出来。回答下列问题:
等均被合成出来。回答下列问题:(1)基态F原子的外围电子排布图为
(2)Xe元素位于元素周期表
(3)
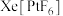 中提供空轨道的为
中提供空轨道的为(4)
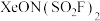 中
中 、
、 、
、 的第一电离能由小到大的顺序是
的第一电离能由小到大的顺序是(5)已知
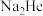 的晶胞结构如图所示,设晶胞边长为anm,阿伏加德罗常数为
的晶胞结构如图所示,设晶胞边长为anm,阿伏加德罗常数为 。
。
①以晶胞边长为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在晶胞坐标系中,1号原子的坐标为(0,0,0,),3号原子的坐标为(1,1,1),则2号原子的坐标为
②
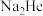 的晶胞中含有的He原子数是
的晶胞中含有的He原子数是③
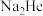 晶体的密度为
晶体的密度为 。
。
您最近一年使用:0次
5 . A、B、C、D、E、F、G是元素周期表前四周期常见的元素,且原子序数依次增大,其相关信息如表所示,请回答下列问题。
(1)A在元素周期表中的位置为___________ ,画出基态B原子的轨道表示式___________ 。
(2)F元素基态原子的最高能级具有的原子轨道数为___________ ,该原子轨道呈___________ 形。
(3)已知元素A、B形成的 链状分子中所有的原子都满足8电子稳定结构,则其分子中σ键与π键数目之比为
链状分子中所有的原子都满足8电子稳定结构,则其分子中σ键与π键数目之比为___________ 。
(4)C元素可形成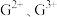 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是___________ 。
(5)短周期元素M与元素E在周期表中的位置呈现对角线关系,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是___________ (填“离子”或“共价”)化合物。推测M的最高价氧化物对应的水化物___________ (填“能”或“不能”)与D的最高价氧化物对应水化物发生反应。
| A | 原子核外有6个电子 |
| B | 原子序数比A大1 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子价层电子排布式为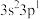 |
| F | 基态原子的最外层p轨道有2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 生活中使用最多的一种金属,其高价氯化物的盐溶液常用于刻蚀铜制印刷电路板 |
(2)F元素基态原子的最高能级具有的原子轨道数为
(3)已知元素A、B形成的
 链状分子中所有的原子都满足8电子稳定结构,则其分子中σ键与π键数目之比为
链状分子中所有的原子都满足8电子稳定结构,则其分子中σ键与π键数目之比为(4)C元素可形成
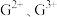 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是(5)短周期元素M与元素E在周期表中的位置呈现对角线关系,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是
您最近一年使用:0次
解题方法
6 . 一种用于合成治疗免疫疾病药物的物质,其结构如图所示,其中X、Y、Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。
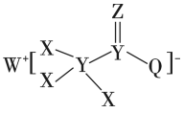
(1)Y在元素周期表中的位置为_______ 。
(2)五种元素原子半径由大到小的顺序为_______ (用元素符号表示),Z、Q、W的离子半径最小的是_______ (填离子符号)。
(3)元素W、Z可形成化合物 ,用电子式表示
,用电子式表示 的形成过程:
的形成过程:_______ (用元素符号表示)。
(4)W的最高价氧化物对应的水化物与Al反应的离子方程式为_______ 。
(5)元素W的金属性_______ (填“>”或“<”)元素Na的金属性,下列方法可证明这一事实的是_______ (填字母)。
a.比较元素W的单质和Na单质分别与水反应的剧烈程度
b.比较元素W与Na最高价氧化物对应水化物碱性的强弱
c.比较常温下W的单质与Na的单质的物理状态
d.比较二者原子半径的大小

(1)Y在元素周期表中的位置为
(2)五种元素原子半径由大到小的顺序为
(3)元素W、Z可形成化合物
 ,用电子式表示
,用电子式表示 的形成过程:
的形成过程:(4)W的最高价氧化物对应的水化物与Al反应的离子方程式为
(5)元素W的金属性
a.比较元素W的单质和Na单质分别与水反应的剧烈程度
b.比较元素W与Na最高价氧化物对应水化物碱性的强弱
c.比较常温下W的单质与Na的单质的物理状态
d.比较二者原子半径的大小
您最近一年使用:0次
解题方法
7 . 一种用于合成治疗免疫疾病药物的物质,其结构如图所示,其中X、Y、Z、Q、W为1~20号元素且原子序数依次增大,乙与Q同主族,Q和W的简单离子具有相同的电子层结构。
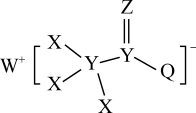
(1)W在元素周期表中的位置为_______ 。
(2)五种元素原子半径由大到小的顺序为_______ (用元素符号表。示),Z、Q、W的离子半径最小的是_______ (填离子符号)。
(3)元素W、Z可形成化合物 ,用电子式表示
,用电子式表示 的形成过程:
的形成过程:_______ (用元素符号表示)。
(4) 的水化物与Al反应的化学方程式为
的水化物与Al反应的化学方程式为_______ 。
(5)元素W的金属性_______ (填“>”或“<”)元素Na的金属性,下列方法可证明这一事实的是_______ (填字母)。
a.比较元素W的单质和Na单质分别与水反应的剧烈程度
b.比较元素W与Na最高价氧化物对应水化物碱性的强弱
c.比较常温下W的单质与Na的单质的物理状态
d.比较二者原子半径的大小

(1)W在元素周期表中的位置为
(2)五种元素原子半径由大到小的顺序为
(3)元素W、Z可形成化合物
 ,用电子式表示
,用电子式表示 的形成过程:
的形成过程:(4)
 的水化物与Al反应的化学方程式为
的水化物与Al反应的化学方程式为(5)元素W的金属性
a.比较元素W的单质和Na单质分别与水反应的剧烈程度
b.比较元素W与Na最高价氧化物对应水化物碱性的强弱
c.比较常温下W的单质与Na的单质的物理状态
d.比较二者原子半径的大小
您最近一年使用:0次
名校
解题方法
8 . A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请回答下列问题。
(1)A在元素周期表中的位置为___________ ,画出基态B原子的轨道表示式___________ 。
(2)B的简单气态氢化物的沸点___________ (填“高于”或“低于”)PH3,原因是___________ 。
(3)A、B、C三种元素的电负性由高到低的排列次序为___________ (用元素符号表示)。
(4)已知元素A、B形成的 链状分子中所有的原子都满足8电子稳定结构,则其分子中
链状分子中所有的原子都满足8电子稳定结构,则其分子中 键与
键与 键数目之比为
键数目之比为___________ 。
(5)G元素可形成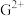 、
、 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是___________ 。
(6)短周期元素 与元素
与元素 在周期表中的位置呈现对角线关系,已知元素
在周期表中的位置呈现对角线关系,已知元素 、
、 的电负性分别为1.5和3.0,预测它们形成的化合物是
的电负性分别为1.5和3.0,预测它们形成的化合物是___________ (填“离子”或“共价”)化合物。推测 的最高价氧化物对应的水化物
的最高价氧化物对应的水化物___________ (填“能”或“不能”)与 的最高价氧化物对应水化物发生反应。
的最高价氧化物对应水化物发生反应。
| A | 原子核外有6个电子 |
| B | 原子序数比 大1 大1 |
| C | 基态原子中 电子总数与p电子总数相等 电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子价层电子排布式为3s23p1 |
| F | 基态原子的最外层p 轨道有2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 生活中使用最多的一种金属,其高价氯化物的盐溶液常用于刻蚀铜制印刷电路板 |
(2)B的简单气态氢化物的沸点
(3)A、B、C三种元素的电负性由高到低的排列次序为
(4)已知元素A、B形成的
 链状分子中所有的原子都满足8电子稳定结构,则其分子中
链状分子中所有的原子都满足8电子稳定结构,则其分子中 键与
键与 键数目之比为
键数目之比为(5)G元素可形成
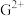 、
、 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是(6)短周期元素
 与元素
与元素 在周期表中的位置呈现对角线关系,已知元素
在周期表中的位置呈现对角线关系,已知元素 、
、 的电负性分别为1.5和3.0,预测它们形成的化合物是
的电负性分别为1.5和3.0,预测它们形成的化合物是 的最高价氧化物对应的水化物
的最高价氧化物对应的水化物 的最高价氧化物对应水化物发生反应。
的最高价氧化物对应水化物发生反应。
您最近一年使用:0次
2022-07-25更新
|
981次组卷
|
3卷引用:陕西省西安市莲湖区2021-2022学年高二下学期期末质量检测化学(B卷)试题
解题方法
9 . 如图是部分短周期主族元素的原子序数与其最高或最低化合价的关系图(用原子序数代表所对应的元素),已知a为元素周期表中相对原子质量最小的元素,请回答下列问题:
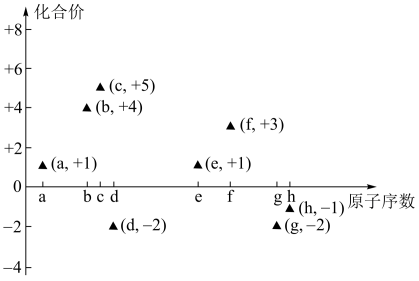
(1)b在元素周期表中的位置是_______ ;元素e和g组成的化合物的电子式为_______ 。
(2)d、f、g、h四种元素的简单离子半径由大到小的顺序为_______ (用离子符号表示)。
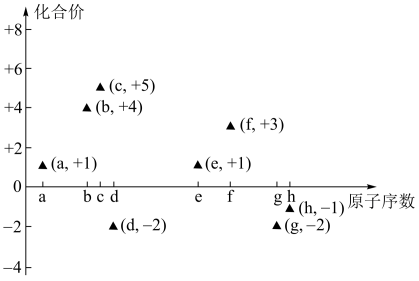
(1)b在元素周期表中的位置是
(2)d、f、g、h四种元素的简单离子半径由大到小的顺序为
您最近一年使用:0次
名校
10 . 已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:
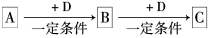
(1)若D是具有氧化性的单质,A元素属于元素周期表中前18号中的金属元素,则C的化学式为_______ ,3.9g该物质中含有阴离子的数目约为_______ 。
(2)若D是金属,C溶液在贮存时应加入少量D,其理由是(用必要的文字和离子方程式说明)___ 。
(3)若D是一种无色无味的气体,A是一种常见的强碱,且其焰色反应为黄绿色。则B转化为C的化学方程式为_______ 。
(4)若D为烧碱,B具有两性,则B转化为C反应的离子方程式为_______ 。
(5)若A是淡黄色固体单质,描述检验气体B的实验操作_______ 。
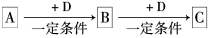
(1)若D是具有氧化性的单质,A元素属于元素周期表中前18号中的金属元素,则C的化学式为
(2)若D是金属,C溶液在贮存时应加入少量D,其理由是(用必要的文字和离子方程式说明)
(3)若D是一种无色无味的气体,A是一种常见的强碱,且其焰色反应为黄绿色。则B转化为C的化学方程式为
(4)若D为烧碱,B具有两性,则B转化为C反应的离子方程式为
(5)若A是淡黄色固体单质,描述检验气体B的实验操作
您最近一年使用:0次



